Energías de ionización de los elementos del bloque s y p
Las energías de ionización de los elementos de la tercera fila de la tabla periódica presentan el mismo patrón que las de \(Li\) y \(Be\) (Tabla \(\PageIndex{2}\): las energías de ionización sucesivas aumentan constantemente a medida que los electrones se eliminan de los orbitales de valencia (3s o 3p, en este caso), seguido de un aumento especialmente grande de la energía de ionización cuando los electrones se eliminan de los niveles del núcleo lleno, como se indica por la línea diagonal en negrita en la Tabla \(\PageIndex{2}\). Así, en la tercera fila de la tabla periódica, el mayor aumento de la energía de ionización corresponde a la eliminación del cuarto electrón de \(Al\), el quinto electrón de Si, y así sucesivamente, es decir, la eliminación de un electrón de un ion que tiene la configuración electrónica de valencia del gas noble anterior. Este patrón explica por qué la química de los elementos normalmente implica sólo electrones de valencia. Se requiere demasiada energía para eliminar o compartir los electrones internos.
| Elemento | (I_1) | (I_2) | (I_3) | (I_4) | (I_5) | (I_6) | (I_7) |
|---|---|---|---|---|---|---|---|
| *Este electrón de cáscara internashell electron | |||||||
| Na | 495.8 | 4562,4* | – | – | – | – | – |
| Mg | 737.7 | 1450.7 | 7732.7 | – | – | – | |
| Al | 577.4.4 | 1816.7 | 2744.8 | 11.577.4.4 | – | – | |
| Si | 786.5 | 1577.1 | 3231.6 | 4355.5 | 16.090.6 | – | – |
| P | 1011.8 | 1907.4.4 | 2914.1 | 4963.6 | 6274.0 | 21,267.4.3 | – |
| S | 999.6 | 2251.8 | 3357 | 4556.2 | 7004.3 | 8495.8 | 27,107.4,3 |
| Cl | 1251,2 | 2297,7 | 3822 | 5158.6 | 6540 | 9362 | 11.018,2 |
| Ar | 1520.6 | 2665.9 | 3931 | 5771 | 7238 | 8781.0 | 11,995.3 |
Ejemplo \(\PageIndex{1}\): Mayor energía de cuarta ionización
A partir de sus ubicaciones en la tabla periódica, prediga cuál de estos elementos tiene la mayor energía de cuarta ionización: B, C o N.
Dado: tres elementos
Se pide: elemento con mayor cuarta energía de ionización
Estrategia:
- Enumere la configuración de electrones de cada elemento.
- Determine si los electrones se eliminan de una capa de valencia llena o parcialmente llena. Predecir qué elemento tiene la cuarta energía de ionización más alta, reconociendo que la energía más alta corresponde a la eliminación de electrones de un núcleo de electrones lleno.
Solución:
A Todos estos elementos se encuentran en la segunda fila de la tabla periódica y tienen las siguientes configuraciones electrónicas:
- B: 2s22p1
- C: 2s22p2
- N: 2s22p3
B La cuarta energía de ionización de un elemento (\(I_4\)) se define como la energía necesaria para eliminar el cuarto electrón:
\7380>
Dado que el carbono y el nitrógeno tienen cuatro y cinco electrones de valencia, respectivamente, sus energías de cuarta ionización corresponden a la eliminación de un electrón de una capa de valencia parcialmente llena. La cuarta energía de ionización para el boro, sin embargo, corresponde a la eliminación de un electrón de la subcáscara 1s2 llena. Esto debería requerir mucha más energía. Los valores reales son los siguientes: B, 25.026 kJ/mol; C, 6223 kJ/mol; y N, 7475 kJ/mol.
Ejercicio \N(\PageIndex{1}\N): Segunda energía de ionización más baja
A partir de sus ubicaciones en la tabla periódica, prediga cuál de estos elementos tiene la segunda energía de ionización más baja: Sr, Rb, o Ar.
Respuesta
(\ce{Sr}\})
La primera columna de datos de la Tabla (\ce{{2}\}) muestra que las energías de primera ionización tienden a aumentar a través de la tercera fila de la tabla periódica. Esto se debe a que los electrones de valencia no se apantallan muy bien entre sí, lo que permite que la carga nuclear efectiva aumente constantemente a lo largo de la fila. Por lo tanto, los electrones de valencia son atraídos con más fuerza hacia el núcleo, por lo que los tamaños atómicos disminuyen y las energías de ionización aumentan. Estos efectos representan dos caras de la misma moneda: las interacciones electrostáticas más fuertes entre los electrones y el núcleo aumentan aún más la energía requerida para eliminar los electrones.
Sin embargo, la primera energía de ionización disminuye en Al (3s23p1) y en S (3s23p4). Las configuraciones electrónicas de estas «excepciones» proporcionan la respuesta al porqué. Los electrones de la subcélula 3s2 llena del aluminio son mejores para apantallar el electrón 3p1 que para apantallarse de la carga nuclear, por lo que los electrones s penetran más cerca del núcleo que el electrón p y el electrón p se elimina más fácilmente. La disminución en el S se produce porque los dos electrones en el mismo orbital p se repelen. Esto hace que el átomo de S sea ligeramente menos estable de lo que cabría esperar, como ocurre con todos los elementos del grupo 16.
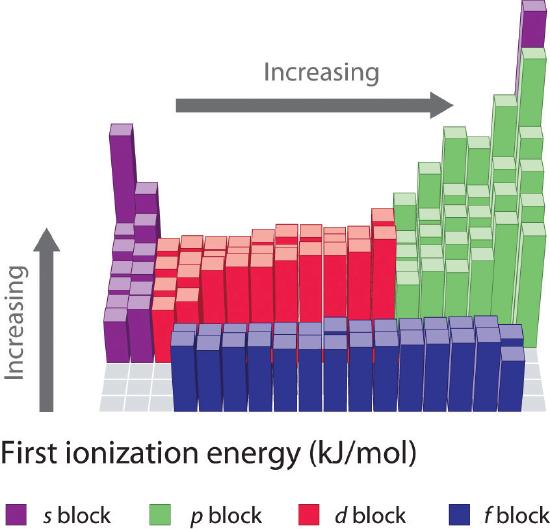
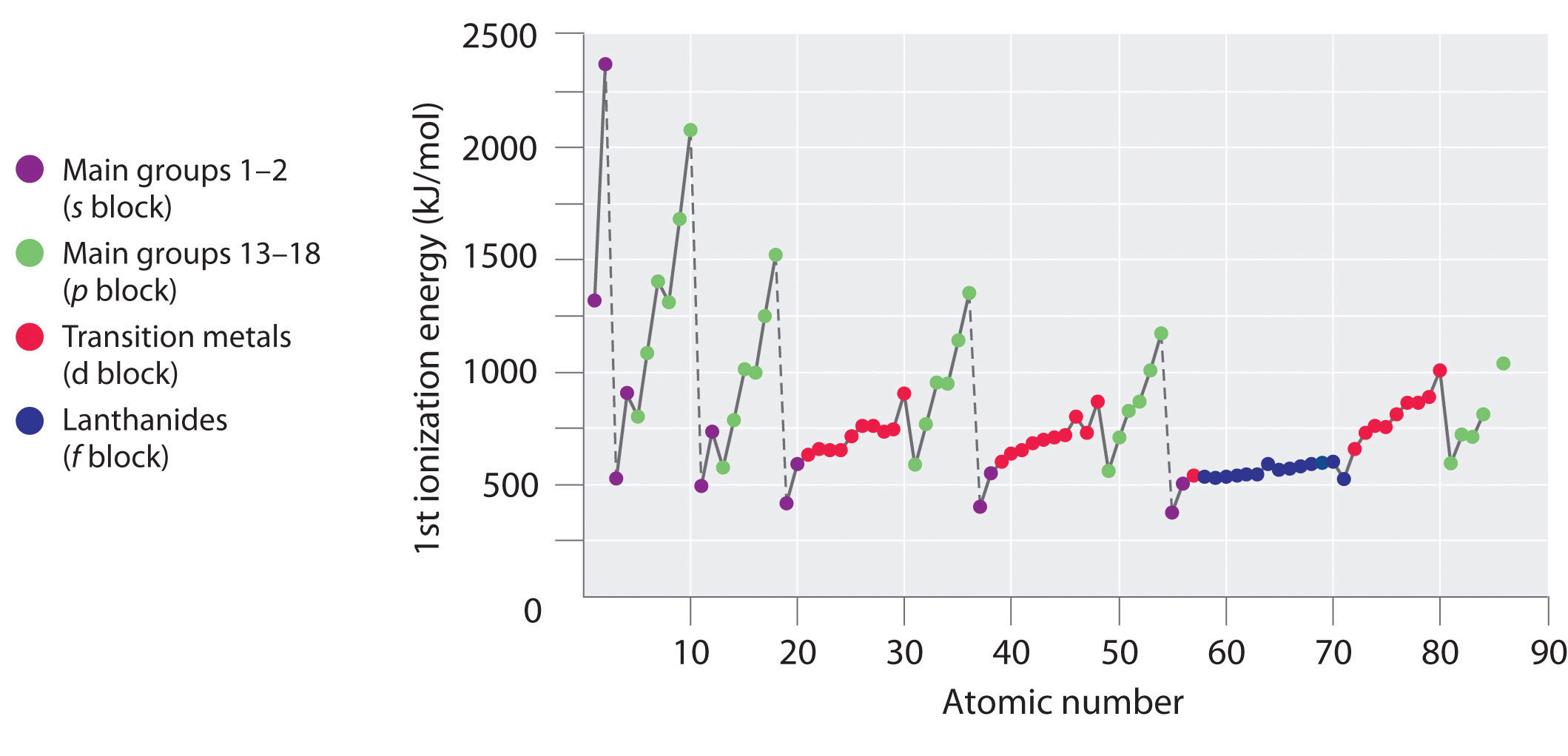
Las energías de primera ionización de los elementos de las seis primeras filas de la tabla periódica se representan en la Figura \(\PageIndex{1}) y se presentan numérica y gráficamente en la Figura \(\PageIndex{2}). Estas figuras ilustran tres tendencias importantes:
- Los cambios observados en las filas segunda (Li a Ne), cuarta (K a Kr), quinta (Rb a Xe) y sexta (Cs a Rn) de los bloques s y p siguen un patrón similar al descrito para la tercera fila de la tabla periódica. Sin embargo, los metales de transición están incluidos en las filas cuarta, quinta y sexta, y los lantánidos están incluidos en la sexta fila. Las primeras energías de ionización de los metales de transición son algo similares entre sí, al igual que las de los lantánidos. Las energías de ionización aumentan de izquierda a derecha en cada fila, con discrepancias en ns2np1 (grupo 13), ns2np4 (grupo 16) y ns2(n – 1)d10 (grupo 12).
- Las energías de primera ionización generalmente disminuyen hacia abajo en una columna. Aunque el número cuántico principal n aumenta hacia abajo en una columna, las envolturas interiores llenas son eficaces para apantallar los electrones de valencia, por lo que hay un aumento relativamente pequeño en la carga nuclear efectiva. En consecuencia, los átomos se hacen más grandes a medida que adquieren electrones. Los electrones de valencia que están más alejados del núcleo están menos ligados, por lo que son más fáciles de eliminar, lo que hace que las energías de ionización disminuyan. Un radio más grande suele corresponder a una energía de ionización más baja.
- Debido a las dos primeras tendencias, los elementos que forman iones positivos con más facilidad (tienen las energías de ionización más bajas) se encuentran en la esquina inferior izquierda de la tabla periódica, mientras que los que son más difíciles de ionizar se encuentran en la esquina superior derecha de la tabla periódica. En consecuencia, las energías de ionización generalmente aumentan en diagonal desde la parte inferior izquierda (Cs) a la superior derecha (He).

Generalmente, la energía de ionización (I_1\) aumenta en diagonal desde la parte inferior izquierda de la tabla periódica hacia la parte superior derecha.
El galio (Ga), que es el primer elemento que sigue a la primera fila de metales de transición, tiene la siguiente configuración electrónica: 4s23d104p1. Su primera energía de ionización es significativamente menor que la del elemento inmediatamente anterior, el zinc, porque la subcapa 3d10 llena del galio se encuentra dentro de la subcapa 4p, protegiendo el único electrón 4p del núcleo. Los experimentos han revelado algo aún más interesante: los electrones segundo y tercero que se eliminan cuando el galio se ioniza provienen del orbital 4s2, no de la subesfera 3d10. La química del galio está dominada por el ion Ga3+ resultante, con su configuración electrónica 3d10. Ésta y otras configuraciones electrónicas similares son particularmente estables y se encuentran a menudo en los elementos más pesados del bloque p. A veces se denominan configuraciones de gas pseudo noble. De hecho, para los elementos que presentan estas configuraciones, no se conoce ningún compuesto químico en el que se eliminen los electrones de la subcélula llena (n – 1)d10.