Las células reguladoras T (Tregs), anteriormente conocidas como células supresoras T, son un subconjunto de células T con funciones directas tanto en la autoinmunidad como en las respuestas a los patógenos.
Las Tregs disminuyen la inflamación a través de la secreción de citoquinas inmunosupresoras (IL-10, TGF-b) y también a través de la supresión directa de las células T efectoras inflamatorias (como las células Th1 y Th17).
Las Tregs controlan y probablemente previenen las enfermedades autoinmunes al contribuir al mantenimiento de la tolerancia a los autoantígenos. El beneficio terapéutico de la transferencia de Treg está bien establecido en modelos animales y se están realizando esfuerzos para iniciar terapias con Treg en humanos para trasplantes y pacientes con diabetes de tipo 1.
Dada la importancia de este subconjunto único de células T en tantas respuestas inmunitarias, muchos investigadores se sienten negligentes si inmunofenotipan sus poblaciones celulares de interés sin incluir una medición de Treg en la mezcla. Pero cuantificar las Tregs puede ser complicado.
Por ejemplo, ¿cuáles son los mejores marcadores a utilizar? ¿Cómo se sabe con seguridad que se están midiendo verdaderas células T supresoras?
Estrategias de gating para definir las Tregs por citometría de flujo
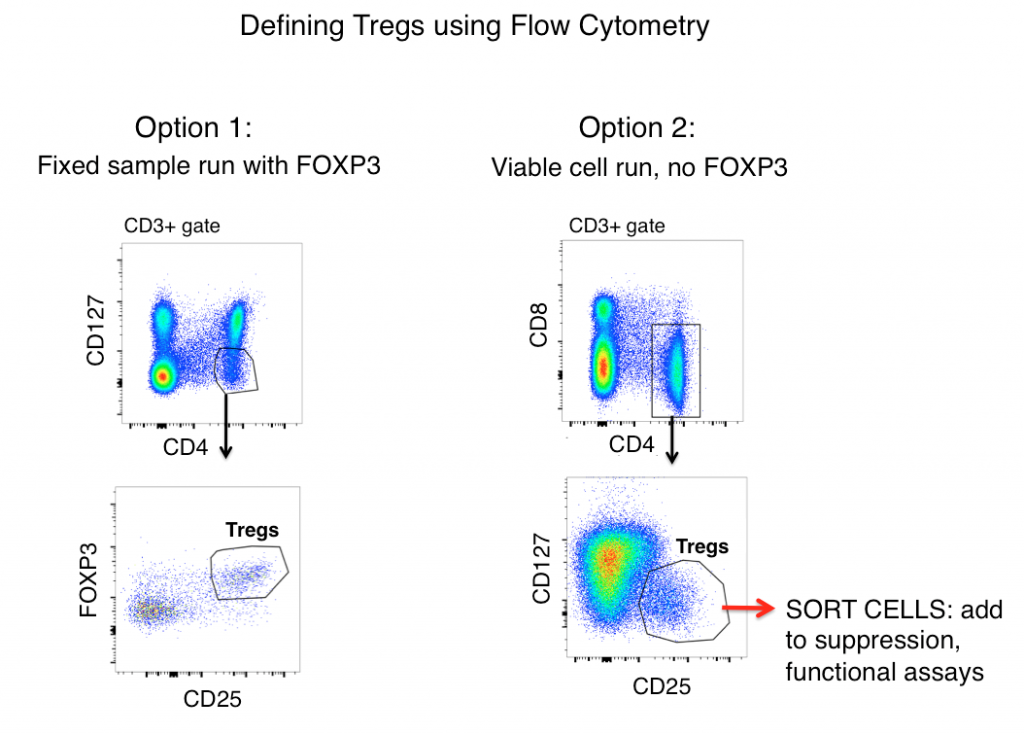
La estrategia de gating estándar de las Tregs para muestras de ratón y humanas (después de gatear primero los dobletes y gatear en células vivas) incluye los antígenos CD3, CD4, CD25, FOXP3 y CD127.
Cuando se observa únicamente la expresión del antígeno, las Tregs se definen a menudo como CD3+, CD4+, CD25hi, FOXP3+ y CD127lo (mostrado en la figura de abajo como Opción 1). Utilizando estos marcadores, una población clara es a menudo visible a partir de muestras tales como esplenocitos de ratón y PBMC humanas.
Sin embargo, las células T activadas a menudo regulan al alza CD25, y la expresión de FOXP3 se ha encontrado en linajes de células T «efectoras» (no supresivas). Por lo tanto, cuando se confía en el fenotipo de la citometría de flujo únicamente para definir las Tregs, las células T inflamatorias podrían ser un lobo con piel de cordero (Treg) y conducir a una interpretación incorrecta de los datos.
Una célula puede parecer un pato, pero ¿grazna? La medición de las funciones efectoras de su posible población de Tregs ayudará en gran medida a dilucidar la exactitud de su estrategia de gating de flujo. Para determinar si las células que está definiendo como Tregs se asemejan funcionalmente a ellas, la Opción 2 (ver abajo) incluye omitir FOXP3 de su panel, clasificar las células CD3+, CD4+, CD25hi, CD127lo, y luego determinar las funciones de su población «Treg» a través del análisis de citoquinas y/o ensayos de co-cultivo de supresión con células T no Treg (CD3+ CD4+ CD25-, CD127hi). Normalmente, FOXP3 no puede incluirse en paneles en los que se requieren células viables después de la clasificación, ya que se requiere la tinción intracelular.
Definición de la creciente variedad de subconjuntos Treg
Hay muchos tipos de Tregs, incluyendo tTregs, pTregs e iTregs.
Por ejemplo, las tTregs (también conocidas como nTregs) se generan en el timo y tienen un repertorio de TcR que se inclina hacia los autopéptidos. Otro sabor, conocido como pTregs, se genera en la periferia, y las iTregs se inducen en cultivo a través del TGF-b.
Hay fabricantes asociados a estos diversos subconjuntos de Tregs y deben considerarse para su inclusión en un panel de anticuerpos de Tregs si su subconjunto es de interés. Por ejemplo, en humanos, CD39 se considera un marcador fiable de tTreg. Además, tanto en ratones como en humanos, se ha descubierto que Helios distingue de forma fiable los tTregs de los subconjuntos p, e iTreg.
Definir una sola célula como Treg-¿Es posible?
Una limitación importante en el campo de los Treg es la falta de un ensayo de supresión de una sola célula.
Definir una célula T individual como miembro de un linaje de memoria distinto, como Th1, Th2 o Th17, puede lograrse a través de un análisis analítico con resolución de célula única, como la tinción de citoquinas intracelulares, ya que estas células se definen principalmente, si no exclusivamente, por las citoquinas que producen.
Sin embargo, para demostrar que una sola célula es una Treg, lo ideal es poder cuantificar que esta célula elegida puede suprimir la función de las células T efectoras (u otros subconjuntos celulares) en cocultivo. Actualmente, la única forma de comprobar la función supresora de las Tregs es en un cultivo masivo, donde se puede concluir que algunas (pero no todas, posiblemente ni siquiera la mayoría) de las células designadas como Tregs son supresoras.
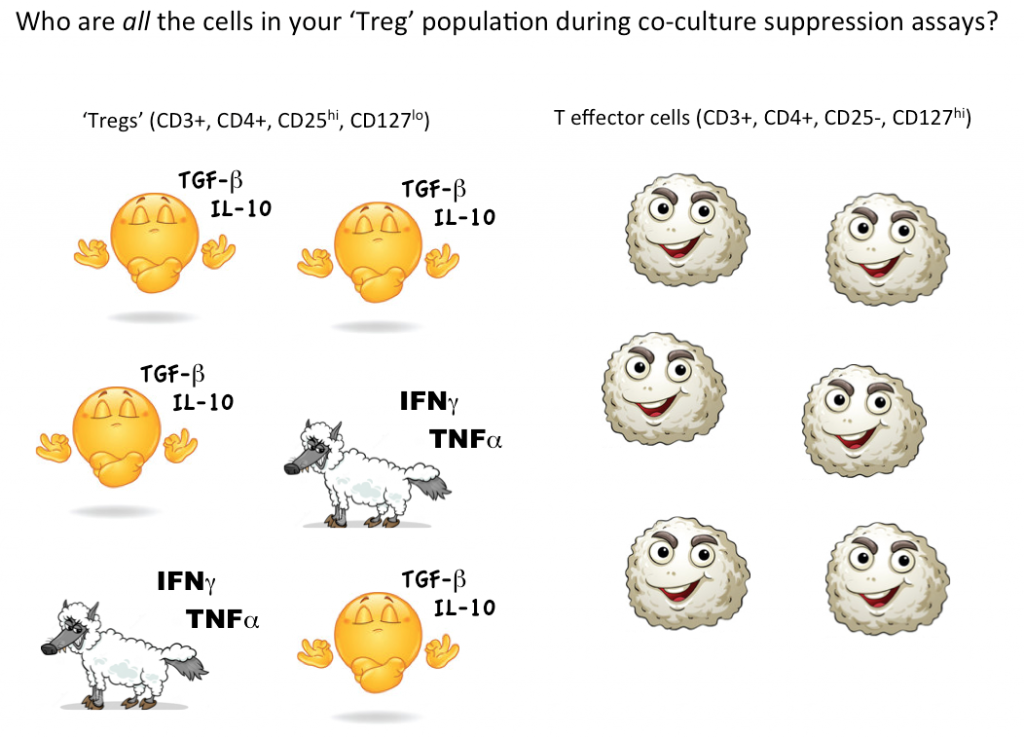
Pensando de nuevo en los potenciales lobos con piel de cordero de las «células T efectoras», simplemente no sabemos cuántas células no supresoras, incluso inflamatorias, se esconden en nuestra estrategia de gating de las Tregs. El uso de la citometría de flujo para primero seleccionar y clasificar las células viables con marcadores consistentes con las Tregs, y luego probar funcionalmente para ver si, como grupo, las células definidas por su estrategia de selección actúan realmente como Tregs, es actualmente la mejor manera de cuantificar las Tregs en su muestra.
Ejecutando las estrategias de selección correctas para definir las Tregs por citometría de flujo y teniendo en cuenta el creciente número de subconjuntos de Tregs, usted puede separar sus poblaciones Treg de interés. La clave es probar estas poblaciones funcionalmente después de identificarlas porque actualmente es difícil, si no imposible, definir una sola célula como Treg. Sin embargo, se están produciendo avances a diario y, con el tiempo, será posible etiquetar correctamente las células Treg individuales.
Para obtener más información sobre el análisis de las células T y otros tipos de células mediante citometría de flujo, y para acceder a todos nuestros materiales avanzados, incluidos 20 vídeos de formación, presentaciones, libros de trabajo y la pertenencia a un grupo privado, inscríbase en la lista de espera de la clase de maestría en citometría de flujo.
 .
.