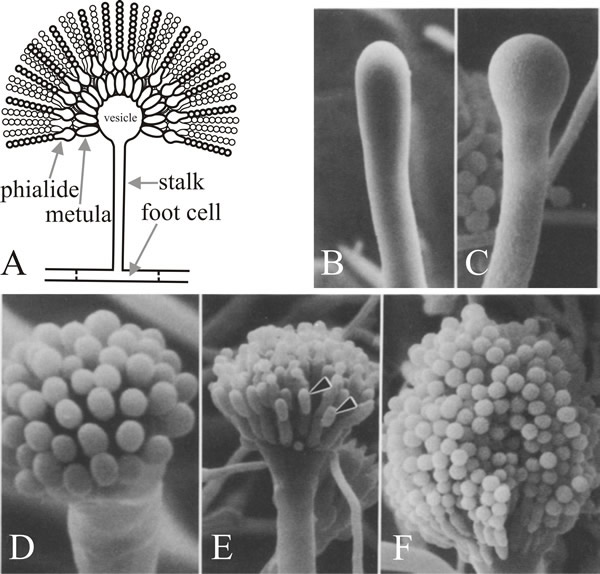
Buňka, z níž vyrůstá větévka, je nožní buňka konidioforu, která se od ostatních vegetativních buněk liší tím, že má na vnitřní straně své původní stěny hnědě pigmentované sekundární ztluštění. Stopka roste apikálně, dokud nedosáhne délky asi 100 µm, kdy se vrchol zvětšuje a vytváří konidioforový měchýřek, který má průměr asi 10 µm. Z vezikuly pak vyrůstá jedna vrstva četných primárních sterigmat, nazývaných metuly, a z obnažených vrcholů metul vyrůstají sekundární sterigmata, fialidy. Fialidy jsou kmenové buňky, které následně procházejí opakovaným asymetrickým dělením a vytvářejí dlouhé řetězce enteroblastických konidií o průměru přibližně 3 µm (obr. 7).
Klasická genetická analýza pomocí izolace a analýzy mutantů stanovila základní genetické schéma konidiace rodu Aspergillus. Porovnáním frekvencí mutací v lokusech ovlivňujících konidiaci s frekvencemi mutací pro jiné funkce bylo odhadnuto, že se konidiace týká 300 až 1 000 genových lokusů (Martinelli & Clutterbuck, 1971). Analýza druhů mRNA ukázala, že přibližně 6 000 je exprimováno ve vegetativním myceliu a dalších 1 200 se nachází v kulturách, které zahrnují konidiofory a konidie; 200 z těchto dalších mRNA se nachází v samotných konidiích. Pouze asi 2 % mutantů A. nidulans, kteří postrádali konidie, mělo defekty ve fázích týkajících se růstu a vývoje konidioforů a 85 % konidiových mutantů mělo rovněž defekty v růstu vegetativních hyf a v dosažení kompetice.
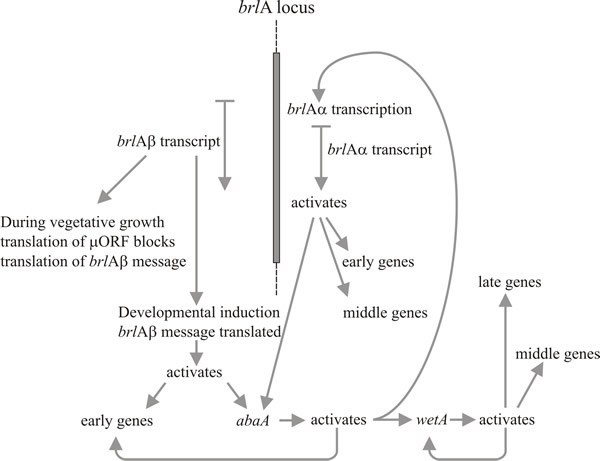
Zejména dva geny hrají klíčovou roli v morfogenezi konidioforů: jedná se o gen „bristle“ (brlA), který má defekty v tvorbě vezikul a metul, a gen „abacus“ (abaA), u něhož jsou konidie nahrazeny korálkovými délkami hyf, takže je pravděpodobně defektní v pučení konidií z fialid a konečné septaci. Třetí gen, wetA, je defektní v rané fázi zrání spór. Konidie mutantů wetA postrádají pigment a hydrofobicitu; po několika hodinách autolyzují a neexprimují řadu mRNA specifických pro spory. Transkript genu wetA chybí u mutantů brlA a abaA (tj. brlA a abaA jsou epistatické vůči wetA) a studie dvojitých mutantů ukazují, že tyto tři geny působí v pořadí: brlA → abaA → wetA.
Nápadným rysem mutační analýzy vývoje konidioforů u A. nidulans je, že mutanty pouze těchto tří genů způsobují defekty v morfogenezi konidioforů a spor, zatímco až 1 000 dalších genových lokusů způsobuje při mutaci absenci konidiace. To znamená, že brlA, abaA a wetA jsou regulátory, které integrují expresi jiných genů, které jsou potřebné pro konidiaci, ale samy se jí nevěnují. Mnoho konidiačních mutantů rodu Aspergillus bylo také defektních v pohlavním rozmnožování, takže další závěr, který lze vyvodit, je, že existuje určitá ekonomie využití morfogenetických genů v různých vývojových procesech. Je pravděpodobné, že různé způsoby vývoje využívají strukturní geny, které nejsou jedinečně vývojové, ale fungují v mnoha drahách a jejich vývojová specifičnost je dána regulátory, na které reagují. To vystihuje myšlenka, že klíč k vývoji eukaryot spočívá ve schopnosti využívat relativně málo regulačních genů k integraci aktivit mnoha jiných.
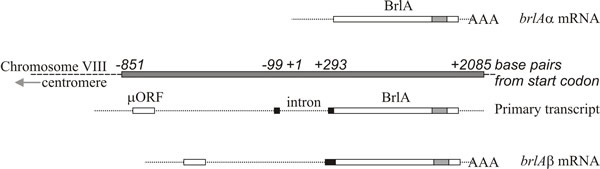
Molekulární analýza podporuje interpretaci, že brlA, abaA a wetA jsou regulátory; sekvence brlA kóduje protein zinkového prstu, který je sekvenčně specifickým DNA vazebným transkripčním aktivátorem vývojově regulovaných cílových genů (obr. 8). To však není celý příběh, protože produkt brlA má různou afinitu k různým cílovým genům. Lokus brlA se totiž skládá z překrývajících se transkripčních jednotek (obr. 9), přičemž downstreamová jednotka se označuje brlAα a upstreamová jednotka brlAβ; jejich produkty mezi sebou řeší dva klasické vývojové problémy, jak reagovat na signál a jak tuto reakci udržet, když se signál rozptýlí.
Dvě transkripční jednotky brlA sdílejí po většinu své délky stejný čtecí rámec, ale brlAβ má na aminoterminálním konci tohoto čtecího rámce dalších 23 aminokyselinových zbytků a jeho transkript má také samostatný čtecí rámec o 41 aminokyselinových zbytcích (tzv. µORF) v blízkosti svého 5′ terminálu. Produkt µORF potlačuje translaci z následného čtecího rámce (BrlA), a přestože lze transkript brlAβ detekovat ve vegetativních hyfách, peptid BrlA se netvoří. Represe způsobená µORF je překonána pouze tehdy, když je mycelium kompetentní, což je pravděpodobně signalizováno jako omezení dusíku (běžný environmentální signál pro zahájení sporulace u Ascomycota), který snižuje zásoby aminoacyl-tRNA a narušuje translační regulaci pomocí µORF. Když je účinek µORF zastaven, může být peptid BrlA přeložen z existujícího transkriptu.
Objevitel tohoto procesu popsal aktivaci konidiační dráhy jako „translační spouštění“ (Timberlake, 1993), což naznačuje, že translační spouštění je způsob, jak učinit diferenciaci citlivou na nutriční stav hyfy. Kompetentní hyfa je tedy připravena zahájit vývoj konidioforu, ale nevratné aktivaci konidiační dráhy brání translační represe, která udržuje vegetativní růst, dokud nejsou ideální podmínky pro sporulaci.
Aktivace brlA je tedy považována za první krok ve vývoji konidioforu a jeho produkt zase aktivuje panel genů specifických pro konidiaci, mezi nimiž je další regulátor, abaA. Produkt abaA je rovněž DNA-vázaný transkripční regulační protein, který zvyšuje expresi strukturních genů indukovaných brlA. Geny brlA a abaA jsou recipročními aktivátory, protože abaA aktivuje také brlA. K expresi brlA musí samozřejmě dojít dříve, než může být exprimován abaA, ale následná aktivace brlA abaA posiluje expresi brlA a účinně činí postup dráhy nezávislým na vnějších událostech. Produkt abaA rovněž aktivuje další strukturní geny a poslední regulační gen wetA, který aktivuje strukturní geny specifické pro spory. Jelikož brlA a abaA nejsou v diferencujících se konidiích exprimovány, wetA se pravděpodobně podílí na deaktivaci jejich exprese ve sporách (a možná také ve fialidách; jakmile aktuální jádro spory dosáhne stadia zrání, které potřebuje geny regulované wetA, musí se jádra fialid „vrátit“ do stavu iniciace konidií, aby se mohla začít tvořit další spora). Exprese wetA je ve fialidě zpočátku aktivována postupným působením brlA a abaA a poté je autoregulována (produkt wetA aktivuje transkripci wetA). Pozitivní autoregulace wetA následně udržuje jeho expresi i po oddělení konidia (fyzicky a cytologicky) od fialidy.
Timberlake (1993) nazval tento mechanismus zpětnovazebnou fixací: vzájemná aktivace, zpětnovazební aktivace a autoregulace základních regulačních sekvencí posilují expresi celé dráhy, čímž ji činí nezávislou na podnětech vnějšího prostředí, které ji iniciovaly, a umožňují spóře pokračovat ve zrání i po oddělení od fialidy. Vývoj konidioforu je stejně jako mnoho jiných morfogenetických procesů přirozeně rozdělen do sekvenčních kroků. Tato regulační síť ukazuje, jak může translační spouštění propojit morfogenetickou dráhu s vývojem kompetence na jedné straně a s iniciací v reakci na environmentální narážku (narážky) na straně druhé. Následně po iniciaci vede zpětnovazební fixace k vývojové determinaci v klasickém embryologickém smyslu pokračující morfogeneze, i když je odstraněna z iniciačního prostředí.
Záměrně jsme se v této části rozhodli založit náš popis na výzkumu provedeném zhruba před 50 lety, který začal izolací velkého počtu mutací se změněnými fenotypy konidií a pokračoval „klasickými“ studiemi genových segregací a genové komplementace (Martinelli & Clutterbuck, 1971). Kromě toho, že ukazuje, jak bylo dosaženo našeho porozumění sporulaci, ukazuje hodnotu používání těchto „staromódních“ technik ke zkoumání těchto jevů.
Nemůžeme však ignorovat rozsáhlý výzkum, který byl dokončen v oblasti molekulárních mechanismů, jež jsou základem růstu a vývoje Aspergillus. Tyto studie potvrdily, že klíčovou událostí při sporulaci je aktivace transkripčního faktoru zinkového prstu kódovaného genem brlA a že geny abaA a wetA jsou nezbytnými regulátory konidiace. Transkripční faktor kódovaný genem abaA je aktivován genem brlA po diferenciaci metulí a ve středních fázích vývoje konidioforu a genwetA, aktivovaný genem abaA, funguje v pozdní fázi konidiace a řídí syntézu klíčových složek buněčné stěny a mění metabolismus zrajícího konidia. U Aspergillus nidulans tyto tři geny vytvářejí centrální regulační dráhu, která spolu s dalšími geny řídí expresi genů specifických pro konidiaci a posloupnost aktivace genů podílejících se na získání vývojové kompetence, vývoji konidioforu a zrání spór (Lee et al., 2016).
Mnoho aspektů těchto vývojových drah bylo konzervováno u jiných aspergilií. Příslušníci rodu Aspergillus patří mezi nejčastěji se vyskytující houby a všichni se rozmnožují nepohlavně tvorbou dlouhých řetězců konidií. Několik druhů, včetně Aspergillus oryzae a Aspergillus niger, se používá v průmyslu pro výrobu enzymů a zpracování potravin; zatímco Aspergillus flavus je zodpovědný za kažení potravin produkcí nejsilnějších známých přirozeně se vyskytujících karcinogenů, aflatoxinů. Dalším znepokojivým druhem je oportunní lidský patogen Aspergillus fumigatus, který produkuje obrovské množství malých hydrofobních konidií jako hlavní způsob šíření a stal se ve vyspělých zemích rozšířeným vzdušným houbovým patogenem. U pacientů s oslabenou imunitou způsobuje A. fumigatus invazivní aspergilózu, která má vysokou úmrtnost. Vývojová signální dráha BrlA-AbaA-WetA byla zachována při konidiaci těchto druhů rodu Aspergillus (Yu, 2010; Tao & Yu, 2011; Krijgsheld et al., 2013). Proteomické, transkriptomické a metabolomické studie dále poskytly podrobný obraz dynamických změn, ke kterým dochází v mnoha tisících genů, transkriptů, enzymů a metabolických reakcí během tvorby, zrání, dormance a klíčení konidií Aspergillus (van Leeuwen et al., 2013; Novodvorska et al., 2016; Teertstra et al., 2017).
Aktualizováno v červenci 2019