Ionizační energie prvků s- a p-bloku
Ionizační energie prvků ve třetím řádku periodické tabulky vykazují stejný vzorec jako energie \(Li\) a \(Be\) (tabulka \(\PageIndex{2}\): postupné ionizační energie se postupně zvyšují, když jsou elektrony odebírány z valenčních orbitalů (v tomto případě 3s nebo 3p), po čemž následuje obzvláště velký nárůst ionizační energie, když jsou elektrony odebírány z vyplněných jaderných hladin, jak je naznačeno tučnou diagonální čarou v tabulce \(\PageIndex{2}\). Ve třetím řádku periodické tabulky tedy největší nárůst ionizační energie odpovídá odebrání čtvrtého elektronu z \(Al\), pátého elektronu ze Si atd., tj. odebrání elektronu z iontu, který má valenční elektronovou konfiguraci předchozího vzácného plynu. Tento vzorec vysvětluje, proč chemie prvků obvykle zahrnuje pouze valenční elektrony. K odebrání nebo sdílení vnitřních elektronů je zapotřebí příliš mnoho energie.
| Prvek | \(I_1\) | \(I_2\) | \(I_3\) | \(I_4\) | \(I_5\) | \(I_6\) | \(I_7\) | |
|---|---|---|---|---|---|---|---|---|
| *Inner-elektronového obalu | ||||||||
| Na | 495.8 | 4562,4* | – | – | – | – | – | – |
| Mg | 737.7 | 1450.7 | 7732.7 | – | – | – | – | – |
| Al | 577.4.4 | 1816.7 | 2744.8 | 11 577.4.4 | – | – | – | – |
| Si | 786.5 | 1577.1 | 3231.6 | 4355.5 | 16 090.6 | – | – | |
| P | 1011.8 | 1907.4.4 | 2914.1 | 4963.6 | 6274.0 | 21,267.4.3 | – | |
| S | 999.6 | 2251.8 | 3357 | 4556.2 | 7004.3 | 8495.8 | 27,107.4.3 | |
| Cl | 1251.2 | 2297.7 | 3822 | 5158.6 | 6540 | 9362 | 11 018,2 | |
| Ar | 1520.6 | 2665.9 | 3931 | 5771 | 7238 | 8781.0 | 11,995.3 | |
Příklad \(\PageIndex{1}\): Nejvyšší čtvrtá ionizační energie
Předpovězte na základě jejich umístění v periodické tabulce, který z těchto prvků má nejvyšší čtvrtou ionizační energii: B, C nebo N.
Dáno: tři prvky
Zadáno: prvek s nejvyšší čtvrtou ionizační energií
Strategie:
- Uveďte elektronovou konfiguraci každého prvku.
- Určete, zda se elektrony odebírají z naplněné nebo částečně naplněné valenční slupky. Předpovězte, který prvek má nejvyšší čtvrtou ionizační energii, přičemž si uvědomte, že nejvyšší energie odpovídá odebírání elektronů z vyplněného elektronového jádra.
Řešení:
A Všechny tyto prvky leží ve druhé řadě periodické tabulky a mají následující elektronové konfigurace:
- B: 2s22p1
- C: 2s22p2
- N: Protože uhlík a dusík mají čtyři, resp. pět valenčních elektronů, jejich čtvrtá ionizační energie (\(I_4\)) je definována jako energie potřebná k odstranění čtvrtého elektronu:
\
Protože uhlík a dusík mají čtyři, resp. pět valenčních elektronů, jejich čtvrtá ionizační energie odpovídá odstranění elektronu z částečně zaplněné valenční slupky. Čtvrtá ionizační energie boru však odpovídá odebrání elektronu ze zaplněné valenční slupky 1s2. To by mělo vyžadovat mnohem více energie. Skutečné hodnoty jsou následující: B 25 026 kJ/mol, C 6223 kJ/mol a N 7475 kJ/mol.
Cvičení \(\PageIndex{1}\): Předpovězte, který z těchto prvků má nejnižší druhou ionizační energii
Podle jejich umístění v periodické tabulce předpovězte, který z těchto prvků má nejnižší druhou ionizační energii: Odpověď
\(\ce{Sr}\)
První sloupec údajů v tabulce \(\PageIndex{2}\) ukazuje, že první ionizační energie mají ve třetím řádku periodické tabulky rostoucí tendenci. Je to proto, že valenční elektrony se navzájem příliš nestíní, což umožňuje, aby efektivní jaderný náboj napříč řadou neustále rostl. Valenční elektrony jsou proto silněji přitahovány k jádru, takže velikost atomů se zmenšuje a ionizační energie rostou. Tyto efekty představují dvě strany jedné mince: silnější elektrostatické interakce mezi elektrony a jádrem dále zvyšují energii potřebnou k odstranění elektronů.
První ionizační energie však klesá u Al (3s23p1) a u S (3s23p4). Elektronové konfigurace těchto „výjimek“ poskytují odpověď na otázku proč. Elektrony v zaplněné podskupině 3s2 hliníku lépe stíní elektron 3p1 než se navzájem stíní od jaderného náboje, takže elektrony s pronikají blíže k jádru než elektrony p a elektron p se snáze odstraňuje. K poklesu u S dochází proto, že dva elektrony ve stejném p orbitalu se navzájem odpuzují. Díky tomu je atom S o něco méně stabilní, než by se jinak očekávalo, což platí pro všechny prvky skupiny 16.
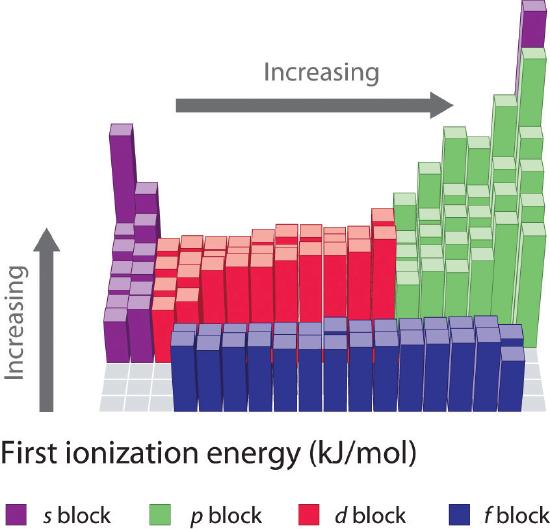
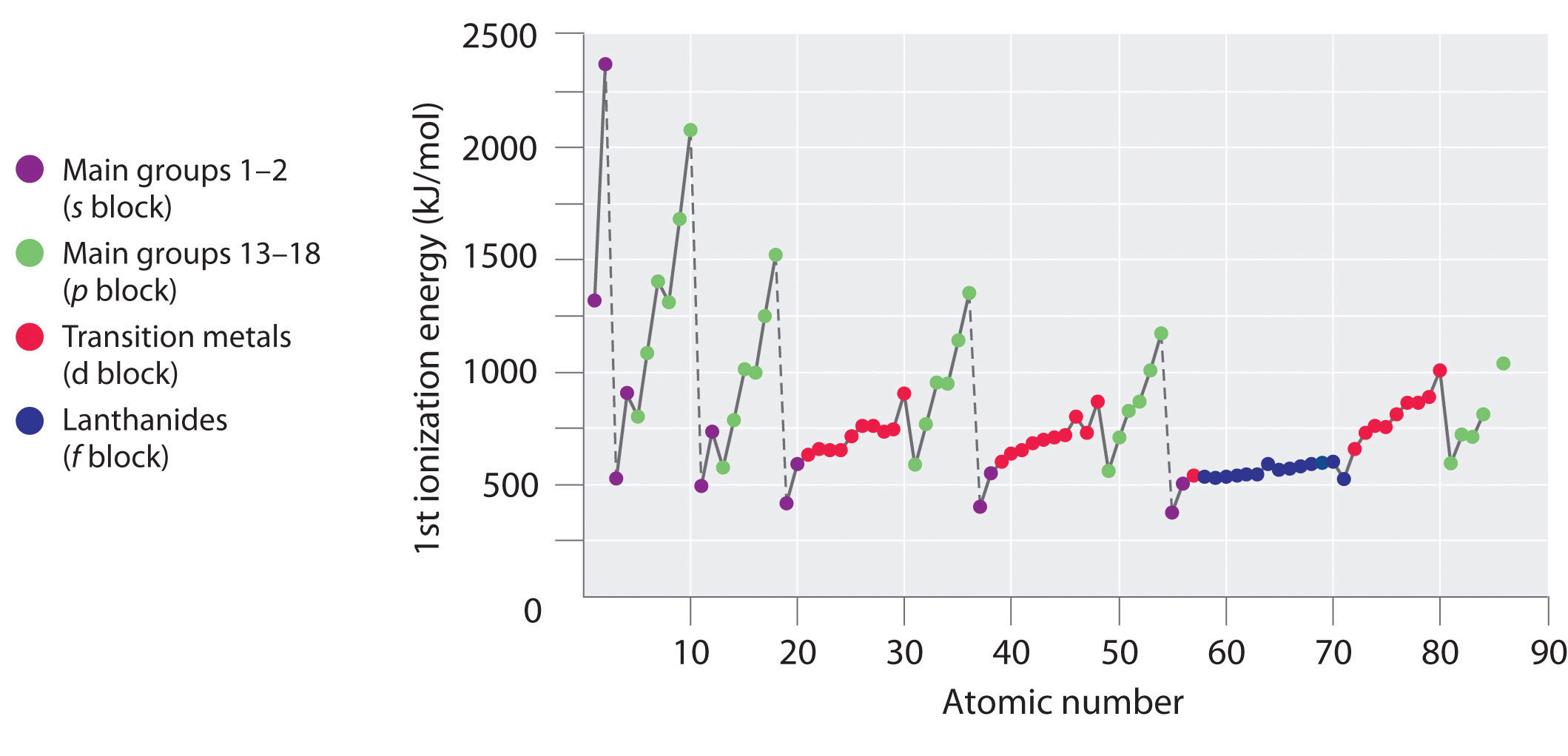
První ionizační energie prvků v prvních šesti řádcích periodické tabulky jsou vyneseny na obrázku \(\PageIndex{1}\) a numericky a graficky znázorněny na obrázku \(\PageIndex{2}\). Tyto obrázky ilustrují tři důležité trendy:
- Změny pozorované ve druhém (Li na Ne), čtvrtém (K na Kr), pátém (Rb na Xe) a šestém (Cs na Rn) řádku bloků s a p mají podobný průběh jako změny popsané pro třetí řádek periodické tabulky. Přechodné kovy jsou však zařazeny do čtvrtého, pátého a šestého řádku a lanthanoidy do šestého řádku. První ionizační energie přechodných kovů jsou si poněkud podobné, stejně jako energie lanthanoidů. Ionizační energie se zvyšují zleva doprava v každém řádku, přičemž nesrovnalosti se vyskytují u ns2np1 (skupina 13), ns2np4 (skupina 16) a ns2(n – 1)d10 (skupina 12).
- První ionizační energie obecně klesají směrem dolů po sloupci. Ačkoli se hlavní kvantové číslo n směrem dolů po sloupci zvyšuje, zaplněné vnitřní slupky účinně stíní valenční elektrony, takže dochází k relativně malému nárůstu efektivního jaderného náboje. V důsledku toho se atomy při získávání elektronů zvětšují. Valenční elektrony, které jsou vzdálenější od jádra, jsou méně pevně vázány, takže se snáze odstraňují, což způsobuje pokles ionizačních energií. Větší poloměr obvykle odpovídá nižší ionizační energii.
- V důsledku prvních dvou tendencí leží prvky, které nejsnáze tvoří kladné ionty (mají nejnižší ionizační energie), v levém dolním rohu periodické tabulky, zatímco prvky, které se nejhůře ionizují, leží v pravém horním rohu periodické tabulky. V důsledku toho ionizační energie obecně rostou diagonálně od levého dolního rohu (Cs) k pravému hornímu rohu (He).

Obecně platí, že \(I_1\) roste diagonálně od levého dolního rohu periodické tabulky k pravému hornímu rohu.
Gallium (Ga), které je prvním prvkem následujícím po první řadě přechodných kovů, má následující elektronovou konfiguraci: 4s23d104p1. Jeho první ionizační energie je podstatně nižší než energie bezprostředně předcházejícího prvku, zinku, protože zaplněná 3d10 podpouzdra galia leží uvnitř 4p podpouzdra a stíní jediný 4p elektron od jádra. Experimenty odhalily něco ještě zajímavějšího: druhý a třetí elektron, které jsou při ionizaci galia odebírány, pocházejí z orbitalu 4s2, nikoliv z podpouzdra 3d10. V chemii galia dominuje výsledný iont Ga3+ s elektronovou konfigurací 3d10. Tato a podobné elektronové konfigurace jsou obzvláště stabilní a často se s nimi setkáváme u těžších prvků bloku p. Někdy se označují jako konfigurace pseudoušlechtilých plynů. U prvků, které vykazují tyto konfigurace, nejsou ve skutečnosti známy žádné chemické sloučeniny, v nichž by byly elektrony odebrány z (n – 1)d10 vyplněné podpouzdra
.