Subatomární částice
Všechny prvky se skládají z velmi malých částic hmoty zvaných atomy. Atom můžeme definovat jako nejjednodušší částici prvku, která má chemické vlastnosti daného prvku. Chemické vlastnosti zahrnují fyzikální stav prvku (plyn, kapalina nebo pevná látka), typy vazeb, které může prvek tvořit, způsob reakce s jinými prvky atd. Proto mají všechny atomy tvořící prvek uhlík stejné chemické vlastnosti.
Fyzikům se podařilo roztrhat atomy na desítky různých subatomárních částic, avšak pouze 3 z nich jsou stabilní. Jsou to protony, neutrony a elektrony. Protony jsou kladně nabité částice, mají hmotnost a nacházejí se v centru neboli jádru atomu. Neutrony nemají náboj, mají hmotnost a rovněž se nacházejí v jádře atomu. Neutrony se vážou s protony způsobem, který pomáhá stabilizovat jádro. Příliš mnoho nebo příliš málo neutronů může vést k tomu, že atomové jádro je nestabilní a může se rozpadat za vzniku jiných prvků. Takové atomy označujeme jako radioaktivní. Přestože hmotnost neutronu je o něco větší než hmotnost protonu, můžeme oběma přiřadit relativní hmotnost 1 (1 atomová hmotnostní jednotka neboli amu). Neutrony a protony tvoří téměř celou hmotnost atomu. Třetím typem stabilní částice je elektron. Elektrony mají záporný náboj, ale jsou velmi malé a mají hmotnost pouze 1/1850 hmotnosti protonu nebo neutronu. Jsou tak malé, že se pro praktické účely nepodílejí na hmotnosti atomu. Elektrony se kolem jádra pohybují nesmírně vysokou rychlostí, která se blíží rychlosti světla. Přestože elektrony často popisujeme jako obíhající kolem jádra, podobně jako planety obíhají kolem Slunce, moderní fyzika nás učí, že tento model je nesprávný. Tyto „orbitaly“ jsou ve skutečnosti oblasti v prostoru kolem jádra, kde se elektrony nacházejí po většinu času. Tato oblast se často označuje jako elektronový „oblak“. Je pravda, že se stále jedná o určitou oblast, ale je poněkud amorfnější než sférický orbit. Pro zjednodušení si je však často představujeme jako kruhové orbitaly podobné satelitům. Následující obrázek představuje náš současný model atomu dusíku.
Jádro dusíku obsahuje 7 protonů (oranžová) a 7 neutronů (zelená). Stínované oblasti kolem jádra představují elektronové orbitaly (mraky). Elektrony (modré) se budou nacházet někde uvnitř těchto orbitalů. (Poznámka: obrázek není nakreslen v měřítku. Bylo navrženo, že kdyby bylo jádro velké jako basketbalový míč, elektrony by byly vzdáleny asi šest kilometrů nebo 3¾ míle!“
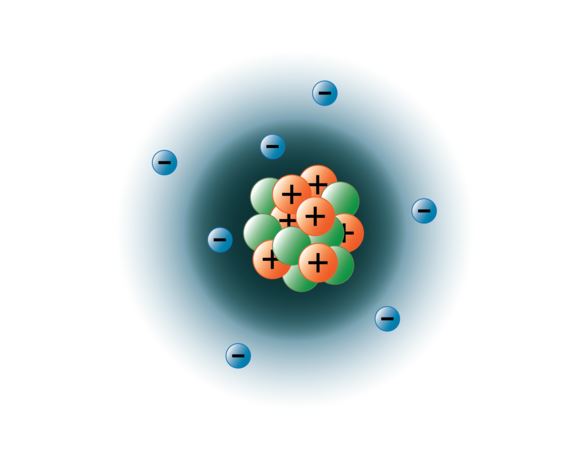
obrázek vytvořila studentka BYU-I Hannah Crowder Fall 2013
Atomové číslo
Podívejte se znovu na periodickou tabulku a všimněte si čísla v horní části každého políčka. Toto číslo je atomové číslo daného prvku a je jedinečné pro každý jiný prvek. Například atomové číslo vodíku je 1. Žádný jiný prvek nemá atomové číslo 1. U uhlíku je atomové číslo 6 a opět žádný jiný prvek nemá atomové číslo 6. Význam atomového čísla spočívá v tom, že nám říká počet protonů v jádře každého prvku. Všechny atomy vodíku tedy mají 1 proton a všechny atomy uhlíku mají 6 protonů. Kromě toho, protože atomy mají neutrální náboj, nám atomové číslo říká také počet elektronů v atomu. V chemickém zápisu se atomové číslo prvku vyjadřuje jako index před symbolem prvku. Například uhlík by byl vyjádřen jako 6C.
Hmotnostní číslo (atomová hmotnost)
Hmotnostní číslo atomu, jak již název napovídá, udává celkovou hmotnost atomu. Protože hmotnost elektronu je velmi malá (zanedbatelná), při výpočtu hmotnostního čísla se nepoužívá. Připomeňme také, že hmotnost každého protonu i každého neutronu je 1 atomová hmotnostní jednotka. Hmotnostní číslo je tedy součtem protonů a neutronů v atomu. Protože hmotnostní číslo je počet protonů plus počet neutronů a atomové číslo je počet protonů, můžete zjistit počet neutronů prostým odečtením atomového čísla od hmotnostního čísla. Jako příklad předpokládejme, že máme prvek s atomovým číslem 8 a hmotnostním číslem 17. Z této informace můžete odvodit, že tento prvek má 8 protonů, 8 elektronů a 9 neutronů (17-8=9). Teď vás trochu znejistím. Jak bylo uvedeno výše, všechny atomy daného prvku mají stejný počet protonů (atomové číslo), avšak různé atomy daného prvku mohou mít různý počet neutronů. Říkáme, že se jedná o různé izotopy daného prvku. Například existují tři izotopy vodíku. Nejběžnější izotop, který tvoří 99,98 % všech atomů vodíku, má hmotnostní číslo 1. Skládá se tedy z 1 protonu, žádného neutronu a jednoho elektronu. Ostatní méně rozšířené izotopy vodíku mají hmotnostní čísla 2 a 3. Tyto izotopy se liší počtem neutronů ve svých jádrech, ale všechny tři mají jeden proton a jeden elektron. Ve skutečnosti se v přírodě vyskytují izotopy každého prvku, z nichž každý má své jedinečné hmotnostní číslo. V chemickém zápisu se hmotnostní číslo daného izotopu vyjadřuje jako horní index před symbolem prvku. Tři izotopy vodíku by byly vyjádřeny jako 1H, 2H a 3H. Protože se každý prvek skládá z několika izotopů, vyvstává otázka: „Jaká je skutečná hmotnost daného prvku?“. Pokud se opět podíváte na výše uvedenou periodickou tabulku, všimnete si čísla ve spodní části každého políčka. Jedná se o atomovou hmotnost daného prvku. Například atomová hmotnost vodíku je 1,00794 amu. Toto číslo bylo získáno výpočtem průměrné hmotnosti 3 izotopů vodíku. Předpokládejme například, že máme ve třídě 10 chlapců. Kdybychom chtěli znát průměrnou hmotnost chlapců, sečetli bychom jejich jednotlivé hmotnosti a výsledek vydělili deseti. Tím bychom získali jejich průměrnou hmotnost. Takto se v podstatě určují atomové hmotnosti. Protože 1H je nejrozšířenější izotop vodíku, je logické, že atomová hmotnost vodíku je velmi blízká atomové hmotnosti 1H.
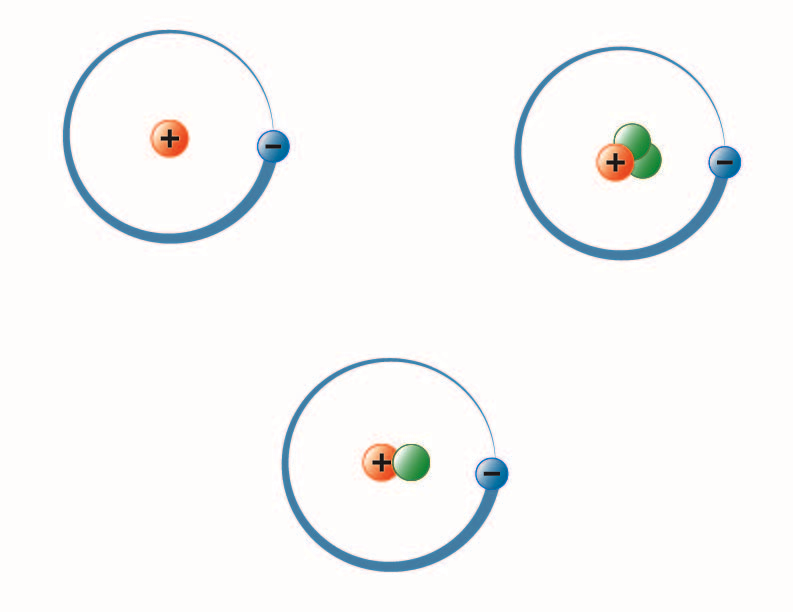
obrázek vytvořila studentka BYU-I Hannah Crowder Fall 2013
Výše uvedený obrázek představuje tři izotopy vodíku. Nejběžnější (vlevo nahoře) má v jádře jeden proton a žádné neutrony. Deuterium (dole) má jeden proton a jeden neutron a tritium (vpravo nahoře) má jeden proton a dva neutrony.
**Na další nebo předchozí čtení v tomto modulu můžete přejít pomocí tlačítek níže**

