Úvod
Metan (CH4) je hlavním skleníkovým plynem. Jeho emise z přírodních prostředí, jako jsou mokřady, oceány a sedimenty, představují celosvětově více než 70 % atmosférického metanu (IPCC, 2007). Vyhodnocení publikovaných údajů odhalilo rozdílnou míru emisí metanu pro mokřady, jezera, řeky, ústí řek a oceány (v sestupném pořadí, doplňkový obrázek S1). Jen na přírodní mokřady připadá 62 % produkce biogenního CH4 (Kirschke et al., 2013; Nazaries et al., 2013) a emise z mokřadů dominují v meziroční variabilitě zdrojů metanu (Bousquet et al., 2006). Naproti tomu rozsáhlé plochy mořských ekosystémů se na přírodních zdrojích CH4 podílejí pouze asi 8 % (Nazaries et al., 2013). V rámci celosvětových emisí metanu z oceánů se méně než 10 % podílejí ústí řek (Bange et al., 1994).
Metanogeneze, biologická tvorba metanu, je prováděna metanogenními archei, které produkují metan především z H2/CO2, methylových skupin nebo acetátu za anoxických podmínek (Thauer et al., 2008). Tuto reakci katalyzuje methyl-koenzym M reduktáza (MCR). Gen mcrA kódující podjednotku tohoto enzymu je běžně používaným genovým markerem v molekulárních průzkumech (Conrad, 2007; Bridgham et al., 2013). Výhodou markeru genu mcrA je zachycení fylogenetických i funkčních znaků metanogenů, což nabízí vysokou hloubku sekvenování pro tuto konkrétní funkci (Luton et al., 2002; Borrel et al., 2013; Yang et al., 2014). Bylo získáno velké množství sekvencí mcrA z různých přírodních prostředí. Veřejný soubor dat mcrA umožňuje extrahovat obecné ekologické vzorce a zkoumat formování environmentálních gradientů v globálním a regionálním měřítku. Kromě toho je k dispozici databáze shrnující fyziologické vlastnosti 152 metanogenních izolátů1 (Jabłoński et al., 2015). Nedávno binning genomů odhalil neobvyklé sekvence mcrA v nové třídě Methanofastidiosa (Nobu et al., 2016) a v nových fylách Bathyarchaeota (Evans et al., 2015) a Verstraetearchaeota (Vanwonterghem et al., 2016). Tyto nové poznatky rozšířily naše znalosti o rozmanitosti potenciálních metanogenů, ale nezastínily použitelnost genu mcrA jako molekulárního markeru pro velkou většinu metanogenních společenstev.
Dosud byla metanogenní společenstva zjištěna v mokřadech, sedimentech, věčně zmrzlých oblastech, rýžovištích, fermentorech, geotermálních pramenech a hydrotermálních vývěrech (Conrad, 2007; Thauer et al., 2008; Wagner a Liebner, 2009). Bylo zjištěno, že struktura metanogenního společenstva souvisí s pH prostředí, teplotou, salinitou, hladinou podzemní vody a dynamikou vegetace v různých prostorových a časových měřítkách (Megonigal et al., 2005; Milferstedt et al., 2010; Frank-Fahle et al., 2014; McCalley et al., 2014; Cui et al., 2015; Liebner et al., 2015). Například acetoklastické metanogenezi obecně brání nízké pH, protože snižuje disociaci acetátu (Megonigal et al., 2005; Kotsyurbenko et al., 2007). Vegetace může dodávat labilní, vysoce kvalitní organický uhlík jako palivo pro metanogeny ve formě kořenových exudátů nebo detritu, takže rostlinné exudáty obecně zvýhodňují acetoklastické metanogeny především v bažinách (Bridgham et al., 2013). Sírany z mořské vody inhibují produkci metanu v přílivových mokřadech, a slanost se proto používá jako obecný prediktor emisí metanu (Holm et al., 2016). Studie na tibetských jezerních sedimentech ukázala, že zvyšující se salinita inhibuje hydrogenotrofní metanogeny, ale zvyšuje acetoklastickou metanogenezi (Liu et al., 2016). Tyto studie naznačily environmentální faktory ovlivňující metanogenní společenstva, ale zaměřily se na jednotlivá stanoviště nebo omezená prostorová měřítka.
Pochopení adaptace metanogenů na různé změny prostředí však vyžaduje systematické a globální zkoumání korelací mezi složením mikrobiálních společenstev a podmínkami prostředí (Lozupone a Knight, 2007). V současné době se disperzí a filtrováním stanovišť metanogenních společenstev zabývá pouze několik studií (Auguet et al., 2010; Barreto et al., 2014). Předpokládáme, že metanogenní společenstva jsou ovlivněna především filtrováním stanovišť a že je řízeno globálními environmentálními kontrolami. Vzhledem k tomu, že míra emisí metanu se v jednotlivých přírodních ekosystémech do značné míry liší, může být explicitní začlenění složení, diverzity a biogeografie metanogenních společenstev v těchto ekosystémech zásadní pro určení reakce produkce metanu na současné a budoucí změny klimatu. Tato metastudie je provedena s cílem zaplnit mezery spojené s biogeografií metanogenů, jejich diverzitou a jejich environmentálními kontrolami pomocí veřejně dostupných sekvenčních dat mcrA a literatury doplněné o fyziologická data metanogenních izolátů.
Materiál a metody
Sbírka dat
Vyhledali jsme sekvence mcrA dostupné v databázi GenBank (leden 2016)2 . U každé shody byl zkontrolován původní článek a příslušné sekvence mcrA byly analyzovány vlastním skriptem Perl. Jelikož jsme se zaměřili na přírodní prostředí, byly metanogenní sekvence mcrA získány z přírodních stanovišť a klasifikovány jako půda, jezerní, ústí řek, mořské a hydrotermální sedimenty a bahenní vulkány. Kromě sekvencí klonových knihoven bylo zahrnuto pět knihoven ze sekvenování nové generace (NGS). Sekvence byly staženy bez zohlednění relativní četnosti v původním souboru dat. Protože sekvence klonových knihoven pokrývají především hojné fylotypy, zatímco NGS může zachytit mnohem hlubší diverzitu, učinili jsme kompromis, abychom použili data NGS, ale zmírnili potenciální chybu způsobenou rozdílným rozlišením sekvenačních metod. Proto jsme vybrali pouze reprezentativní sekvence hojných OTU s relativní četností vyšší než 1 %. Dále jsme odmítli ty sekvence NGS, které neprošly kontrolou převodu z nukleotidových na proteinové sekvence nebo měly nízkou kvalitu (sekvence < 250 bps). Nakonec jsme sestavili soubor dat obsahující 4466 unikátních sekvencí mcrA z 94 globálně rozšířených lokalit (obr. 1 a doplňkové tabulky S1, S2). Z datového souboru jsme navíc neodečetli sekvence mcrA potenciálních archeálních metanotrofů, které byly nevyhnutelně zjištěny při genomickém průzkumu (Conrad, 2007). Tato část je mimo zaměření této studie.
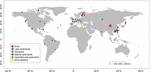
FIGURE 1. Umístění lokalit použitých pro tuto studii. Lokality byly rozděleny do šesti různých kategorií podle stanovišť a byly označeny různými barvami. Přehled šesti stanovišť je uveden v doplňkových tabulkách S1, S2.
Zeměpisné souřadnice a nastavení prostředí včetně pH, salinity, nadmořské výšky, průměrné roční teploty vzduchu (MAAT) a průměrného ročního úhrnu srážek (MAP) byly pro každou výzkumnou lokalitu uvažovanou v této studii získány z příslušných publikací za předpokladu, že jsou údaje k dispozici (viz doplňková tabulka S1). Abychom zohlednili chybějící parametry prostředí ve více studiích, definovali jsme kvalitativně některé proměnné prostředí podle popisů lokalit v příslušné literatuře a poté jsme tyto kategoriální údaje převedli na semimetrické číselné hodnoty, například vzorky mořských sedimentů, hydrotermálních sedimentů, vulkanického bahna a sedimentů sodného jezera jsme definovali jako „slané“, vzorky půdy a sladkovodních jezerních sedimentů jako „neslané“ a vzorky mangrovů a ústí řek jako „smíšené“.
Zpracování surových sekvencí
Zpracování sekvencí bylo realizováno pomocí softwarové platformy Mothur (Schloss et al., 2009). Sekvence z různých knihoven byly před zpracováním sloučeny. Sekvence s délkou menší než 350 bp nebo s více než 8 nejednoznačnými bázemi byly vyřazeny. Následně byly tyto sekvence zarovnány s předem zarovnanou podmnožinou sekvencí mcrA, které byly získány z databáze FunGene http://fungene.cme.msu.edu/ (Fish et al., 2013). Chimérické sekvence byly identifikovány pomocí softwaru Mothur metodou uchime (Edgar et al., 2011), přičemž samotný soubor dat sloužil jako referenční. Poté byly platné nukleotidové sekvence genu mcrA použity k výpočtu nekorigovaných párových vzdáleností mezi zarovnanými sekvencemi DNA a dále přiřazeny do operačních taxonomických jednotek (OTU) při hranici 84 %, která odpovídá 97 % pro gen 16S rRNA (Yang et al., 2014). Početnost každé mcrA OTU byla započítána pouze jako přítomnost nebo nepřítomnost. Přesnost taxonomické klasifikace OTU jsme zvýšili zohledněním sekvencí nukleotidů i aminokyselin. Na úrovni DNA byla taxonomická identita přiřazena pomocí platformy Mothur podle referenční databáze (Yang et al., 2014). Na úrovni proteinů byly zarovnané proteinové sekvence použity ke konstrukci stromu v ARB a poté bylo taxonomické přiřazení založeno na odpovídající databázi. Pokud bylo přiřazení OTU nekonzistentní, ručně jsme blastovali nukleotidovou i proteinovou sekvenci v NCBI a určili konečnou taxonomickou identitu s ohledem na pokrytí dotazu (>95 %), identitu (>84 %) a e-hodnotu (<1E-5). U proteinových sekvencí se mezní hodnota na úrovni rodu vztahovala k prahové hodnotě 83,5 % (Hunger et al., 2011).
Ekologická a statistická analýza
Statistická analýza byla provedena pomocí různých balíčků R. Ordinace analýzy hlavních souřadnic (PCoA) byly vytvořeny na základě Jaccardových matic vzdáleností zkonstruovaných pomocí balíčku vegan v2.2.0 (Oksanen et al., 2015). Pro posouzení zdroje variability Jaccardovy matice (McArdle a Anderson, 2001) byla provedena permutační MANOVA (vícerozměrná analýza variance) u veganů se 104 permutacemi. Míry Jaccardovy vzdálenosti jsou založeny na přítomnosti/nepřítomnosti druhů, což je pro náš soubor dat vhodnější, protože většina studií poskytla pouze reprezentativní sekvence, zatímco informace o početnosti chybí. Frekvence taxonomického výskytu napříč stanovišti byly vizualizovány pomocí bublinových grafů pomocí balíčku ggplot2 (v1.0.0) (Wickham, 2009). Hierarchická shluková analýza společenstev neslaných půdních a jezerních sedimentů byla provedena pomocí R funkce „hclust“ (R Core Team, 2014). Získané shluky společenstev byly popsány podle pH a teplotního režimu původních vzorků, protože pomocí PCoA jsme předem identifikovali, že oba parametry pH a teplota ovlivňují složení metanogenních společenstev v neslaných půdách a jezerních sedimentech. Asociace jednotlivých metanogenních linií s každým z těchto shluků byla určena pomocí korelační analýzy indikátorových druhů (Dufrene a Legendre, 1997). Indikátorové druhy jsou zde definovány jako druhy, které se vyskytují hojně v určitém typu stanoviště (specifičnost) a převážně v tomto typu stanoviště (věrnost). V této studii byly indikátorové taxony, podobně jako u konceptu indikátorových druhů, pro neslaniskové půdy a jezerní sedimenty vybírány podle indikátorové hodnoty (hodnota IndVal) pomocí R balíčku labdsv (Roberts, 2016), pokud je pravděpodobnost získání stejně vysoké indikátorové hodnoty, jaká byla pozorována v průběhu zadaných iterací, menší než 0,05. V této studii byly indikátorové taxony vybírány podle indikátorové hodnoty (hodnota IndVal). Indexy Chao2 byly vypočteny pro každý vzorek pomocí balíčku vegan. Wilcoxonův rank sum test indexů Chao2 mezi stanovišti byl proveden pomocí funkce R ‚wilcox.test‘ (R Core Team, 2014). Pro konsolidaci vlivu filtrování stanovišť na izoláty metanogenních archeí byly fyziologické a biochemické charakteristiky popsaných metanogenních kultur získány z3 „Methanogenic archaea database“ (Jabłoński et al., 2015). Z nich byly vyfiltrovány izoláty s informací o optimální potřebě NaCl, které byly roztříděny a vyneseny do grafu podle zdroje izolace.
Pro zkoumání vlivu omezení disperze na strukturu metanogenního společenstva byla provedena lineární regresní analýza na základě matice geografické vzdálenosti a matice Jaccardovy vzdálenosti společenstva pomocí funkce R ‚lm‘ (R Core Team, 2014). Pro vyhodnocení vlivu disperzní limitace podle obou matic jsme provedli Mantelův a částečný Mantelův test opět pomocí balíčku vegan v R (Oksanen et al., 2015). Dále byla použita vícerozměrná prostorová analýza (prostorová PCA) na 16 evropských vzorků půdy a jezerních sedimentů na základě Moranova I indexu pro zkoumání prostorové struktury metanogenů pomocí funkce „multispati“ v balíčku R ade4 (Dray a Dufour, 2007). Kromě toho bylo na těchto 16 vzorků implementováno shlukování Wardova minimálního rozptylu, které bylo založeno na matici Jaccardovy vzdálenosti, pomocí funkce R „hclust“ (R Core Team, 2014) a výsledky shlukování jsme dále promítli do geografické mapy. Evropský shapefile pro mapování na úrovni států je k dispozici v databázi GSHHG (v2.3.6)4. Mapa byla vytvořena pomocí QGIS v2.18.25.
Výsledky
Biogeografie metanogenních archeí v přírodních prostředích
Byly získány sekvence genu mcrA z 94 globálně rozšířených přírodních prostředí. Poloha a typ ekosystému každé z těchto 94 lokalit je znázorněna na obrázku 1. Frekvence výskytu (přítomnost/nepřítomnost) metanogenních linií byly sloučeny podle typu ekosystému a znázorněny na obrázku 2. Stručně řečeno, nejčastěji pozorovaným taxonem v půdách je Methanoregula spolu s Methanobacterium, Methanosaeta, Methanocella, Methanomassiliicoccus a Methanosarcina. V sedimentech ústí řek byly běžně zjištěny sekvence Methanosaeta, Methanobacterium, Methanoregula a Methanoculleus. V jezerních sedimentech se navíc vyskytovaly především Methanoregula a Methanosaeta. V mořských sedimentech se nejčastěji vyskytovaly linie Methanoculleus a Methanosaeta, následované linií Methanolinea.
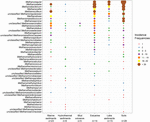
OBRÁZEK 2. V mořských sedimentech se nejčastěji vyskytovaly linie Methanoculleus a Methanosaeta. Bublinový graf znázorňující četnosti výskytu metanogenních linií v různých přírodních prostředích. Pořadí podél svislé osy odpovídá klesajícím celkovým frekvencím výskytu linií. Taxonomie je znázorněna pro rodovou úroveň. Pokud nebylo možné přiřazení k rodové úrovni, byla použita nejbližší vyšší přiřaditelná taxonomická úroveň. Pro každé stanoviště je uveden počet vzorků (n).
Přestože bylo mnoho taxonů zjištěno v různých prostředích, některé z nich stále vykazují environmentální preference. Taxon Methanoregula, který se často vyskytuje v nemořském a přechodném prostředí (půdy, jezerní sedimenty a ústí řek), chybí v mořských biotopech (mořské sedimenty, hydrotermální sedimenty a bahenní vulkány). Methanobacterium a Methanocella, které převládají v nemořském a přechodném prostředí, se v mořských biotopech vyskytují zřídka. Naopak Methanococcoides, jako převládající linie v mořských sedimentech, hydrotermálních sedimentech a bahenních vulkanitech, se v půdách a jezerních sedimentech téměř nevyskytuje. Methanogenium a Methanolacinia se navíc vyskytují pouze v ústí řek a v mořských sedimentech, zatímco Methanospirillum a Methanosphaerula se vyskytují pouze v suchozemském prostředí. Kromě toho se některé specifické taxony vyskytují výhradně v hydrotermálních sedimentech, včetně Methanocaldococcus, Methanothermococcus, Methanopyrus, Methanotorris a Methanococcus. Přestože některé linie, jako například Methanosaeta, jsou přítomny ve většině prostředí, nelze žádnou linii považovat za všudypřítomnou.
Nejvyšší bohatství linií se vyskytovalo v ústí řek, kde se také vyskytují rovnoměrnější frekvence výskytu různých linií. Naopak bahenní sopky a hydrotermální ekosystémy vykazují relativně nízkou metanogenní diverzitu. Půdy a jezerní sedimenty se podobně jako ústí řek vyznačují rozmanitými metanogenními společenstvy.
Alfa-diverzita metanogenních společenstev v přírodním prostředí
Bohacení metanogenních archeí podle indexu Chao2 se mezi jednotlivými typy ekosystémů značně lišilo (obr. 3). Pro účely přímého porovnání alfa diverzity a pro získání rozumného kompromisu mezi vzorky byl proveden podvýběr na 15 sekvencí pro každou lokalitu. Index Chao2 ukazuje, že sedimenty ústí řek zahrnují nejvyšší druhovou bohatost metanogenů podél šesti typů ekosystémů (doplňková tabulka S3), což podtrhuje výsledky bublinového grafu (obrázek 2). Půdy a jezerní sedimenty, které vykazují nižší bohatství než vzorky z ústí řek, mají významně vyšší indexy Chao2 než mořské sedimenty a hydrotermální sedimenty a bez významných rozdílů mezi mořskými sedimenty a hydrotermálními sedimenty (Doplňková tabulka S3).
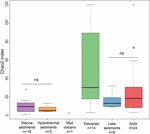
Obrázek 3. Krabicový graf indexů Chao2 různých typů ekosystémů. Graf je založen na podsouborech dat obsahujících 15 sekvencí pro každou lokalitu, aby bylo srovnání na mírách alfa diverzity robustnější. Počet vzorků v každém stanovišti je uveden jako „n“ pod označením stanoviště. Označení „ns“ neznamená statistickou významnost ve Wilcoxonově testu. Statistický výsledek alfa diverzity na úrovni OTU je uveden v doplňkové tabulce S3.
Globální kontroly metanogenních společenstev v přírodním prostředí
Devadesát čtyři globálně rozšířených metanogenních společenstev bylo seskupeno do ordinačního grafu pomocí PCoA na základě Jaccardovy matice vzdáleností. Podle analýzy PCoA vysvětlují první a druhá osa dohromady 16,3 % celkového rozptylu. Rozdíly mezi vzorky tak lze do značné míry vysvětlit slaností (obr. 4). Vzhledem k tomu, že v některých případech nebyly k dispozici výchozí údaje o koncentraci solí, kvalitativně jsme tyto vzorky přiřadili k slaným, smíšeným (středně slaným) a neslaným vzorkům, jak je popsáno výše. Zasolené a nezasolené vzorky se účinně oddělují podél první osy. Smíšené vzorky se celkově řadí mezi slané a neslané vzorky. Permutační MANOVA založená na matici Jaccardovy vzdálenosti rovněž naznačuje, že slanost je hlavním abiotickým faktorem, který řídí rozložení globálních metanogenních společenstev (R2 = 0,099, P < 0,001) (tabulka 1).
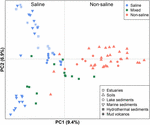
OBRÁZEK 4. Ordinace analýzy hlavních souřadnic (PCoA) na základě Jaccardovy matice vzdáleností knihoven sekvencí metanogenních genů mcrA porovnávající 94 vzorků. PCoA je barevně odlišena podle salinity: Červené symboly označují neslaná prostředí, modré symboly označují slaná prostředí a zelené symboly označují přechodná prostředí. Různé symboly znázorňují různá prostředí. Na osách je uvedeno procento variability vysvětlené vynesenými hlavními souřadnicemi.

TABULKA 1. Permutační analýza MANOVA na matici Jaccardovy vzdálenosti všech vzorků ze šesti stanovišť pro testování souvislosti variability společenstva s různými proměnnými prostředí.
Dále jsme ověřovali potenciální vztah mezi zdrojem izolace čistých metanogenních kultur a optimální koncentrací NaCl pro růst. Optimální koncentrace NaCl metanogenních čistých kultur vykazovala pokles od mořských k ústím řek, jezerním sedimentům a půdním ekosystémům (doplňkový obrázek S2). Několik odlehlých izolátů pochází ze sedimentů sodných jezer nebo hypersalinních půd.
Kontrola prostředí a metanogenní indikátorové taxony v neslaných půdách a jezerních sedimentech
V globálním měřítku se metanogenní společenstva z neslaných půd a jezerních sedimentů těsně shlukují (Obrázek 4), takže jsme dále analyzovali kontrolu prostředí metanogenních společenstev z těchto dvou biotopů, které představují celkem 33 studovaných lokalit. Shluková analýza společenství pro tyto dva typy stanovišť odhalila čtyři shluky na základě Jaccardovy matice vzdáleností (doplňkový obrázek S3). Permutační MANOVA naznačuje, že jak pH (R2 = 0,099, P < 0,001), tak teplota (R2 = 0,069, P < 0,001) ovlivňují metanogenní β-diverzitu v neslaných půdách a jezerních sedimentech (tabulka 2). V souladu s tím jsme přiřadili čtyři shluky k pH a MAAT výchozího místa odběru vzorků a získali jsme do značné míry konzistentní podskupiny ke shlukování společenstev (obr. 5C,D). Kombinace charakteristik prostředí a těchto čtyř shluků společenstev nám umožňuje definovat tyto čtyři podskupiny jako neutrální a chladnou skupinu 1, kyselou a chladnou skupinu 2, kyselou a mírnou skupinu 3 a neutrální a teplou skupinu 4 (obr. 5). Další ordinace PCoA na základě Jaccardovy matice nepodobnosti naznačuje, že podél osy PC1 pochází většina vzorků ze skupiny 2 a skupiny 3 z kyselých půd a jezerních sedimentů, zatímco skupina 1 a skupina 4 byly převážně z neutrálního prostředí (obr. 5A). Kromě toho se vzorky z mírných stanovišť (skupina 3) oddělily od vzorků z teplých a studených stanovišť podél PC2, zatímco vzorky z teplého prostředí (skupina 4) se oddělily od ostatních vzorků podél PC3 (obrázek 5B). Tím první tři osy ordinace PCoA vysvětlují 38,8 % celkové variability.

TABULKA 2. Permutační MANOVA založená na matici Jaccardovy vzdálenosti vzorků neslaných půd a jezerních sedimentů pro testování asociace variability společenstev s různými proměnnými prostředí.
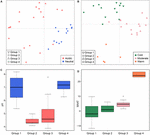
Obrázek 5. Graf analýzy hlavních souřadnic na základě Jaccardovy matice vzdáleností pro 33 neslaných půd a jezerních sedimentů. Dílčí graf (A) zobrazuje PC1 a PC2 a symboly jsou barevně odlišeny podle pH a dílčí graf (B) zobrazuje PC2 a PC3 a symboly jsou barevně odlišeny podle teploty. První tři komponenty vysvětlují 17,1, 11,7 a 10 % rozptylu. Krabicové grafy ukazují pH (C) a MAAT (průměrná roční teplota vzduchu) (D) čtyř identifikovaných podskupin. Barva boxu na obrázku C odpovídá kategorii pH na obrázku (A). Barvy krabicových grafů ukazují statistickou významnost na základě párového Wilcoxonova testu (P < 0,05), kde se vzorky se stejnou barvou od sebe významně neliší. Podobně barva v (D) sleduje seskupení teplot v (B). Podskupiny odkazují na hierarchickou shlukovou analýzu podobnosti společenstev.
Zkoumali jsme výskyt metanogenních linií v jednotlivých podskupinách na základě četností výskytu (obr. 6). Methanoregula převažuje ve všech typech neslaných stanovišť. Kromě Methanoregula vykazuje neutrální a chladná podskupina (skupina 1) vysoký výskyt Methanosaeta, Methanobacterium a Methanosarcina. Kyselá a chladná skupina 2 je zastoupena Methanobacterium, Methanocella a Methanosarcina, zatímco Methanosaeta zde chybí. Methanocella a Methanosaeta jsou běžné v kyselé a mírné skupině 3. V neutrální a teplé skupině 4 jsou významnými členy Methanolinea a Methanosaeta. Tato skupina je jedinou skupinou, kde byl identifikován Methanoculleus.

Obrázek 6. Četnosti výskytu metanogenních linií v rámci čtyř definovaných skupin metanogenních společenstev v půdách a jezerních sedimentech. Vertikální osa je uspořádána v abecedním pořadí. Délka sloupce odpovídá průměrným frekvencím výskytu jednotlivých linií v rámci příslušné skupiny. Chybové sloupce představují směrodatnou odchylku daného taxonu u různých vzorků v dané skupině. Hvězdičkami jsou označeny specializované taxony s hodnotou P < 0,05. Taxonomie je zobrazena pro úroveň rodu. Pokud nebylo možné přiřadit taxon na rodovou úroveň, byla použita nejbližší vyšší přiřaditelná taxonomická úroveň. Popis pro čtyři skupiny je uveden na obrázku 5.
Pro všechny čtyři skupiny jsou taxony s vysokým výskytem Methanoregula, Methanobacterium, Methanosarcina, Methanosaeta, Methanomassiliicoccus a Methanocella. Specializované taxony, které jsou výrazně více zastoupeny na většině lokalit v rámci dané skupiny, byly zjištěny podle analýzy indikátorových druhů, jak bylo popsáno dříve. Celkem šest z 31 taxonů vykazovalo významnou indikační hodnotu (P < 0,05) (označeno hvězdičkou na obr. 6). Skupina 1 (neutrální a chladná) vykazovala největší počet specialistů s liniemi Methanosaeta, Methanolobus a Methanomethylovorans. Methanobacterium sloužil jako taxon specialista ve skupině 2 (studená a kyselá), zatímco Methanolinea byla identifikována jako specialista ve skupině 4 (neutrální a teplá), ale v ostatních skupinách nebyla téměř pozorována. Methanoregula je navíc ve velké míře zastoupena v kyselé a mírné skupině 3.
Omezení rozptylu
Lineární regresní analýza (R2= 0,05, P < 0,001) ukázala slabou korelaci mezi geografickou vzdáleností a strukturou metanogenního společenstva na globálním souboru dat. Mantelův test zároveň ukázal, že environmentální proměnné mají vyšší korelaci se strukturou společenstva než geografické vzdálenosti (viz tabulka 3). Tento trend potvrdil i částečný Mantelův test kontrolující vliv autokorelace. Graf geografické vzdálenosti vůči Jaccardově podobnosti společenstev neukazuje žádný jasný lineární trend, ale zákonitosti, které vyplývají především z globálního rozložení míst odběru vzorků (viz doplňkový obrázek S4).

TABULKA 3. V tabulce 3 jsou znázorněny geografické vzdálenosti a podobnost společenstev. Analýzy Mantelova a částečného Mantelova testu pro určení vlivu proměnných prostředí a geografické vzdálenosti na distribuci mikrobů pro globální soubor dat a podsoubor 16 evropských vzorků.
Pro další analýzu vlivu rozptylu jsme naši analýzu omezili na Evropu, kde byl odběr vzorků nejhustší a nejrovnoměrnější. Mantelovy testy a částečné Mantelovy testy na tomto podsouboru reprodukovaly trend, že údaje o společenstvu jsou více korelovány s proměnnými prostředí než s geografickými vzdálenostmi (viz tabulka 3). Částečný Mantelův test kontrolující proměnné prostředí nezjistil žádnou statisticky významnou korelaci mezi mikrobiálním společenstvem a zeměpisnou vzdáleností. Prostorová analýza PCA na těchto 16 evropských lokalitách naznačuje prostorovou strukturu metanogenního společenstva (23,7 % celkového rozptylu bylo vysvětleno touto strukturou), což odpovídá pozitivní prostorové autokorelaci lokalit, jak naznačuje Moranův index I (Moran’s I = 0,4018). Pouze první vlastní číslo bylo stabilní a odpovídalo rozdělení vzorků mezi střední Evropu a pobaltské státy (doplňkový obrázek S5). Malý soubor dat však komplikuje robustní přiřazení této pozorované prostorové struktury ke geografickým, environmentálním proměnným nebo k oběma. Proto jsme provedli shlukovou analýzu metanogenních společenstev, jak je popsáno výše, a odhalili jsme tři skupiny (obr. 7A), které jsme promítli do geografické mapy (obr. 7B). Shlukování nereprodukovalo rozdělení prostorové PCA podél Baltského moře. V souladu s tím vykazují některé lokality, které jsou si geograficky velmi blízké, odlišné struktury metanogenních společenstev a skládají se z různých shluků. Na druhou stranu některé geograficky velmi vzdálené lokality vykazují velmi podobné složení společenstva a shlukují se dohromady (obr. 7B). Zdá se, že regionální rozptyl skupin v Evropě neodpovídá geografické struktuře ani jí není omezen.
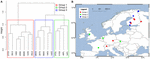
OBRÁZEK 7. Hierarchická shluková analýza matice Jaccardovy vzdálenosti mezi 16 evropskými vzorky půdy a jezerních sedimentů. Pro analýzu byla použita Wardova metoda shlukování. Lokality byly rozděleny do tří skupin vybarvených různými obdélníky ve shlukovacím dendrogramu (A) a byly promítnuty na mapu Evropy (B).
Diskuse
Identifikace a aplikace konceptů biogeografie na mikrobiální společenstva má v mikrobiální ekologii velký význam. Předpokládá se, že mikrobiální biogeografie je řízena evoluční a ekologickou souhrou čtyř hlavních procesů: filtrování stanovišť, disperze, drift a mutace (Hanson et al., 2012). Přestože vliv driftu a mutace přesahuje interpretační možnosti této studie, ukazujeme, že globální vzorce metanogenních společenstev v přírodním prostředí existují. Tato studie ukazuje globální biogeografický vzorec metanogenních společenstev, který souvisí spíše s filtrováním stanovišť než s geografickým rozptylem. Metanogenní společenstva ze sedimentů sodných jezer se například těsně shlukují s geograficky vzdálenými mořskými vzorky (obr. 4) a velmi podobná metanogenní společenstva se vyskytují v evropských půdních a jezerních sedimentech, přestože se nacházejí ve velké vzdálenosti mezi sebou (obr. 7). Celkově naše pokusy odhalit potenciální omezení disperze odhalily slabý vliv geografické polohy na strukturu metanogenních společenstev, což kontrastuje s jasným vlivem podmínek prostředí. Jednoznačné vyloučení prostorového vlivu na mikrobiální společenstva není s dostupnými datovými body možné. Místa odběru vzorků se zaměřují na určitá stanoviště a/nebo oblasti, zatímco celkový počet vzorků je nízký. Pokud existuje vliv, předpokládáme, že se prostorové účinky projevují pouze v regionálním nebo místním měřítku. Lokální omezení disperze byla zaznamenána u hypertermofilních archeí způsobených geografickými bariérami (Whitaker et al., 2003), u bakterií oxidujících amoniak v lokálních solných bažinách, nikoli však v regionálním a kontinentálním měřítku (Martiny et al., 2011), u mikroorganismů v hlubokomořských sedimentech spolu s prostředím (Schauer et al., 2009), a pro bakterie velkého souboru heterogenních sněhových prostředí většinou způsobených dostupností alochtonního uhlíku (Lutz et al., 2016). Malý vliv omezení disperze na metanogeny v přírodním prostředí znamená, že metanogeny se mohou náhodně šířit v prostoru, jsou úspěšně selektovány místním prostředím, pokud jsou splněny jejich fyziologické požadavky, a mohou vytvářet stabilní společenstva (Martiny et al., 2006; von Mering et al., 2007).
Koncept filtrování stanovišť znamená, že druhy s podobnými ekologickými požadavky by se měly vyskytovat společně častěji, než se očekává náhodou (Weiher a Keddy, 2001; Cornwell et al., 2006; Ulrich et al., 2010). Naše výsledky ukazují, že velké rozdíly mezi složením metanogenních společenstev se vyskytují mezi mořskými a mokřadními a jezerními ekosystémy, zatímco ústí řek se shlukují mezi nimi. Biogeografické vzorce založené na souboru genových průzkumů na environmentálních vzorcích byly zaznamenány také pro obecné bakterie (Nemergut et al., 2011), mikrobiom metanových průsaků (Ruff et al., 2015), archea oxidující amoniak (Cao et al., 2013), mořské pelagické a bentické bakterie (Zinger et al., 2011) a mikroorganismy cyklující dusík (Church et al., 2008). Filtrování stanovišť bylo konkrétně zaznamenáno u nekultivovaných archeí (Auguet et al., 2010), celých bakteriálních společenstev v různých prostředích (von Mering et al., 2007; Chaffron et al., 2010) nebo v jihoamerických rašeliništích v regionálním měřítku (Oloo et al., 2016), stejně jako specifické skupiny bakterií, jako jsou metan-oxidující (Knief, 2015) a dusík-fixující bakterie (Nelson et al., 2016).
Naše výsledky ukazují, že v globálním měřítku slanost podstatně reguluje složení metanogenních společenstev a určuje velké rozdíly mezi mořskými a suchozemskými metanogenními společenstvy. Také metanogeny ze sedimentů sodných jezer se shlukují s metanogeny z mořských sedimentů (obr. 4), což zdůrazňuje globální vliv salinity. Tento výsledek je v souladu s dalšími studiemi založenými na genu 16S rRNA odhalujícími, že slanost je primárním faktorem utvářejícím globální vzorce celkových bakteriálních a celkových archeálních společenstev (Lozupone a Knight, 2007; Auguet a kol., 2010; Caporaso a kol., 2011; Cao a kol., 2013). Nízký vliv geografické separace, ale silný vliv salinity na obecná mikrobiální společenstva byl pozorován i v předchozích studiích (Logares et al., 2013; Yang et al., 2016). Podle toho zasolení do značné míry určuje, které linie mohou přežít. V různých biotopech byla aktivita produkce metanu negativně korelována se salinitou (Bartlett et al., 1987; Potter et al., 2009; Poffenbarger et al., 2011). Předpokládá se tak, že inhibice produkce metanu prostřednictvím zasolení se shoduje se sníženou velikostí metanogenní populace (Pattnaik et al., 2000). Vliv salinity na hydrogenotrofní, acetotrofní a metylotrofní metanogenezi tak závisí na úrovni salinity a liší se pro různé cesty metanogeneze (Liu et al., 2016). V současné době neexistuje jasný mechanismus, který by vysvětloval vliv salinity na strukturu společenstva, ale jako možné vysvětlení může sloužit několik hypotéz. Z fyziologického hlediska ovlivňuje salinita vnější a vnitřní osmolaritu buněk. Neslané metanogenní buňky si vyvinuly fyziologické adaptace proti vnitřnímu turgorovému tlaku, zatímco buňky adaptované na sůl tuto vlastnost ztratily (Zinder, 1993). Kromě toho může zvyšující se salinita přimět metanogeny k syntéze nebo příjmu zvýšeného podílu kompatibilních solutů za značných energetických, a tedy i metabolických nákladů (McGenity, 2010). Vlastnost tolerance k soli se dokonce projevuje v optimální koncentraci NaCl pro růst čistých metanogenních kultur, protože jsme zjistili, že izoláty z mořských sedimentů a hydrotermálních sedimentů mají výrazně vyšší optimální koncentraci NaCl než izoláty z půd (doplňkový obrázek S2).
V neslaných suchozemských ekosystémech, konkrétně v půdách a jezerních sedimentech, je složení metanogenního společenstva řízeno kombinací teploty a pH. V souladu s tím lze metanogeny těchto prostředí rozdělit do čtyř skupin (obr. 6). Na rozdíl od mořských ekosystémů vykazují neslané suchozemské ekosystémy velkou přirozenou variabilitu pH i teploty. Teplota může ovlivňovat nejen metanogenní dráhu, ale i samotné metanogenní populace (Conrad, 2007; Rooney-Varga et al., 2007). Produkce metanu se může výrazně zvýšit, pokud se zvýší teplota v důsledku teplotně citlivých kroků během fermentace a acetogeneze (Megonigal et al., 2005; Kotsyurbenko et al., 2007). Kromě toho může nízké pH podstatně omezit dostupnost acetátu tím, že brání jeho disociaci, a tím negativně ovlivnit acetoklastickou metanogenezi (Fukuzaki et al., 1990; Bridgham et al., 2013). To by mohl být možný důvod, proč Methanosaeta ve skupině2 chyběla, zatímco Methanosarcina může přepínat mezi různými zdroji a nebyla podstatně ovlivněna. Navíc pH může regulovat účinnost produkce metanu a metanogenních drah od ombrotrofních po minerotrofní rašeliniště, a to přímou inhibicí obou drah metanogeneze a nepřímo svým vlivem na fermentaci (Ye et al., 2012). Teplota i pH tedy mohou přímo či nepřímo regulovat metabolické kroky spojené s metanogenezí a navazující fermentací, která poskytuje substrát pro metanogeny.
Metanoregula je všudypřítomná a velmi hojná ve všech čtyřech skupinách suchozemských biotopů (obr. 6), ale v mořském systému prakticky chybí, a může se tak ukázat jako zástupce vlivu sladké vody v mořské sféře. O jeho globálním významu bylo nedávno referováno na jiném místě (Yang et al., 2017). Navzdory všudypřítomnému rozšíření v půdách a jezerních sedimentech se Methanoregula vyskytuje jako indikační linie v kyselých biotopech s mírnou teplotou. Navíc se zdá, že (1) Methanolinea se adaptovala zejména na teplé, neutrální suchozemské prostředí, (2) Methanobacterium na chladné, kyselé prostředí a (3) Methanosaeta na prostředí s neutrálním pH, což je v souladu s jinými studiemi (Rosenberg et al., 2014) a podtrhuje robustnost našeho přístupu. Obecně platí, že geochemické podmínky obklopující metanogenní společenstva povedou k diferenciaci nik. Vzhledem k tomu, že třídění nik má tendenci opouštět adaptivní specialisty (Langenheder a Székely, 2011), postupná dlouhodobá environmentální selekce vytvořila řadu nik, které byly vyplněny řadou endemických habitatových specialistů, kteří mohou být v jiných odlišných environmentálních podmínkách méně zastoupeni nebo mohou chybět. Společenstvo je také utvářeno biotickými faktory, jako jsou ekologické interakce, dynamika, konkurence a symbióza. Navzdory těmto biologickým faktorům von Mering et al. (2007) zjistili, že habitatové preference jsou často pozoruhodně stabilní v čase a charakteristické taxonomické složení environmentálních společenstev zase může být důležitým ukazatelem jejich ekologie a funkce.
V souladu s habitatovými preferencemi metanogenních archeí se zdá, že blízce příbuzné metanogenní kmeny byly často izolovány ze srovnatelných prostředí. Například Methanoregulaceae se zdá být v přírodních prostředích poměrně rozmanitá (Yang et al., 2017) a neutrální kmeny mohou zatím odolávat kultivaci. Oba aktuálně popsané kmeny Methanoregula jsou získány z mírně acidofilních prostředí, zatímco dva zástupci Methanolinea pocházejí z relativně teplých stanovišť, jako jsou digestátové kaly, respektive půda rýžových polí (Rosenberg et al., 2014). Přestože byly kmeny Methanobacterium izolovány z různých prostředí, přibližně polovina existujících izolátů tohoto rodu vykazuje pH optima mírně nižší než 7. To znamená, že indikátorové linie, které byly identifikovány na základě environmentálních sekvencí, by mohly odrážet diferenciace fyziologie a zdrojů existujících metanogenních kultivarů. Například slanost prostředí, jako obecná vlastnost prostředí, může postupně vystavovat organismy silné selekci prostředí a filtrovat sestavení nového souboru druhů, které jsou nejvhodnější pro slanost prostředí (Logares et al., 2013).
Ochrana a správa biodiverzity je hlavní výzvou naší současné společnosti. Zde ukazujeme, že metanogenní archea přírodního prostředí jsou nejrozmanitější v ústních sedimentech. Estuária jsou přechodnými zónami mezi mořskými a suchozemskými ekosystémy. To umožňuje dva hlavní procesy, které mohou přispívat k druhovému bohatství. Zaprvé se v ústích řek mísí mikrobi z moře a souše a nakonec zahrnují celkově vysokou diverzitu (McLusky a Elliott, 2004). Byla například pozorována vysoká rozmanitost bakterií, archeí, hub a dokonce i specifických bakterií vykonávajících jedinečné funkce v ústí řek (Cunliffe a kol., 2008; Mosier a Francis, 2008; Crump a kol., 2012). Dalším aspektem je vysoká hladina živin v důsledku suchozemských, přílivových vstupů, kterými se ústní organismy živí (McLusky a Elliott, 2004; Statham, 2012). V této souvislosti má prostředí ústí řek význam při obnově druhových novinek pro metanogeny. Vliv druhové rozmanitosti na ekosystémové procesy dosud přitahoval značné výzkumné úsilí. Souvislost mezi biodiverzitou a funkcí ekosystému je stále předmětem diskusí a v případě mikrobiálních společenstev zůstává nepolapitelná (Loreau et al., 2001; Tilman et al., 2014). Přestože jsou půdy a jezerní sedimenty primárními zdroji metanu a zároveň stanovišti s vysokou metanogenní diverzitou, navrhujeme, aby druhová bohatost nebyla vhodným ukazatelem potenciálu produkce metanu a emisí metanu v ekosystému; spíše se zdá, že odráží heterogenitu a historii prostředí. Seřazení prostředí podle jejich druhové bohatosti nemusí nutně znamenat potenciál míry emisí metanu, který je nejvyšší z půd a jezer a srovnatelně malý z ústí řek (obr. 3 a doplňkový obr. S1).
Nakonec, nedostatek informací o prostředí ve veřejných databázích mohl bránit úplné interpretaci o zde pozorovaných faktorech prostředí. Přestože v literatuře a veřejných databázích přibývá sekvenčních údajů o metanogenech, poskytované související abiotické proměnné jsou často nekonzistentní a řídké. Omezené množství konzistentních informací o environmentálních proměnných skutečně omezuje použití vícerozměrných statistických analýz. Připomeneme-li, že abiotické faktory v této studii mohou vysvětlit pouze omezenou část variability společenstva, naznačuje to, že chybí další vysvětlující proměnné. Zvláště důležité by mohly být koncentrace a dostupnost methanogenních substrátů, jako jsou acetát, vodík a methylaminy. Nicméně abiotické parametry nemusí nikdy stačit k úplnému vysvětlení toho, co strukturuje metanogenní společenstva, jednoduše proto, že stanoviště mají různou historii a lze je studovat pouze lokálně. Také mezi dostupnými údaji o mcrA jsou rozsáhlé oblasti ruské a kanadské subarktické a arktické oblasti málo zastoupeny. Lepší geografické pokrytí a rovnoměrné rozložení souboru dat o genech mcrA by zlepšilo hodnocení metanogenních společenstev v globálním měřítku.
Příspěvky autorů
SL a XW navrhli studii. XW a SY shromáždili a analyzovali data. XW, SY a FH provedli statistickou analýzu. XW, MW a SY provedli fylogenetickou korekci. XW, SY, FH, MW, DW a SL interpretovali výsledky a napsali článek. Všichni autoři se podíleli na diskusích a recenzovali rukopis.
Prohlášení o střetu zájmů
Autoři prohlašují, že výzkum byl prováděn bez jakýchkoli komerčních nebo finančních vztahů, které by mohly být chápány jako potenciální střet zájmů.
Poděkování
Vděčně děkujeme za finanční podporu XW (grant č. 201408620031 pro XW), který poskytla Čínská rada pro stipendia (CSC). Tato studie byla podpořena Helmholtz Gemeinschaft (HGF) financováním Helmholtzovy skupiny mladých výzkumníků SL (VH-NG-919).
Přídavné materiály
Přídavné materiály k tomuto článku naleznete online na adrese: https://www.frontiersin.org/article/10.3389/fmicb.2017.01339/full#supplementary-material
Přílohy
- ^ http://metanogen.biotech.uni.wroc.pl/
- ^ http://www.ncbi.nlm.nih.gov/
- ^ http://metanogen.biotech.uni.wroc.pl/
- ^ https://www.ngdc.noaa.gov/mgg/shorelines/gshhs.html
- ^ http://qgis.osgeo.org
Auguet, J. C., Barberan, A., a Casamayor, E. O. (2010). Globální ekologické vzorce u nekultivovaných Archaea. ISME J. 4, 182-190. doi: 10.1038/ismej.2009.109
PubMed Abstract | CrossRef Full Text | Google Scholar
Bange, H. W., Bartell, U. H., Rapsomanikis, S., and Andreae, M. O. (1994). Metan v Baltském a Severním moři a přehodnocení emisí metanu do moře. Glob. Biogeochem. Cycles 8, 465-480. doi: 10.1029/94GB02181
CrossRef Full Text | Google Scholar
Barreto, D. P., Conrad, R., Klose, M., Claus, P., and Enrich-Prast, A. (2014). Vztahy mezi vzdáleností a rozpadem a mezi taxony a plochou pro bakterie, archea a metanogenní archea v tropickém jezerním sedimentu. PLoS ONE 9:e110128. doi: 10.1371/journal.pone.0110128
PubMed Abstract | CrossRef Full Text | Google Scholar
Bartlett, K. B., Bartlett, D. S., Harriss, R. C., a Sebacher, D. I. (1987). Methane emissions along a salt marsh salinity gradient. Biogeochemistry 4, 183-202. doi: 10.1007/BF02187365
CrossRef Full Text | Google Scholar
Borrel, G., O’Toole, P. W., Harris, H. M. B., Peyret, P., Brugere, J. F., and Gribaldo, S. (2013). Fylogenomická data podporují sedmý řád methylotrofních methanogenů a poskytují vhled do evoluce methanogeneze. Genome Biol. Evol. 5, 1769-1780. doi: 10.1093/Gbe/Evt128
PubMed Abstract | CrossRef Full Text | Google Scholar
Bousquet, P., Ciais, P., Miller, J., Dlugokencky, E., Hauglustaine, D., Prigent, C., et al. (2006). Contribution of anthropogenic and natural sources to atmospheric methane variability (Příspěvek antropogenních a přírodních zdrojů k variabilitě metanu v atmosféře). Nature 443, 439-443. doi: 10.1038/nature05132
PubMed Abstract | CrossRef Full Text | Google Scholar
Bridgham, S. D., Cadillo-Quiroz, H., Keller, J. K., and Zhuang, Q. (2013). Emise metanu z mokřadů: biogeochemické, mikrobiální a modelovací perspektivy od lokálního po globální měřítko. Glob. Chang. Biol. 19, 1325-1346. doi: 10.1111/gcb.12131
PubMed Abstract | CrossRef Full Text | Google Scholar
Cao, H., Auguet, J.-C., and Gu, J.-D. (2013). Globální ekologický vzorec archeí oxidujících amoniak. PLoS ONE 8:e52853. doi: 10.1371/journal.pone.0052853
PubMed Abstract | CrossRef Full Text | Google Scholar
Caporaso, J. G., Lauber, C. L., Walters, W. A., Berg-Lyons, D., Lozupone, C. A., Turnbaugh, P. J., et al. (2011). Globální vzorce diverzity 16S rRNA v hloubce milionů sekvencí na vzorek. Proc. Natl. Acad. Sci. U.S.A. 108, 4516-4522. doi: 10.1073/pnas.1000080107
PubMed Abstract | CrossRef Full Text | Google Scholar
Chaffron, S., Rehrauer, H., Pernthaler, J., and von Mering, C. (2010). Globální síť koexistujících mikrobů z environmentálních a celogenomových sekvenčních dat. Genome Res. 20, 947-959. doi: 10.1101/gr.104521.109
PubMed Abstract | CrossRef Full Text | Google Scholar
Church, M. J., Bjorkman, K. M., Karl, D. M., Saito, M. A., and Zehr, J. P. (2008). Regionální distribuce bakterií vázajících dusík v Tichém oceánu. Limnol. Oceanogr. 53, 63-77. doi: 10.4319/lo.2008.53.1.0063
CrossRef Full Text | Google Scholar
Conrad, R. (2007). „Mikrobiální ekologie metanogenů a metanotrofů,“ in Pokroky v agronomii, vyd. L. S. Donald (Cambridge, MA: Academic Press), 1-63.
Google Scholar
Cornwell, W. K., Schwilk, D. W., and Ackerly, D. D. (2006). Test pro filtrování stanovišť založený na vlastnostech: objem konvexního trupu. Ecology 87, 1465-1471. doi: 10.1890/0012-9658(2006)872.0.CO;2
PubMed Abstract | CrossRef Full Text | Google Scholar
Crump, B. C., Amaral-Zettler, L. A., and Kling, G. W. (2012). Mikrobiální diverzita v arktických sladkých vodách je strukturována inokulací mikrobů z půdy. ISME J. 6, 1629-1639. doi: 10.1038/ismej.2012.9
PubMed Abstract | CrossRef Full Text | Google Scholar
Cui, M., Ma, A., Qi, H., Zhuang, X., Zhuang, G., and Zhao, G. (2015). Vyšší teplota urychluje emise metanu z mokřadu Zoige na Tibetské náhorní plošině, aniž by se změnilo složení metanogenního společenstva. Sci. Rep. 5:11616. doi: 10.1038/srep11616
PubMed Abstract | CrossRef Full Text | Google Scholar
Cunliffe, M., Schafer, H., Harrison, E., Cleave, S., Upstill-Goddard, R., and Murrell, J. C. (2008). Fylogenetická a funkční genová analýza bakteriálních a archeálních společenstev spojených s povrchovou mikrovrstvou ústí řeky. ISME J. 2, 776-789. doi: 10.1038/ismej.2008.28
PubMed Abstract | CrossRef Full Text | Google Scholar
Dray, S., and Dufour, A. B. (2007). Balíček ade4: implementace duálního diagramu pro ekology. J. Stat. Softw. 22, 1-20. doi: 10.18637/jss.v022.i04
CrossRef Full Text | Google Scholar
Dufrene, M., and Legendre, P. (1997). Druhová společenstva a indikační druhy: potřeba flexibilního asymetrického přístupu. Ecol. Monogr. 67, 345-366. doi: 10.2307/2963459
CrossRef Full Text | Google Scholar
Edgar, R. C., Haas, B. J., Clemente, J. C., Quince, C., and Knight, R. (2011). UCHIME zlepšuje citlivost a rychlost detekce chimér. Bioinformatics 27, 2194-2200. doi: 10.1093/bioinformatics/btr381
PubMed Abstract | CrossRef Full Text | Google Scholar
Evans, P. N., Parks, D. H., Chadwick, G. L., Robbins, S. J., Orphan, V. J., Golding, S. D. a další (2015). Metabolismus metanu v archeálním fylu Bathyarchaeota odhalený pomocí genomově orientované metagenomiky. Science 350, 434-438. doi: 10.1126/science.aac7745
PubMed Abstract | CrossRef Full Text | Google Scholar
Fish, J. A., Chai, B., Wang, Q., Sun, Y., Brown, C. T., Tiedje, J. M., et al. (2013). FunGene: funkční genová pipeline a úložiště. Front. Microbiol. 4:291. doi: 10.3389/fmicb.2013.00291
PubMed Abstract | CrossRef Full Text | Google Scholar
Frank-Fahle, B. A., Yergeau, E., Greer, C. W., Lantuit, H., and Wagner, D. (2014). Mikrobiální funkční potenciál a složení společenstev v půdách ovlivněných permafrostem v severozápadní části kanadské Arktidy. PLoS ONE 9:e84761. doi: 10.1371/journal.pone.0084761.g001
PubMed Abstract | CrossRef Full Text | Google Scholar
Fukuzaki, S., Nishio, N., and Nagai, S. (1990). Kinetika metanogenní fermentace acetátu. Appl. environ. Microbiol. 56, 3158-3163.
Google Scholar
Hanson, C. A., Fuhrman, J. A., Horner-Devine, M. C., and Martiny, J. B. (2012). Beyond biogeographic patterns: processes shaping the microbial landscape (Za hranice biogeografických vzorců: procesy utvářející mikrobiální krajinu). Nat. Rev. Microbiol. 10, 497-506. doi: 10.1038/Nrmicro2795
PubMed Abstract | CrossRef Full Text | Google Scholar
Holm, G. O., Perez, B. C., McWhorter, D. E., Krauss, K. W., Johnson, D. J., Raynie, R. C., et al. (2016). Ecosystem level methane fluxes from tidal freshwater and brackish marshes of the Mississippi River Delta: implications for coastal wetland carbon projects [Toky metanu z přílivových sladkovodních a brakických bažin v deltě řeky Mississippi na úrovni ekosystému: důsledky pro projekty týkající se uhlíku v pobřežních mokřadech]. Wetlands 36, 401-413. doi: 10.1007/s13157-016-0746-7
CrossRef Full Text | Google Scholar
Hunger, S., Schmidt, O., Hilgarth, M., Horn, M. A., Kolb, S., Conrad, R., et al. (2011). Competing formate- and carbon dioxide-utilizing prokaryotes in anoxic methane-emitting fen soil [Konkurence prokaryot využívajících oxid uhličitý v anoxické bažinaté půdě]. Appl. Environ. Microbiol. 77, 3773-3785. doi: 10.1128/AEM.00282-11
PubMed Abstract | CrossRef Full Text | Google Scholar
IPCC (2007). „Climate Change 2007: the Physical Science Basis,“ in Proceedings of the Contribution of Working Group I to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change, eds D. Qin, S. Solomon, M. Manning, Z. Chen, M. Marquis, K. B. Averyt, et al. (Cambridge: Cambridge University Press).
Google Scholar
Jabłoński, S., Rodowicz, P. a Łukaszewicz, M. (2015). Databáze metanogenních archeí obsahující fyziologické a biochemické charakteristiky. Int. J. Syst. Evol. Microbiol. 65, 1360-1368. doi: 10.1099/ijs.0.000065
PubMed Abstract | CrossRef Full Text | Google Scholar
Kirschke, S., Bousquet, P., Ciais, P., Saunois, M., Canadell, J. G., Dlugokencky, E. J., et al. (2013). Tři desetiletí globálních zdrojů a propadů metanu. Nat. Geosci. 6, 813-823. doi: 10.1038/Ngeo1955
CrossRef Full Text | Google Scholar
Knief, C. (2015). Diverzita a habitatové preference kultivovaných a nekultivovaných aerobních metanotrofních bakterií hodnocené na základě pmoA jako molekulárního markeru. Front. Microbiol. 6:1346. doi: 10.3389/fmicb.2015.01346
PubMed Abstract | CrossRef Full Text | Google Scholar
Kotsyurbenko, O., Friedrich, M., Simankova, M., Nozhevnikova, A., Golyshin, P., Timmis, K., et al. (2007). Posun od acetoklastické k H2-dependentní metanogenezi v západosibiřském rašeliništi při nízkých hodnotách pH a izolace acidofilního kmene Methanobacterium. Appl. Environ. Microbiol. 73, 2344-2348. doi: 10.1128/AEM.02413-06
PubMed Abstract | CrossRef Full Text | Google Scholar
Langenheder, S., and Székely, A. J. (2011). Třídění druhů i neutrální procesy jsou důležité při počátečním sestavování bakteriálních společenstev. ISME J. 5, 1086-1094. doi: 10.1038/ismej.2010.207
PubMed Abstract | CrossRef Full Text | Google Scholar
Liebner, S., Ganzert, L., Kiss, A., Yang, S., Wagner, D., and Svenning, M. M. (2015). Posuny ve složení metanogenních společenstev a tocích metanu podél degradace diskontinuálního permafrostu. Front. Microbiol. 6:356. doi: 10.3389/fmicb.2015.00356
PubMed Abstract | CrossRef Full Text | Google Scholar
Liu, Y. Q., Priscu, J. C., Xiong, J. B., Conrad, R., Vick-Majors, T., Chu, H. Y., et al. (2016). Salinity drives archaeal distribution patterns in high altitude lake sediments on the Tibetan Plateau (Slanost určuje vzorce distribuce archeí ve vysokohorských jezerních sedimentech na Tibetské náhorní plošině). FEMS Microbiol. Ecol. 92:fiw033. doi: 10.1093/femsec/fiw033
PubMed Abstract | CrossRef Full Text | Google Scholar
Logares, R., Lindstrom, E. S., Langenheder, S., Logue, J. B., Paterson, H., Laybourn-Parry, J., et al. (2013). Biogeografie bakteriálních společenstev vystavených postupným dlouhodobým změnám prostředí. ISME J. 7, 937-948. doi: 10.1038/ismej.2012.168
PubMed Abstract | CrossRef Full Text | Google Scholar
Loreau, M., Naeem, S., Inchausti, P., Bengtsson, J., Grime, J. P., Hector, A., et al. (2001). Biodiverzita a fungování ekosystémů: současné znalosti a budoucí výzvy. Science 294, 804-808. doi: 10.1126/science.1064088
PubMed Abstract | CrossRef Full Text | Google Scholar
Lozupone, C. A., and Knight, R. (2007). Globální vzorce bakteriální diverzity. Proc. Natl. Acad. Sci. U.S.A. 104, 11436-11440. doi: 10.1073/pnas.0611525104
PubMed Abstract | CrossRef Full Text | Google Scholar
Luton, P. E., Wayne, J. M., Sharp, R. J., and Riley, P. W. (2002). Gen mcrA jako alternativa k 16S rRNA při fylogenetické analýze populací metanogenů na skládkách. Microbiology 148, 3521-3530. doi: 10.1099/00221287-148-11-3521
PubMed Abstract | CrossRef Full Text | Google Scholar
Lutz, S., Anesio, A. M., Raiswell, R., Edwards, A., Newton, R. J., Gill, F., et al. (2016). Biogeografie mikrobů červeného sněhu a jejich role v tání arktických ledovců. Nat. Commun. 7:11968. doi: 10.1038/ncomms11968
PubMed Abstract | CrossRef Full Text | Google Scholar
Martiny, J. B. H., Bohannan, B. J. M., Brown, J. H., Colwell, R. K., Fuhrman, J. A., Green, J. L., et al. (2006). Microbial biogeography: putting microorganisms on the map (Mikrobiální biogeografie: zobrazení mikroorganismů na mapě). Nat. Rev. Microbiol. 4, 102-112. doi: 10.1038/Nrmicro1341
PubMed Abstract | CrossRef Full Text | Google Scholar
Martiny, J. B. H., Eisen, J. A., Penn, K., Allison, S. D., and Horner-Devine, M. C. (2011). Drivers of bacterial beta-diversity depend on spatial scale (Hnací síly bakteriální beta-diverzity závisí na prostorovém měřítku). Proc. Natl. Acad. Sci. U.S.A. 108, 7850-7854. doi: 10.1073/pnas.1016308108
PubMed Abstract | CrossRef Full Text | Google Scholar
McArdle, B. H., and Anderson, M. J. (2001). Fitting multivariate models to community data: a comment on distance-based redundancy analysis (Přizpůsobení vícerozměrných modelů údajům o společenstvích: komentář k analýze nadbytečnosti založené na vzdálenosti). Ecology 82, 290-297. doi: 10.1890/0012-9658(2001)0822.0.CO;2
CrossRef Full Text | Google Scholar
McCalley, C. K., Woodcroft, B. J., Hodgkins, S. B., Wehr, R. A., Kim, E.-H., Mondav, R. a další (2014). Dynamika metanu regulovaná reakcí mikrobiálních společenstev na tání permafrostu. Nature 514, 478-481. doi: 10.1038/nature13798
PubMed Abstract | CrossRef Full Text | Google Scholar
McGenity, T. J. (2010). „Methanogens and Methanogenesis in Hypersaline Environments,“ in Handbook of Hydrocarbon and Lipid Microbiology, vyd. K. N. Timmis (Berlin: Springer), 665-680. doi: 10.1007/978-3-540-77587-4_53
CrossRef Full Text | Google Scholar
McLusky, D. S., and Elliott, M. (2004). Estuární ekosystém: Ecology, Threats and Management (Ekologie, hrozby a řízení). New York, NY: Oxford University Press. doi: 10.1093/acprof:oso/9780198525080.001.0001
CrossRef Full Text | Google Scholar
Megonigal, J. P., Mines, M. E., and Visscher, P. T. (2005). „Anaerobní metabolismus: vazby na stopové plyny a aerobní procesy,“ in Biogeochemistry, ed. W. H. Schlesinger (Oxford: Elsevier), 350-362.
Google Scholar
Milferstedt, K., Youngblut, N. D., and Whitaker, R. J. (2010). Prostorová struktura a perzistence metanogenních populací v huminových rašelinných jezerech. ISME J. 4, 764-776. doi: 10.1038/Ismej.2010.7
PubMed Abstract | CrossRef Full Text | Google Scholar
Mosier, A. C., and Francis, C. A. (2008). Relativní početnost a diverzita archeí a bakterií oxidujících amoniak v ústí Sanfranciského zálivu. Environ. Microbiol. 10, 3002-3016. doi: 10.1111/j.1462-2920.2008.01764.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Nazaries, L., Murrell, J. C., Millard, P., Baggs, L., and Singh, B. K. (2013). Metan, mikrobi a modely: základní porozumění koloběhu metanu v půdě pro budoucí předpovědi. Environ. Microbiol. 15, 2395-2417. doi: 10.1111/1462-2920.12149
PubMed Abstract | CrossRef Full Text | Google Scholar
Nelson, M. B., Martiny, A. C., and Martiny, J. B. H. (2016). Globální biogeografie mikrobiálních znaků koloběhu dusíku v půdě. Proc. Natl. Acad. Sci. U.S.A. 113, 8033-8040. doi: 10.1073/pnas.1601070113
PubMed Abstract | CrossRef Full Text | Google Scholar
Nemergut, D. R., Costello, E. K., Hamady, M., Lozupone, C., Jiang, L., Schmidt, S. K., et al. (2011). Global patterns in the biogeography of bacterial taxa (Globální vzorce v biogeografii bakteriálních taxonů). Environ. Microbiol. 13, 135-144. doi: 10.1111/j.1462-2920.2010.02315.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Nobu, M. K., Narihiro, T., Kuroda, K., Mei, R., and Liu, W. T. (2016). Honba za nepolapitelnou třídou Euryarchaeota WSA2: genomy odhalují unikátně rychlý methanogen redukující metyl. ISME J. 10, 2478-2487. doi: 10.1038/ismej.2016.33
PubMed Abstract | CrossRef Full Text | Google Scholar
Oksanen, J., Blanchet, F. G., Kindt, R., Legendre, P., Minchin, P. R., O’Hara, R. B., et al. (2015). vegan: Community Ecology Package (Balíček ekologie společenství). R Package Version 2.2.0. Dostupné na adrese: https://CRAN.R-project.org/package=vegan
Google Scholar
Oloo, F., Valverde, A., Quiroga, M. V., Vikram, S., Cowan, D. a Mataloni, G. (2016). Habitatová heterogenita a konektivita formují mikrobiální společenstva v jihoamerických rašeliništích. Sci. Rep. 6:25712. doi: 10.1038/srep25712
PubMed Abstract | CrossRef Full Text | Google Scholar
Pattnaik, P., Mishra, S. R., Bharati, K., Mohanty, S. R., Sethunathan, N., and Adhya, T. K. (2000). Vliv salinity na methanogenezi a související mikroflóru v tropických rýžových půdách. Microbiol. Res. 155, 215-220. doi: 10.1016/S0944-5013(00)80035-X
PubMed Abstract | CrossRef Full Text | Google Scholar
Poffenbarger, H. J., Needelman, B. A., and Megonigal, J. P. (2011). Salinity influence on methane emissions from tidal marshes [Vliv salinity na emise metanu z přílivových bažin]. Wetlands 31, 831-842. doi: 10.1007/s13157-011-0197-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Potter, E. G., Bebout, B. M., and Kelley, C. A. (2009). Izotopové složení metanu a odvozených metanogenních substrátů podél gradientu salinity v hypersalinním mikrobiálním matovém systému. Astrobiology 9, 383-390. doi: 10.1089/ast.2008.0260
PubMed Abstract | CrossRef Full Text | Google Scholar
R Core Team (2014). R: Jazyk a prostředí pro statistické výpočty (verze 3.0.3). Vídeň: R Foundation for Statistical Computing.
Google Scholar
Roberts, D. (2016). labdsv: Ordinace a vícerozměrná analýza pro ekologii. R Package Version 1.8-0. Dostupné na: https://CRAN.R-project.org/package=labdsv
Google Scholar
Rooney-Varga, J. N., Giewat, M. W., Duddleston, K. N., Chanton, J. P. a Hines, M. E. (2007). Links between archaeal community structure, vegetation type and methanogenic pathway in Alaskan peatlands (Souvislosti mezi strukturou archeálních společenstev, typem vegetace a metanogenní cestou v aljašských rašeliništích). FEMS Microbiol. Ecol. 60, 240-251. doi: 10.1111/j.1574-6941.2007.00278.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Rosenberg, E., DeLong, E. F., Lory, S., Stackebrandt, E., and Thompson, F. (2014). Prokaryota: Další hlavní linie bakterií a archeí. Berlin: Springer.
Google Scholar
Ruff, S. E., Biddle, J. F., Teske, A. P., Knittel, K., Boetius, A., and Ramette, A. (2015). Globální rozptyl a lokální diverzifikace mikrobiomu metanových průsaků. Proc. Natl. Acad. Sci. U.S.A. 112, 4015-4020. doi: 10.1073/pnas.1421865112
PubMed Abstract | CrossRef Full Text | Google Scholar
Schauer, R., Bienhold, C., Ramette, A., and Harder, J. (2009). Bakteriální diverzita a biogeografie v hlubokomořských povrchových sedimentech jižního Atlantiku. ISME J. 4, 159-170. doi: 10.1038/ismej.2009.106
PubMed Abstract | CrossRef Full Text | Google Scholar
Schloss, P. D., Westcott, S. L., Ryabin, T., Hall, J. R., Hartmann, M., Hollister, E. B., et al. (2009). Introducing mothur: open-source, platform-independent, community-supported software for describing and comparing microbial communities. Appl. Environ. Microbiol. 75, 7537-7541. doi: 10.1128/Aem.01541-09
PubMed Abstract | CrossRef Full Text | Google Scholar
Statham, P. J. (2012). Živiny v ústích řek – přehled a možné dopady změny klimatu. Sci. Total Environ. 434, 213-227. doi: 10.1016/j.scitotenv.2011.09.088
PubMed Abstract | CrossRef Full Text | Google Scholar
Thauer, R. K., Kaster, A.-K., Seedorf, H., Buckel, W., and Hedderich, R. (2008). Methanogenní archea: ekologicky relevantní rozdíly v šetření energií. Nat. Rev. Microbiol. 6, 579-591. doi: 10.1038/Nrmicro1931
PubMed Abstract | CrossRef Full Text | Google Scholar
Tilman, D., Isbell, F., and Cowles, J. M. (2014). Biodiverzita a fungování ekosystémů. Annu. Rev. Ecol. Evol. Syst. 45, 471-493. doi: 10.1146/annurev-ecolsys-120213-091917
CrossRef Full Text | Google Scholar
Ulrich, W., Hajdamowicz, I., Zalewski, M., Stañska, M., Ciurzycki, W., and Tykarski, P. (2010). Druhový sortiment nebo filtrování stanovišť: případová studie společenstev pavouků na jezerních ostrovech. Ecol. Res. 25, 375-381. doi: 10.1007/s11284-009-0661-y
CrossRef Full Text | Google Scholar
Vanwonterghem, I., Evans, P. N., Parks, D. H., Jensen, P. D., Woodcroft, B. J., Hugenholtz, P., et al. (2016). Methylotrofní methanogeneze objevená v archeálním fylu Verstraetearchaeota. Nat. Microbiol. 1:16170. doi: 10.1038/nmicrobiol.2016.170
PubMed Abstract | CrossRef Full Text | Google Scholar
von Mering, C., Hugenholtz, P., Raes, J., Tringe, S. G., Doerks, T., Jensen, L. J., et al. (2007). Kvantitativní fylogenetické hodnocení mikrobiálních společenstev v různých prostředích. Science 315, 1126-1130. doi: 10.1126/science.1133420
PubMed Abstract | CrossRef Full Text | Google Scholar
Wagner, D., and Liebner, S. (2009). „Global warming and carbon dynamics in permafrost soils: methane production and oxidation,“ in Permafrost Soils, vyd. R. Margesin (Berlin: Springer), 219-236.
Google Scholar
Weiher, E., and Keddy, P. (2001). Pravidla ekologického shromažďování: Perspectives, Advances, Retreats (Perspektivy, pokroky, ústupy). Cambridge: Cambridge University Press.
Google Scholar
Whitaker, R. J., Grogan, D. W., and Taylor, J. W. (2003). Geografické bariéry izolují endemické populace hypertermofilních archeí. Science 301, 976-978. doi: 10.1126/science.1086909
PubMed Abstract | CrossRef Full Text | Google Scholar
Wickham, H. (2009). ggplot2: Elegantní grafika pro analýzu dat. New York, NY: Springer-Verlag. doi: 10.1007/978-0-387-98141-3
CrossRef Full Text | Google Scholar
Yang, J., Ma, L. A., Jiang, H., Wu, G., and Dong, H. (2016). Salinita formuje mikrobiální diverzitu a strukturu společenstev v povrchových sedimentech čchinghajsko-tibetských jezer. Sci. Rep. 6:25078. doi: 10.1038/srep25078
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, S., Liebner, S., Alawi, M., Ebenhöh, O., and Wagner, D. (2014). Taxonomická databáze a mezní hodnota pro zpracování dat pyrosekvenování 454 genů mcrA pomocí MOTHUR. J. Microbiol. Methods 103, 3-5. doi: 10.1016/j.mimet.2014.05.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, S., Liebner, S., Winkel, M., Alawi, M., Horn, F., Dörfer, C., et al. (2017). Hloubková analýza jádrových metanogenních společenstev z vysoko položených mokřadů ovlivněných permafrostem. Soil Biol. Biochem. 111, 66-77. doi: 10.1016/j.soilbio.2017.03.007
CrossRef Full Text | Google Scholar
Ye, R. Z., Jin, Q. S., Bohannan, B., Keller, J. K., McAllister, S. A., and Bridgham, S. D. (2012). pH controls over anaerobic carbon mineralization, efficiency of methane production, and methanogenic pathways in peatlands across an ombrotrophic-minerotrophic gradient. Soil Biol. Biochem. 54, 36-47. doi: 10.1016/j.soilbio.2012.05.015
CrossRef Full Text | Google Scholar
Zinder, S. H. (1993). „Physiological ecology of methanogens,“ in Methanogenesis: Ecology, Physiology, Biochemistry & Genetics, ed. J. G. Ferry (Boston, MA: Springer), 128-206.
Google Scholar
Zinger, L., Amaral-Zettler, L. A., Fuhrman, J. A., Horner-Devine, M. C., Huse, S. M., Welch, D. B. M., et al. (2011). Globální vzorce bakteriální beta-diverzity v ekosystémech mořského dna a mořské vody. PLoS ONE 6:e24570. doi: 10.1371/journal.pone.0024570
PubMed Abstract | CrossRef Full Text | Google Scholar
.