T-regulační buňky (Tregs), dříve známé jako T-supresorové buňky, jsou podskupinou T-buněk s přímou úlohou v autoimunitě i v reakcích na patogeny.
Tregs snižují zánět prostřednictvím sekrece imunosupresivních cytokinů (IL-10, TGF-b) a také přímým potlačením zánětlivých efektorových T buněk (jako jsou Th1 a Th17 buňky).
Tregs kontrolují autoimunitní onemocnění a pravděpodobně jim předcházejí tím, že přispívají k udržení tolerance vůči vlastním antigenům. Terapeutický přínos přenosu Treg je dobře prokázán na zvířecích modelech a probíhají snahy o zahájení terapie lidskými Treg pro transplantace a pacienty s diabetem 1. typu.
Vzhledem k významu této jedinečné podskupiny T buněk v tolika imunitních reakcích se mnozí výzkumníci cítí nedoceněni, pokud imunofenotypizují své zájmové buněčné populace, aniž by do směsi zahrnuli měření Treg. Kvantifikace Tregs však může být komplikovaná.
Například – jaké markery je nejlepší použít? Jak s jistotou víte, že měříte skutečné supresorové T-buňky?
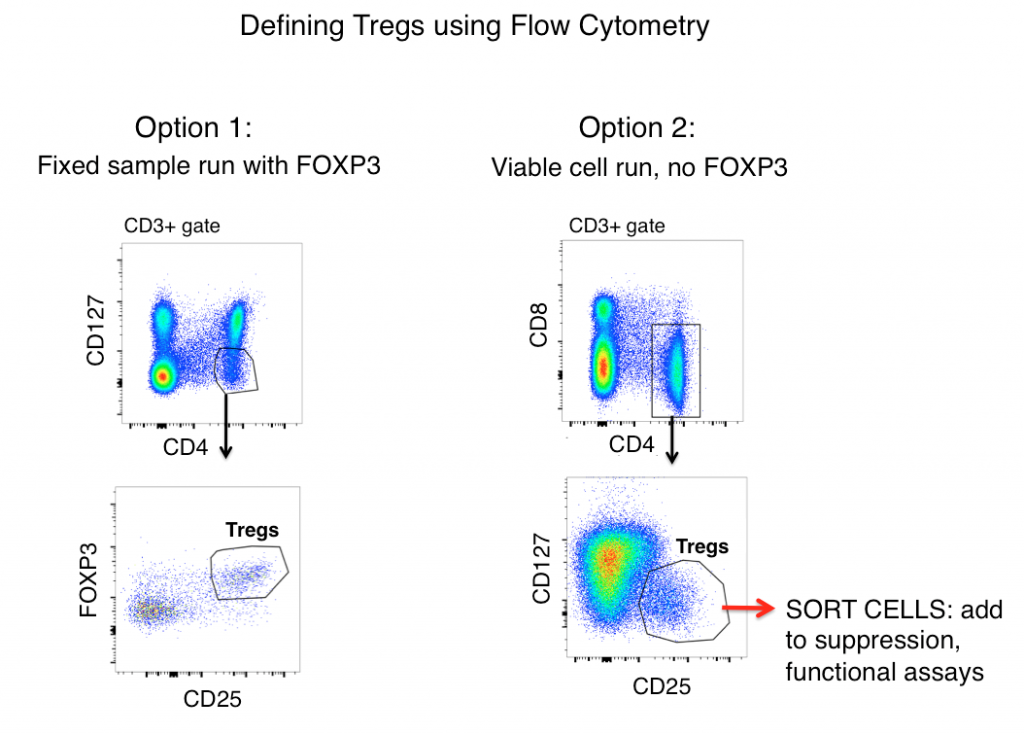
Strategie gatingu pro definování Tregs pomocí průtokové cytometrie
Standardní strategie gatingu Treg pro myší i lidské vzorky (po předchozím vyřazení dublet a gatingu na živých buňkách) zahrnuje antigeny CD3, CD4, CD25, FOXP3 a CD127.
Při pohledu výhradně na expresi antigenu se Tregs často definují jako CD3+, CD4+, CD25hi, FOXP3+ a CD127lo (na obrázku níže uvedeno jako možnost 1). Při použití těchto markerů je často patrná jasná populace ze vzorků, jako jsou myší splenocyty a lidské PBMC.
Aktivované T-lymfocyty však často regulují CD25 a exprese FOXP3 byla zjištěna u „efektorových“ (nesupresivních) linií T-buněk. Pokud se tedy při definování Treg spoléháme pouze na fenotypizaci průtokovou cytometrií, mohou být zánětlivé T buňky vlkem v rouše beránčím (Treg) a vést k nesprávné interpretaci údajů.
Buňka může vypadat jako kachna, ale kváká? Měření efektorových funkcí vaší možné populace Treg výrazně pomůže objasnit přesnost vaší strategie flow gatingu. Abyste zjistili, zda se buňky, které definujete jako Treg, funkčně podobají, zahrnuje možnost 2 (viz níže) vynechání FOXP3 z vašeho panelu, třídění buněk CD3+, CD4+, CD25hi, CD127lo a následné stanovení funkcí vaší populace „Treg“ pomocí analýzy cytokinů a/nebo testů suprese v kokultuře s non-Treg T buňkami (CD3+ CD4+ CD25-, CD127hi). Obvykle nelze FOXP3 zahrnout do panelů, kde jsou po roztřídění vyžadovány životaschopné buňky, protože je vyžadováno intracelulární barvení.
Defining The Increasing Variety Of Treg Subsets
Existuje mnoho variant Tregs, včetně tTregs, pTregs a iTregs.
Například tTregs (známé také jako nTregs) jsou generovány v thymu a mají repertoár TcR, který je zaujatý vůči vlastním peptidům. Další příchuť, známá jako pTregs, je generována v periferii a iTregs jsou indukovány v kultuře prostřednictvím TGF-b.
S těmito různými podskupinami Treg jsou spojeny tvůrci a měly by být zváženy pro zařazení do panelu Treg proti tělu, pokud je jejich subsetování předmětem zájmu. Například u lidí je CD39 považován za spolehlivý marker tTreg. Také u myší i lidí bylo zjištěno, že Helios spolehlivě rozlišuje tTreg od podskupin p a iTreg.
Definování jediné buňky jako Treg – je to možné?
Hlavním omezením v oblasti Treg je absence testu suprese jediné buňky.
Definování jednotlivé buňky T jako příslušníka odlišné paměťové linie, například Th1, Th2 nebo Th17, lze provést pomocí analýzy analytů s rozlišením jedné buňky, například pomocí intracelulárního barvení cytokinů, protože tyto buňky jsou definovány především, ne-li výhradně tím, jaké cytokiny produkují.
Chceme-li však prokázat, že jedna buňka je Treg, chceme být v ideálním případě schopni kvantifikovat, že tato jedna vybraná buňka dokáže potlačit funkci efektorových T buněk (nebo jiných buněčných podskupin) ve společné kultuře. V současné době je jediný způsob, jak testovat supresivní funkci Treg, v hromadné kultuře, kde lze dojít k závěru, že některé (ale ne všechny, možná ani ne většina) z buněk označených jako Treg jsou supresivní.
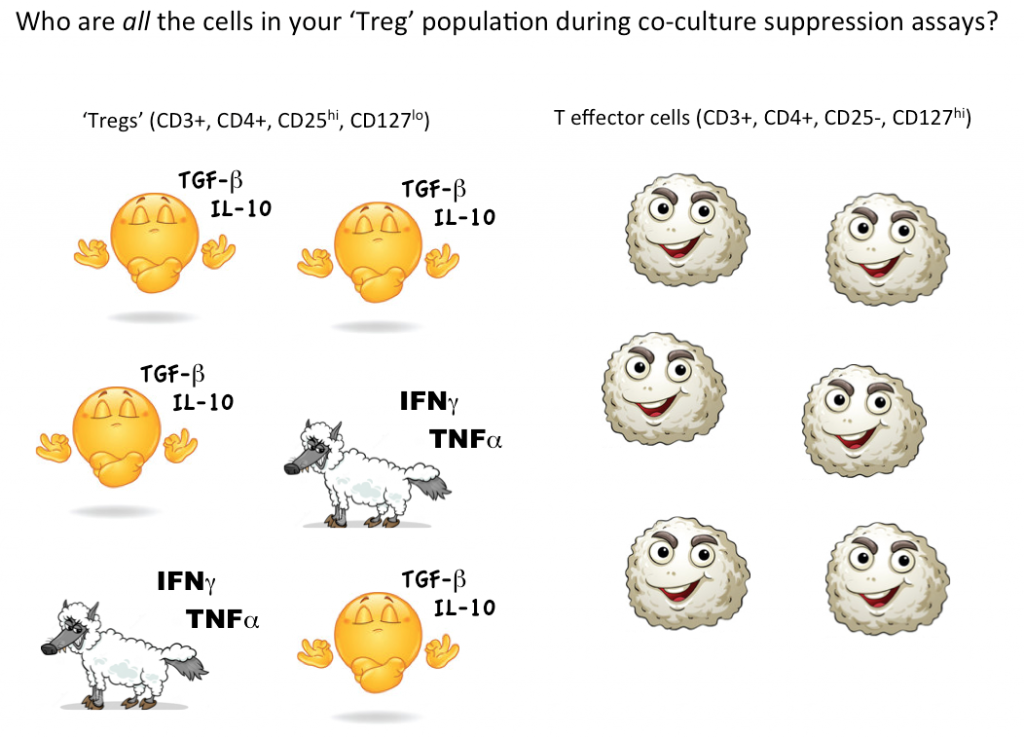
Přemýšlíme-li opět o potenciálních „vlcích z efektorových T buněk“ v rouše beránčím, prostě nevíme, kolik nesupresivních, dokonce zánětlivých buněk se skrývá v naší strategii bránění Treg. Použití průtokové cytometrie k tomu, abyste nejprve zapnuli a roztřídili životaschopné buňky s markery odpovídajícími Treg, a poté funkčně otestovali, zda se buňky definované vaší gatingovou strategií jako skupina skutečně chovají jako Treg, je v současné době nejlepší způsob, jak kvantifikovat Treg ve vašem vzorku.
Provedením správných gatingových strategií pro definování Treg pomocí průtokové cytometrie a zohledněním rostoucího počtu podskupin Treg můžete vyčlenit vaše zájmové populace Treg. Klíčem k úspěchu je po identifikaci těchto populací jejich funkční testování, protože v současné době je obtížné, ne-li nemožné, definovat jedinou buňku jako Treg. Každodenně však dochází k pokroku a nakonec bude možné správně označit jednotlivé buňky Treg.
Chcete-li se dozvědět více o analýze T buněk a dalších typů buněk pomocí průtokové cytometrie a získat přístup ke všem našim pokročilým materiálům včetně 20 školicích videí, prezentací, pracovních sešitů a členství v soukromé skupině, zařaďte se na čekací listinu kurzu Flow Cytometry Mastery Class.
 .
.