Generický název: naftifin hydrochlorid
Dávkovací forma: krém
Medicínsky přezkoumáno Drugs.com. Naposledy aktualizováno 1. ledna 2021.
- Přehled
- Nežádoucí účinky
- Dávkování
- Profesionální
- Těhotenství
- Další
Indikace a použití přípravku Naftifin krém
Naftifin hydrochlorid krém je určen k léčbě interdigitální tinea pedis, tinea cruris a tinea corporis způsobené organismem Trichophyton rubrum.
Dávkování a způsob podání přípravku Naftifin krém
Pouze k lokálnímu použití. Naftifin-hydrochlorid krém není určen k oftalmologickému, perorálnímu ani intravaginálnímu použití. Nanášejte tenkou vrstvu naftifin-hydrochloridového krému jednou denně na postižená místa plus ½ cm okraj zdravé okolní kůže po dobu 2 týdnů.
Dávkovací formy a síla
Každý gram obsahuje 20 mg naftifin-hydrochloridu (2%) v bílém až téměř bílém základu.
Kontraindikace
Žádné
Upozornění a opatření
Lokální nežádoucí účinky
Přerušte léčbu, pokud se při používání naftifin-hydrochloridového krému objeví podráždění nebo přecitlivělost. Nasměrujte pacienty, aby kontaktovali svého lékaře, pokud se tyto stavy po použití naftifin-hydrochloridového krému objeví.
Nežádoucí účinky
Zkušenosti z klinických studií
Vzhledem k tomu, že klinické studie probíhají za velmi rozdílných podmínek, nelze výskyt nežádoucích účinků pozorovaných v klinických studiích léčiva přímo srovnávat s výskytem v klinických studiích jiného léčiva a nemusí odrážet výskyt pozorovaný v klinické praxi.
Během klinických studií bylo 903 subjektů vystaveno působení přípravku naftifin 1% a 2% krém. Celkem 564 subjektů s interdigitální tinea pedis, tinea cruris nebo tinea corporis bylo léčeno naftifin hydrochlorid krémem.
Ve dvou randomizovaných, vehikulem kontrolovaných studiích (400 subjektů bylo léčeno naftifin hydrochlorid krémem). Populace byla ve věku 12 až 88 let, převážně mužského pohlaví (79 %), 48 % bělochů, 36 % černochů nebo Afroameričanů, 40 % Hispánců nebo Latinoameričanů a měla buď převážně interdigitální tinea pedis, nebo tinea cruris. Většina subjektů dostávala dávky jednou denně, lokálně, po dobu 2 týdnů k pokrytí postižených oblastí kůže plus ½ palce okraje okolní zdravé kůže. Ve dvou studiích kontrolovaných vehikulem se u 17,5 % subjektů léčených naftifin-hydrochloridovým krémem vyskytly nežádoucí účinky ve srovnání s 19,3 % subjektů léčených vehikulem. Nejčastějším nežádoucím účinkem (větším nebo rovným 1 %) je pruritus. Většina nežádoucích reakcí byla mírné závažnosti. Výskyt nežádoucích reakcí u populace léčené naftifin-hydrochloridovým krémem se významně nelišil od populace léčené vehikulem.
Ve třetí randomizované, vehikulem kontrolované studii bylo 116 pediatrických subjektů s tinea corporis léčeno naftifin-hydrochloridovým krémem. Populace byla ve věku od 2 do méně než 18 let (průměrný věk 9 let), převážně mužského pohlaví (61 %), 47 % bělochů, 51 % černochů nebo Afroameričanů, 92 % Hispánců nebo Latinoameričanů a byla infikována tinea corporis. Naftifin hydrochlorid krém byl lokálně aplikován jednou denně po dobu 2 týdnů na všechny postižené plochy povrchu těla s tinea corporis plus ½ palce okraje zdravé kůže kolem postižených lézí. Výskyt nežádoucích reakcí v populaci léčené krémem s naftifinem hydrochloridem se významně nelišil od populace léčené vehikulem.
Ve dvou otevřených pediatrických farmakokinetických a bezpečnostních studiích dostávalo 49 dětí ve věku od 2 do méně než 18 let s interdigitální tinea pedis, tinea cruris a tinea corporis krém s naftifinem hydrochloridem. Výskyt nežádoucích reakcí u pediatrické populace byl podobný jako u dospělé populace.
Postmarketingové zkušenosti
Při používání naftifin-hydrochloridu po jeho schválení byly zjištěny následující nežádoucí reakce: zarudnutí/podráždění, zánět, macerace, otok, pálení, puchýře, serózní drenáž, krusty, bolest hlavy, závratě, leukopenie, agranulocytóza.
Protože jsou tyto reakce hlášeny dobrovolně z populace nejisté velikosti, není vždy možné spolehlivě odhadnout jejich četnost nebo stanovit příčinnou souvislost s expozicí léčivu.
Použití u specifických populací
Těhotenství
Souhrn rizik
Nejsou k dispozici žádné údaje s naftifin-hydrochloridovým krémem u těhotných žen, které by informovaly o riziku závažných vrozených vad a potratů spojených s léčbou. V reprodukčních studiích na zvířatech nebyly pozorovány žádné nežádoucí účinky na vývoj embrya při perorálních dávkách podávaných v období organogeneze až do 18násobku maximální doporučené dávky pro člověka (MRHD) u březích potkanů nebo při podkožních dávkách podávaných v období organogeneze až do 2násobku MRHD u březích potkanů nebo 4násobku MRHD u březích králíků .
Odhadované základní riziko závažných vrozených vad a potratů pro uvedenou populaci není známo. Všechna těhotenství mají pozadí rizika vrozených vad, ztrát nebo jiných nepříznivých výsledků. V běžné populaci USA je odhadované riziko pozadí závažných vrozených vad a potratu u klinicky uznaných těhotenství 2 až 4 %, resp. 15 až 20 %.
Údaje
Údaje o zvířatech
Systematické studie embryofetálního vývoje byly provedeny na potkanech a králících. Pro porovnání dávek u zvířat a lidí na základě porovnání tělesného povrchu (mg/m2) je MRHD stanovena na 8 g 2% krému denně (2,67 mg/kg/den pro jedince o hmotnosti 60 kg).
Březím samicím potkanů byly v období organogeneze podávány orální dávky 30, 100 a 300 mg/kg/den naftifin-hydrochloridu. Při dávkách do 300 mg/kg/den (18násobek MRHD) nebyly zaznamenány žádné účinky související s léčbou na embryofetální vývoj. Podkožní dávky 10 a 30 mg/kg/den naftifin-hydrochloridu byly podávány v období organogeneze březím samicím potkanů. Při dávce 30 mg/kg/den (2násobek MRHD) nebyly zaznamenány žádné účinky související s léčbou na embryofetální vývoj. Březím samicím králíků byly v období organogeneze podávány subkutánní dávky 3, 10 a 30 mg/kg/den naftifin-hydrochloridu. Při dávce 30 mg/kg/den (4násobek MRHD) nebyly zaznamenány žádné účinky související s léčbou na embryofetální vývoj.
Byla provedena studie peri- a postnatálního vývoje u potkanů. Perorální dávky 30, 100 a 300 mg/kg/den naftifin-hydrochloridu byly podávány samicím potkanů od 14. dne březosti do 21. dne laktace. Při dávce 300 mg/kg/den (18násobek MRHD) byl zaznamenán snížený přírůstek tělesné hmotnosti samic během březosti a potomků během laktace. Při dávce 100 mg/kg/den (6násobek MRHD) nebyla zaznamenána žádná vývojová toxicita.
Kojení
Shrnutí rizik
Nejsou k dispozici žádné informace o přítomnosti naftifin-hydrochloridu smetany v lidském mléce, o účincích léčiva na kojené dítě ani o účincích léčiva na produkci mléka. Nedostatek klinických údajů během kojení vylučuje jednoznačné určení rizika naftifin-hydrochlorid krému pro kojence během kojení; proto je třeba zvážit vývoj a zdravotní přínos kojení spolu s klinickou potřebou naftifin-hydrochlorid krému u matky a případné nežádoucí účinky naftifin-hydrochlorid krému nebo základního onemocnění matky na kojeného kojence.
Pediatrické použití
Bezpečnost a účinnost naftifin-hydrochloridového krému byla stanovena u dětských pacientů od 12 let s interdigitální tinea pedis a tinea cruris a od 2 let s tinea corporis .
Použití naftifin-hydrochloridového krému v těchto věkových skupinách je podloženo důkazy z adekvátních a dobře kontrolovaných studií u dospělých a dětí, s dalšími údaji o bezpečnosti a PK ze dvou otevřených studií provedených u 49 pediatrických subjektů vystavených působení naftifin-hydrochloridového krému .
Bezpečnost a účinnost naftifin-hydrochloridového krému při léčbě tinea cruris a interdigitální tinea pedis u pediatrických pacientů mladších 12 let nebyla stanovena. Bezpečnost a účinnost naftifin-hydrochlorid krému při léčbě tinea corporis u pediatrických pacientů mladších 2 let nebyla stanovena.
Geriatrické použití
Klinické studie naftifin-hydrochloridového krému nezahrnovaly dostatečný počet subjektů ve věku 65 let a více, aby bylo možné určit, zda reagují jinak než mladší subjekty.
Naftifin krém Popis přípravku
Naftifin-hydrochloridový krém, USP je bílý až téměř bílý krém pouze pro lokální použití. Každý gram obsahuje 20 mg naftifin-hydrochloridu, USP, (2%), syntetické allylaminové antimykotické sloučeniny.
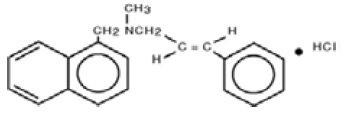
Chemicky je naftifin HCl (E)-N-Cinnamyl-N-methyl-1-napthalenemethylamine hydrochloride.
Molekulární vzorec je C21H21N-HCl s molekulovou hmotností 323,86.
Strukturní vzorec naftifin-hydrochloridu, USP je:
Naftifin-hydrochlorid krém, USP obsahuje následující neaktivní složky: benzylalkohol, cetylalkohol, vosk cetyl esterů, isopropyl myristát, polysorbát 60, čištěnou vodu, hydroxid sodný, sorbitan monostearát a stearylalkohol. K úpravě pH může být přidána kyselina chlorovodíková.
Naftifin krém – klinická farmakologie
Mechanismus účinku
Naftifin hydrochlorid krém je lokální antimykotikum .
Farmakodynamika
Farmakodynamika naftifin hydrochlorid krému nebyla stanovena.
Farmakokinetika
Studie biologické dostupnosti in vitro a in vivo prokázaly, že naftifin proniká do stratum corneum v dostatečné koncentraci, aby inhiboval růst dermatofytů.
Farmakokinetika naftifin-hydrochloridového krému byla hodnocena po lokální aplikaci jednou denně po dobu 2 týdnů u 21 dospělých osob, mužů i žen, s tinea pedis i tinea cruris. Medián celkového množství aplikovaného krému byl 6,4 g (rozmezí 5,3 g až 7,5 g) denně. Výsledky ukázaly, že systémová expozice (tj. maximální koncentrace (Cmax) a plocha pod křivkou od času 0 do 24 hodin (AUC0-24) naftifinu se během 2týdenní léčby zvýšila u všech 21 subjektů. Geometrický průměr (variační koeficient nebo CV%) AUC0-24 byl 117 (41,2) ng*hr/ml v 1. den a 204 (28,5) ng*hr/ml ve 14. den. Geometrický průměr (CV %) Cmax byl 7 ng/ml (55,6) 1. den a 11 ng/ml (29,3) 14. den. Medián doby do dosažení Cmax (Tmax) byl 8 hodin (rozmezí 4 až 24 hodin) v 1. den a 6 hodin (rozmezí 0 až 16 hodin) ve 14. den. Kumulace po 14 dnech lokální aplikace byla méně než dvojnásobná. Trough koncentrace se obecně zvyšovaly po celou dobu 14denní studie. Naftifin byl nadále detekován v plazmě u 13/21 (62 %) subjektů 28. den, průměrné plazmatické koncentrace (směrodatná odchylka nebo SD) byly 1,6 ± 0,5 ng/ml (rozmezí pod hranicí kvantifikace (BLQ) až 3 ng/ml). Ve stejné farmakokinetické studii provedené u pacientů s tinea pedis a tinea cruris byl medián frakce dávky vyloučené močí během léčebného období 0,0016 % v den 1 oproti 0,0020 % v den 14.
V druhé studii, do které bylo zařazeno 22 subjektů, byla farmakokinetika naftifin-hydrochloridu krému hodnocena u 20 pediatrických subjektů ve věku 13 až méně než 18 let s tinea pedis i tinea cruris. Subjekty byly léčeny průměrnou dávkou 8,1 g (rozmezí 6,6 g až 10,1 g) aplikovanou na postižená místa jednou denně po dobu 2 týdnů. Výsledky ukázaly, že systémová expozice se v průběhu léčby zvyšovala. Geometrický průměr (CV%) AUC0-24 byl 138 (50,2) ng*hr/ml v 1. den a 192 (74,9) ng*hr/ml ve 14. den. Geometrický průměr (CV %) Cmax byl 9,21 ng/ml (48,4) 1. den a 12,7 ng/ml (67,2) 14. den. Medián frakce dávky vyloučené močí během léčby byl 0,0030 % v den 1 a 0,0033 % v den 14.
Třetí studie hodnotila farmakokinetiku naftifin-hydrochloridového krému u 27 pediatrických subjektů ve věku 2 až méně než 12 let s alespoň středně těžkou tinea corporis. Subjekty byly rozděleny do skupin mladších (ve věku 2 až méně než 6 let, 17 subjektů) a starších (6 až méně než 12 let, 10 subjektů). Medián dávek 1,3 g (rozmezí 1 g až 3,1 g) a 2,3 g (rozmezí 2,2 g až 4,2 g) byl u mladší a starší skupiny aplikován jednou denně po dobu 2 týdnů na postiženou oblast plus ½ palce okraje. Farmakokinetické hodnocení plazmy a moči bylo provedeno 1. den pouze u starší skupiny a 14. den u obou skupin. U všech subjektů byly po lokální aplikaci naftifin-hydrochloridového krému zjištěny měřitelné hladiny naftifinu v plazmě. Po podání jedné dávky v den 1 u subjektů ve věku 6 až méně než 12 let byly hodnoty Cmax a AUC0-24 geometrického průměru (CV%) 3,60 (76,6) ng/ml a 49,8 (64,4) ng*h/ml. V této skupině byly 14. den Cmax a AUC0-24 3,31 (51,2) ng/ml a 52,4 (49,2) ng*h/ml. U subjektů ve věku 2 až méně než 6 let byly v den 14 Cmax a AUC0-24 3,98 (186) ng/ml, resp. 54,8 (150) ng*h/ml. U starší skupiny subjektů ve věku 6 až 12 let byly systémové expozice (Cmax i AUC0-24) ve dnech 1 a 14 srovnatelné. Medián frakce dávky vyloučené do moči za 24 hodin po aplikaci léku v den 1 byl 0,0029 % a v den 14 0,0014 %.
Mikrobiologie
Ačkoli přesný mechanismus účinku proti plísním není znám, zdá se, že naftifin-hydrochlorid zasahuje do biosyntézy sterolů inhibicí enzymu skvalen2,3-epoxidázy.Tato inhibice aktivity enzymu má za následek snížení množství sterolů,zejména ergosterolu, a odpovídající akumulaci skvalenu v buňkách.
Mechanismus rezistence
Dosud nebyl zjištěn mechanismus rezistence vůči naftifinu.
Bylo prokázáno, že nafifin je účinný proti většině izolátů následujících hub, a to jak in vitro, tak při klinických infekcích, jak je popsáno v části INDIKACE A POUŽITÍ:
Trichophyton rubrum
Neklinická toxikologie
Karcinogeneze, mutageneze, poškození fertility
Ve dvouleté studii dermální karcinogenity byl naftifin-hydrochloridový krém podáván potkanům Sprague-Dawley v lokálních dávkách 1%, 2% a 3% (10, 20 a 30 mg/kg/den naftifin-hydrochloridu). V této studii nebyly zaznamenány žádné nádory související s léčivem až do nejvyšší dávky hodnocené v této studii 30 mg/kg/den (12násobek MRHD na základě srovnání AUC).
Naftifin-hydrochlorid nevykazoval žádný důkaz mutagenního nebo klastogenního potenciálu na základě výsledků dvou testů genotoxicity in vitro (Amesův test a test chromozomových aberací buněk vaječníků čínského křečka) a jednoho testu genotoxicity in vivo (test mikrojader v kostní dřeni myší).
Orální podávání hydrochloridu naftifinu potkanům během páření, březosti, porodu a laktace neprokázalo žádné účinky na růst, plodnost nebo reprodukci, a to v dávkách až 100 mg/kg/den (šestinásobek MRHD).
Klinické studie
Tinea cruris
Naftifin-hydrochlorid krém byl zkoumán z hlediska bezpečnosti a účinnosti v randomizované, dvojitě zaslepené, vehikulem kontrolované, multicentrické studii u 146 subjektů se symptomatickou a kultivačně pozitivní tinea cruris. Subjekty byly randomizovány k podávání naftifin-hydrochloridového krému nebo vehikula. Subjekty aplikovaly naftifin hydrochlorid krém nebo vehikulum na postiženou oblast a ½ cm okraj zdravé kůže kolem postižené oblasti jednou denně po dobu 2 týdnů. Byly hodnoceny příznaky a symptomy tinea cruris (přítomnost nebo nepřítomnost erytému, pruritu a šupinatění) a ve 4. týdnu bylo provedeno KOH vyšetření a kultivace dermatofytů v primárním cílovém bodě účinnosti.
Průměrný věk populace ve studii byl 47 let, 87 % tvořili muži a 43 % běloši. Na počátku studie byly u subjektů potvrzeny známky a příznaky tinea cruris, pozitivní KOH vyšetření a potvrzená přítomnost dermatofytů na základě výsledků kultivace z centrální mykologické laboratoře. Analýza populace, u které byl proveden záměr léčby, spočívala ve srovnání podílů subjektů s úplným vyléčením při návštěvě ve 4. týdnu (viz tabulka 1). Úplné vyléčení bylo definováno jako klinické vyléčení (nepřítomnost erytému, pruritu a šupinatění) i mykologické vyléčení (negativní KOH a kultivace dermatofytů).
Procento subjektů, u nichž došlo ke klinickému vyléčení, a procento subjektů, u nichž došlo k mykologickému vyléčení ve 4. týdnu, je uvedeno jednotlivě v tabulce 1 níže.
|
Koncový bod |
Naftifin hydrochlorid krém, 2% |
Velikost |
|
N=75 |
N=71 |
|
|
Kompletní Curea |
19 (25%) |
2 (3%) |
|
Účinná léčbab |
45 (60%) |
7 (10%) |
|
Mykologická léčba |
54 (72%) |
11 (16%) |
|
a. Úplné vyléčení je složený koncový ukazatel mykologického vyléčení i klinického vyléčení. Klinické vyléčení je definováno jako nepřítomnost erytému, pruritu a šupinatění (stupeň 0) |
||
|
b. Účinná léčba je negativní KOH preparát a negativní kultivace dermatofytů, erytém, šupinatění a pruritus stupně 0 nebo 1 (chybí nebo téměř chybí). |
||
|
c. Mykologické vyléčení je definováno jako negativní KOH a kultivace dermatofytů. |
||
Interdigitální tinea pedis
Naftifin hydrochlorid krém byl zkoumán z hlediska účinnosti v randomizované, dvojitě zaslepené, vehikulem kontrolované, multicentrické studii u 217 subjektů se symptomatickou a kultivačně pozitivní interdigitální tineou pedis. Subjekty byly randomizovány k podání naftifin-hydrochlorid krému nebo vehikula. Subjekty aplikovaly naftifin hydrochlorid krém nebo vehikulum na postiženou oblast chodidla plus ½ palce okraje zdravé kůže kolem postižené oblasti jednou denně po dobu 2 týdnů. Byly hodnoceny příznaky a symptomy interdigitální tinea pedis (přítomnost nebo nepřítomnost erytému, pruritu a šupinatění) a v 6. týdnu bylo provedeno KOH vyšetření a kultivace dermatofytů v primárním cílovém bodě účinnosti.
Průměrný věk populace ve studii byl 42 let, 71 % tvořili muži a 57 % běloši. Na počátku studie byly u subjektů potvrzeny známky a příznaky interdigitální tinea pedis, pozitivní KOH vyšetření a potvrzená kultivace dermatofytů. Primárním koncovým ukazatelem účinnosti byl podíl subjektů s úplným vyléčením při návštěvě v 6. týdnu (viz tabulka 2). Úplné vyléčení bylo definováno jako klinické vyléčení (nepřítomnost erytému, pruritu a šupinatění) i mykologické vyléčení (negativní KOH a kultivace dermatofytů).
Výsledky účinnosti v 6. týdnu, čtyři týdny po ukončení léčby, jsou uvedeny v tabulce 2 níže. Naftifin-hydrochlorid krém prokázal úplné vyléčení u subjektů s interdigitální tinea pedis, ale úplné vyléčení u subjektů s tinea pedis pouze mokasínového typu nebylo prokázáno.
|
Koncový bod |
Naftifin hydrochlorid krém, 2% |
Velikost |
|
N=147 |
N=70 |
|
|
Kompletní Curea |
26 (18%) |
5 (7%) |
|
Účinná léčbab |
83 (57 %) |
14 (20 %) |
|
Mykologická léčba |
99 (67%) |
15 (21%) |
|
a. Úplné vyléčení je složený koncový ukazatel mykologického i klinického vyléčení. |
||
|
b. Účinná léčba je negativní KOH preparát a negativní kultivace dermatofytů, erytém, šupinatění a pruritus stupně 0 nebo 1 (nepřítomnost nebo téměř nepřítomnost). |
||
|
c. Mykologické vyléčení je definováno jako negativní KOH a kultivace dermatofytů. |
||
Tinea corporis
Naftifin-hydrochlorid krém byl zkoumán z hlediska bezpečnosti a účinnosti v randomizované, dvojitě zaslepené, vehikulem kontrolované multicentrické studii u 184 subjektů se symptomatickou a kultivačně pozitivní tinea corporis. Subjekty byly randomizovány k podávání naftifin-hydrochloridového krému nebo vehikula. Subjekty aplikovaly studovaný přípravek na všechny postižené oblasti povrchu těla s tinea corporis plus ½ cm okraj zdravé kůže kolem postižených lézí po dobu dvou týdnů. Byly hodnoceny příznaky a symptomy tinea corporis (přítomnost nebo nepřítomnost erytému, indurace a pruritu) a provedeno KOH vyšetření a kultivace dermatofytů pro hodnocení primárního koncového bodu účinnosti v den 21.
Populace účastníků studie byla dětská (starší nebo rovna 2 až mladší 18 let) s mediánem věku 9 let (naftifin-hydrochlorid krém) nebo 8 let (vehikulum); 61 % subjektů byli muži a 45 % běloši. Na začátku studie byly u subjektů potvrzeny známky a příznaky tinea corporis, pozitivní KOH vyšetření a potvrzená kultivace dermatofytů. Primárním koncovým ukazatelem účinnosti byl podíl subjektů s úplným vyléčením při návštěvě 21. dne. Úplné vyléčení bylo definováno jako klinické vyléčení (nepřítomnost erytému, indurace a pruritu na všech lézích přítomných na počátku léčby) a mykologické vyléčení (negativní KOH a kultivace dermatofytů).
Výsledky účinnosti v den 21, jeden týden po ukončení léčby, jsou uvedeny v tabulce 3 níže.
|
Naftifin hydrochlorid krém, 2% |
Velikost |
|
|
Koncový bod |
N=91 |
N=93 |
|
Kompletní Curea |
42 (46%) |
26 (28%) |
|
Efektivní léčbab |
53 (58%) |
32 (34%) |
|
Mykologická léčba |
57 (63%) |
36 (39%) |
|
a. Úplné vyléčení je složený koncový ukazatel mykologického i klinického vyléčení. |
||
|
b. Účinná léčba je negativní KOH preparát a negativní kultivace dermatofytů, erytém, indurbace a pruritus stupně 0 nebo 1 (nepřítomnost nebo mírný). |
||
|
c. Mykologické vyléčení je definováno jako negativní KOH a kultivace dermatofytů. |
||
Jak se přípravek dodává/schovává a přechovává
Naftifin-hydrochlorid krém, USP 2%, je bílý až téměř bílý krém dodávaný v následující velikosti:
45 gramové tuby – NDC 70700-161-18
60 gramové tuby – NDC 70700-161-17
Naftifin-hydrochloridový krém uchovávejte při teplotě 25°C; výkyvy jsou povoleny na 15° až 30°C .
Informace pro pacienty
- Informujte pacienty, že naftifin-hydrochloridový krém je určen pouze k lokálnímu použití. Naftifin-hydrochlorid krém není určen k perorálnímu, intravaginálnímu ani oftalmologickému použití.
- Pokud se při používání naftifin-hydrochlorid krému objeví podráždění nebo přecitlivělost, je třeba léčbu přerušit a zahájit vhodnou terapii. Pacienti by měli být poučeni, aby kontaktovali svého lékaře, pokud se tyto stavy po použití naftifin-hydrochloridového krému objeví.
Distributor:
Xiromed, LLC,
Florham Park, NJ 07932
Rev. 09/2020
PI-161-00
VÝROBNÍ ŠTÍTEK OBALU – 45g tuba

NDC 70700-161-18
Naftifin krém, 2%
Xiromed, LLC
Pouze pro lokální použití
Není určeno k očnímu použití, K perorálnímu nebo intravaginálnímu použití
45 g
Pouze na lékařský předpis
VÝROBNÍ ŠTÍTEK OBALU – 60g tuba

NDC 70700-161-17
Naftifin krém, 2%
Xiromed, LLC
Pouze k lokálnímu použití
Není určen k očnímu použití, Perorální nebo intravaginální použití
60 g
Pouze na lékařský předpis
| NAFTIFINE HYDROCHLORIDE naftifine hydrochloride cream |
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
Etiketa -. Xiromed, LLC (080228637)
Registrant – Xiromed Pharma España, S.L. (468835741)
Více o přípravku naftifin topický
- Nežádoucí účinky
- Při těhotenství nebo kojení
- Informace o dávkování
- Cena &Kupóny
- En Español
- 7 recenzí
- Třída léku: Informace pro spotřebitele
- Informace pro pacienty
- Naftifin pro lokální použití (rozšířené čtení)
Odborné zdroje
- Předpisová informace
- Naftifin (Odborné rady pro pacienty)
- Naftifin gel (FDA)
Ostatní značky Naftin
Související příručky pro léčbu
- Tinea Pedis
- Tinea Corporis
- Tinea Cruris
Lékařské prohlášení