V tomto příspěvku si představíme karbamáty jako užitečnou ochrannou skupinu pro aminy, zejména v souvislosti s výrobou peptidů.
Tady je stručný souhrnný obrázek toho, čím se budeme v tomto příspěvku zabývat, s podrobnějšími informacemi níže.
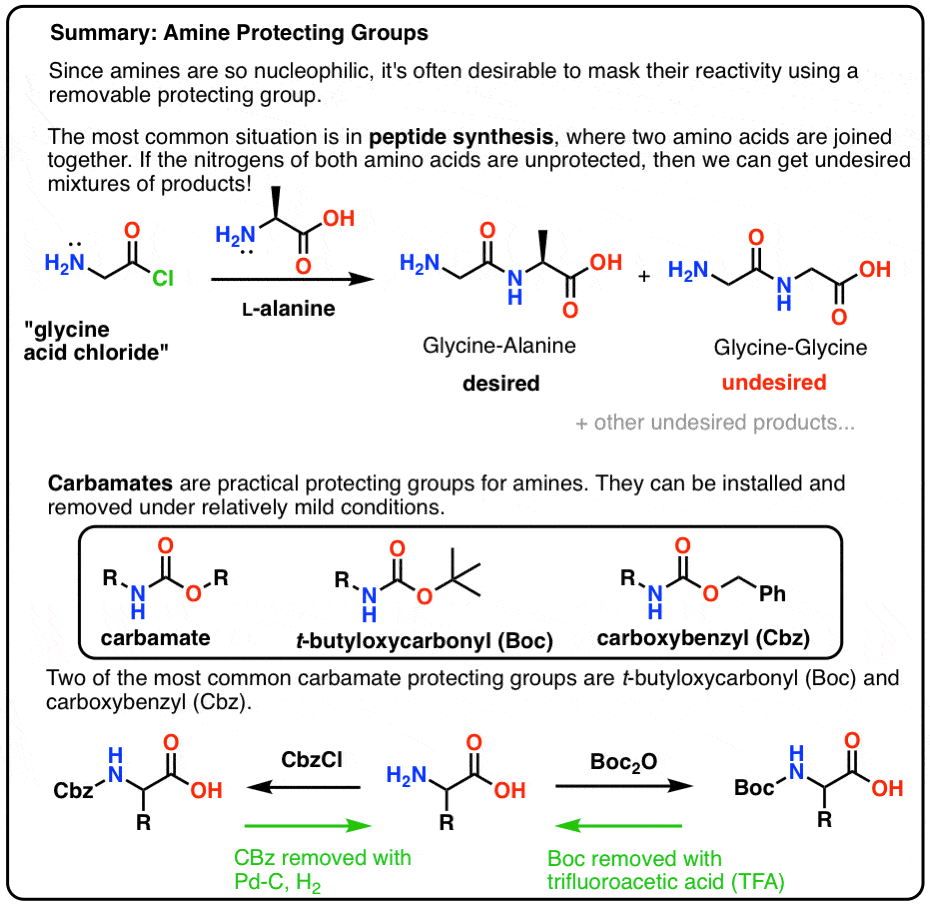
Tabulka obsahu
- Úvod do jednoduché syntézy peptidů
- Namícháme dávku Gly-Ala
- Velmi špatný počáteční plán
- „Hark! Co je to za blbost?“
- Ochranný klobouk pro NH2
- Kamaráde! Použij karbamát, kámo!
- Boc a CBz jsou včelí kolena
- Instalace a odstranění ochranné skupiny „Boc“
- Instalace a odstranění karbamátové ochranné skupiny CBz (nebo „Z“)
- Jednoduchá syntéza peptidů pomocí karbamátových ochranných skupin
- Je to pořád dokola…
- Poznámky
- (pro pokročilé) Odkazy a další literatura
Úvod do jednoduché syntézy peptidů
V nedávném příspěvku jsme prošli 3 běžné způsoby výroby amidů:
- Přidání aminů k acylhalogenidům / anhydridům
- Částečná hydrolýza nitrilů
- Spojení karboxylových kyselin s aminy pomocí dehydratačního činidla, jako je DCC (N,N‘-dicyklohexylkarbodiimid).
V tomto příspěvku chyběla jakákoli zmínka o syntéze pradědečka nejužitečnějších amidových vazeb, které lidstvo zná, a tím myslím peptidy.
Peptidová vazba je název, který dáváme amidové vazbě, která spojuje dvě aminokyseliny.
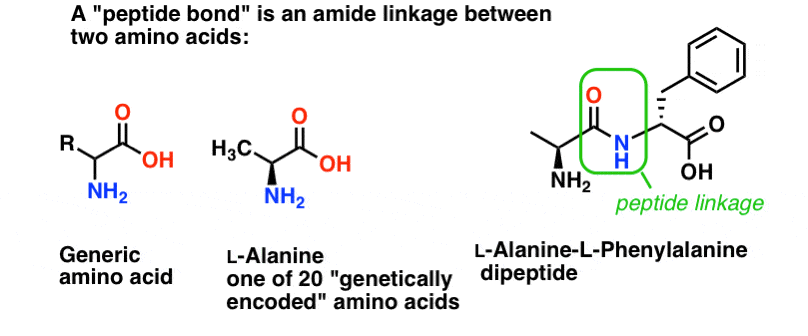
A aminokyseliny jsou důležité, protože… počkat. Už víte, proč jsou aminokyseliny důležité, že? Pokud to nevíte právě teď, vraťte se k tomu po přečtení tohoto článku.
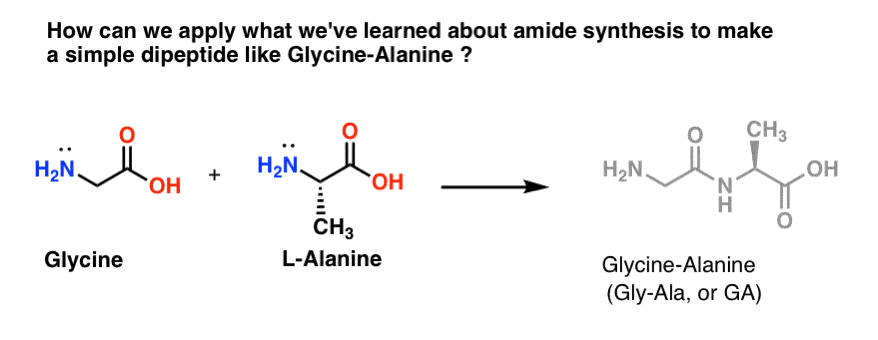
Namíchejme si dávku Gly-Ala
Pokusíme se použít některé z našich nově nabytých dovedností v oblasti syntézy amidů a pokusíme se vytvořit opravdu jednoduchý dipeptid, glycin-alanin. Pokud se nám nyní podaří sestavit jednoduchý dipeptid, můžeme v některém z pozdějších příspěvků použít to, co jsme se naučili, abychom si ukázali, jak se vytvářejí ještě složitější peptidy. Věděli jste, že nositel Nobelovy ceny Bruce Merrifield syntetizoval inzulin spojením jedné aminokyseliny za druhou? Ano, opravdu.
Ze tří metod, které jsme uvedli pro výrobu amidů, jsou pouze dvě potenciálně použitelné pro tvorbu peptidových vazeb: 1) metoda kyselého chloridu nebo 2) syntéza pomocí spojovacího činidla, jako je DCC. .
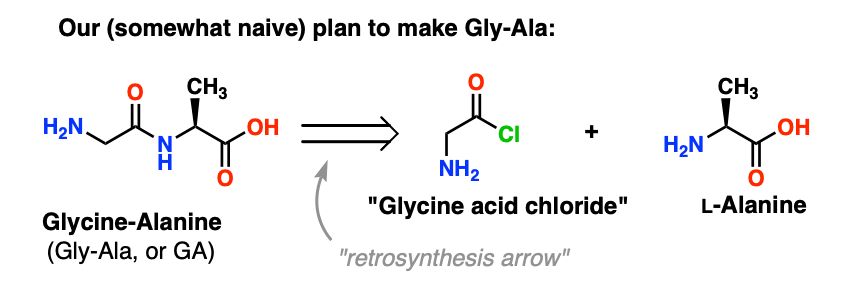
3. Velmi špatný počáteční plán
Náš první pokus o syntézu peptidů bude spočívat v tom, že se vrhneme vpřed s velmi naivním plánem útoku a budeme doufat, že to nakonec vyjde. Vydržte, přátelé, protože to bude zamotané.
Začneme návrhem chloridové metody syntézy Gly-Ala.
Podíváme-li se zpět od dipeptidu Gly-Ala, podle našeho plánu bychom měli syntetizovat peptidovou vazbu reakcí alaninu s chloridem kyseliny odvozeným od glycinu:
V tomto plánu je malý problém. Na první pohled může být trochu těžké si ho všimnout.
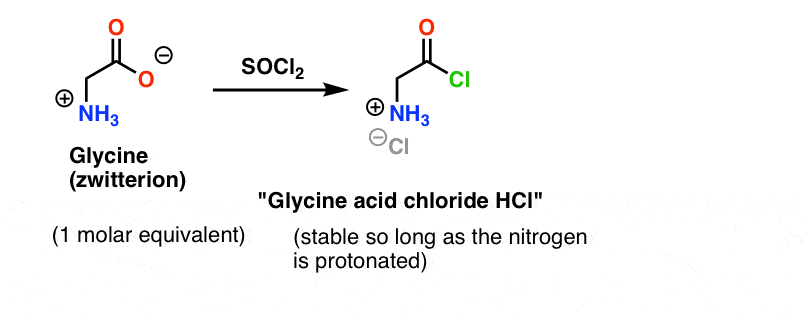
Předpokládejme, že jsme vyrobili chlorid kyseliny glycinové* , a že máme „chlorid kyseliny glycinové“ a alanin společně v jedné baňce, spolu s trochou přebytečné báze pro urychlení.
Nakreslíme reakci směrem dopředu:
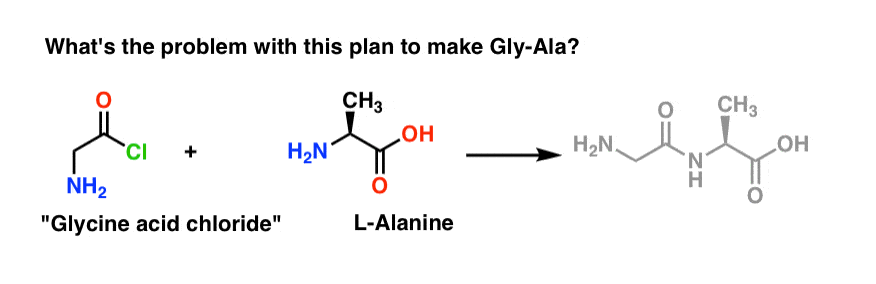
Co by se mohlo pokazit?“
„Hark! What Crap Is This? „
Náš plán je připravit roztok chloridu kyseliny glycinové (1 molární ekvivalent) a pak ho nechat trpělivě čekat v baňce, dokud nepřidáme molární ekvivalent alaninu, načež by reagoval s nukleofilní NH2 skupinou alaninu.
Problém našeho plánu spočívá v tom, že nemáme co do činění s jedinou molekulou „chloridu kyseliny glycinové“ – máme co do činění s něčím kolem jednoho molu (6,02 x 1023 molekul). A chlorid kyseliny glycinové už má nukleofilní skupinu NH2!
„Chlorid kyseliny glycinové“, jak je nakreslen, není stabilní molekula, protože může reagovat sám se sebou.
To znamená, že roztok chloridu kyseliny glycinové ponechaný sám sobě by vytvořil polymer glycinu se strukturou Gly-Gly-Gly-Gly…
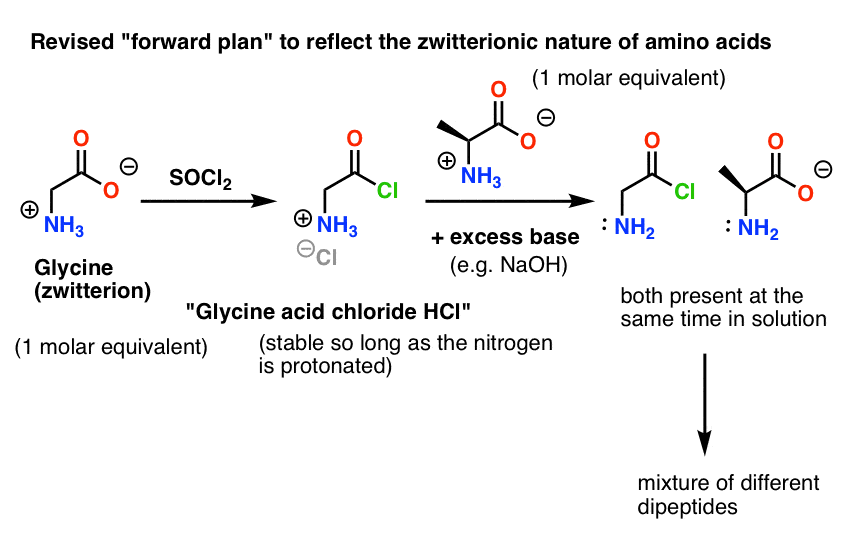
Takže roztok chloridu kyseliny glycinové v přítomnosti alaninu by nevytvořil pouze žádoucí Gly-Ala, ale také Gly-Gly (s připojeným acylhalogenidem), který může pokračovat v dalších neplechách s jiným nukleofilem, ať už je to Gly nebo Ala:
(a ne, NH2 „chloridu kyseliny glycinové“ se od NH2 alaninu příliš neliší. Jsou přibližně stejně reaktivní.“
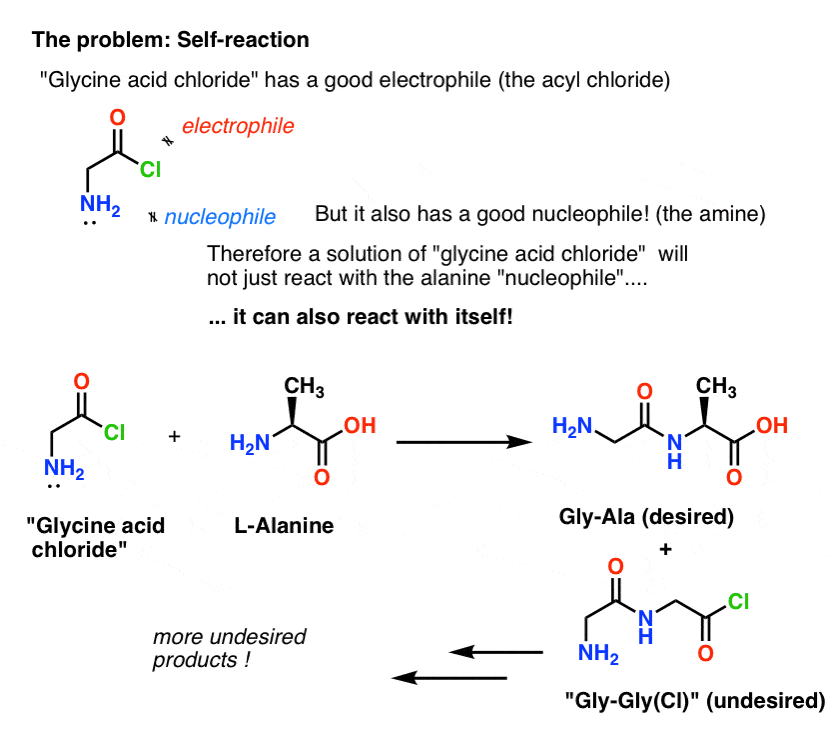
Z toho plyne poučení, že když máte roztok molekuly obsahující jak nukleofil, tak elektrofil, může sama reagovat. Pro tento proces existuje název, který vám může znít povědomě: polymerace.
Jak tomu tedy zabránit?
Ochranný klobouk pro NH2
Nejlepším způsobem je nějakým způsobem „zakrýt“ dusík ochrannou skupinou (PG), která učiní skupinu NH2 nenukleofilní. Měla by mít také tyto vlastnosti:
- snadno a selektivně instalovatelná
- inertní vůči požadovaným reakčním podmínkám (např. SOCl2 pro vytvoření chloridu kyseliny z kyseliny karboxylové)
- snadno a selektivně odstranit, aniž by to ovlivnilo konečný produkt
Se strategiemi ochranných skupin jsme se již setkali, zejména s alkoholy a použitím Grignardových činidel.
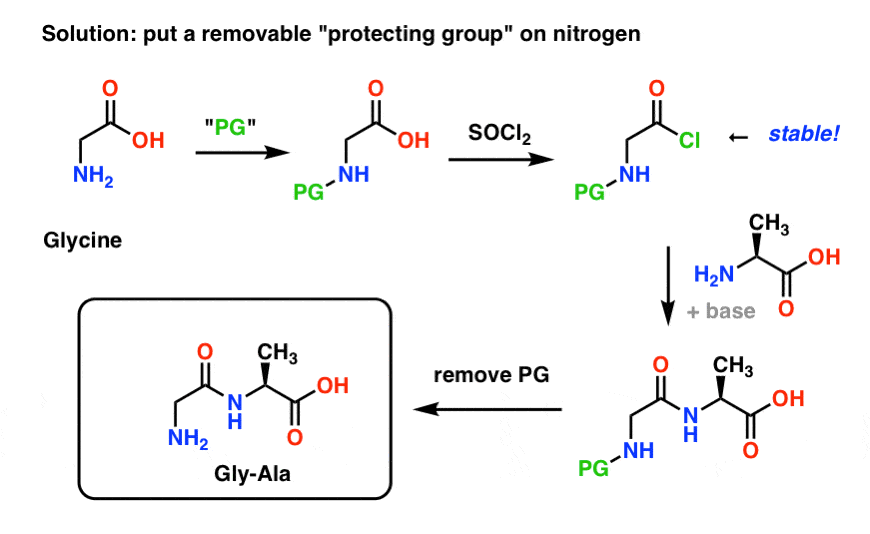
Takto by mohla vypadat strategie ochranné skupiny pro naši syntézu „Gly-Gly“. Nainstalujeme ochrannou skupinu („PG“) na glycin a poté vytvoříme chlorid kyseliny. PG by měla být zvolena tak, aby byl dusík nenukleofilní (tj. nebude reagovat s chloridem kyseliny).
Poté můžeme vytvořit naši peptidovou vazbu s nechráněným alaninem a poté za mírných podmínek odstranit PG.
Jednou strategií ochranné skupiny pro dusík, kterou jsme již prozkoumali, je Gabrielova syntéza, která používá ftalimid (ftalimid si můžete představit jako chráněný dusík). Tato metoda byla skutečně použita k syntéze Gly-Gly („glycylglycin“) ! Jedním z problémů však je, že k instalaci i odstranění ftalimidové skupiny jsou zapotřebí poměrně tvrdé podmínky (dostatek tepla), což není příliš zdravé prostředí pro přežití citlivých chirálních aminokyselin, které mohou snadno racemizovat.
Další možnou volbou je chránit dusík jako amid, ale štěpení amidů může také vyžadovat tvrdé podmínky. Navíc, protože se zde stejně snažíme vytvořit amidovou vazbu (peptid), mohli bychom mít problémy se selektivitou při jejím odstraňování – zničení vesnice za účelem její záchrany.
Mate! Použij karbamát, kámo!
Nejoblíbenější volbou ochranné skupiny pro aminový dusík je karbamátová funkční skupina. Karbamát vypadá jako nemanželské dítě esteru a amidu s N a O po stranách karbonylu.
Dusík karbamátu je relativně nenukleofilní a navíc jsou karbamáty:
- snadno se instalují na dusík
- inertní vůči široké škále reakčních podmínek
- snadno se odstraňují bez ovlivnění existujících amidových skupin
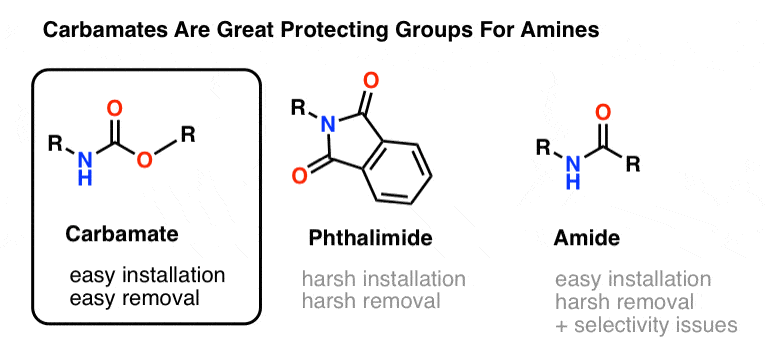
To je činí ideálními pro naše účely.
Boc a CBz jsou včelí kolena
Dvě oblíbené karbamátové ochranné skupiny jsou Boc (t-butyloxykarbonyl) a CBz (karboxybenzyl).
Pro naše účely lze tyto dvě ochranné skupiny považovat za víceméně rovnocenné, protože obě lze účinně použít pro syntézu peptidů.
Klíčový rozdíl je ve skutečnosti ve způsobu jejich odstranění (tj. v kroku „deprotekce“). Volba mezi jedním nebo druhým se stává rozhodující, jakmile máte složitou molekulu s více ochrannými skupinami; to spadá do kategorie „pokročilé syntetické strategie“, která je spíše předmětem Org 3.
Instalace a odstranění ochranné skupiny „Boc“
Skupina Boc se obvykle instaluje pomocí „Boc2O“ (někdy označované jako „anhydrid Boc“) a odstraňuje se pomocí kyseliny. Obvyklou volbou je „čistá“ (tj. neředěná) kyselina trifluoroctová (TFA), která velmi čistě odbourává skupiny Boc a uvolňuje CO2 a t-butylalkohol.
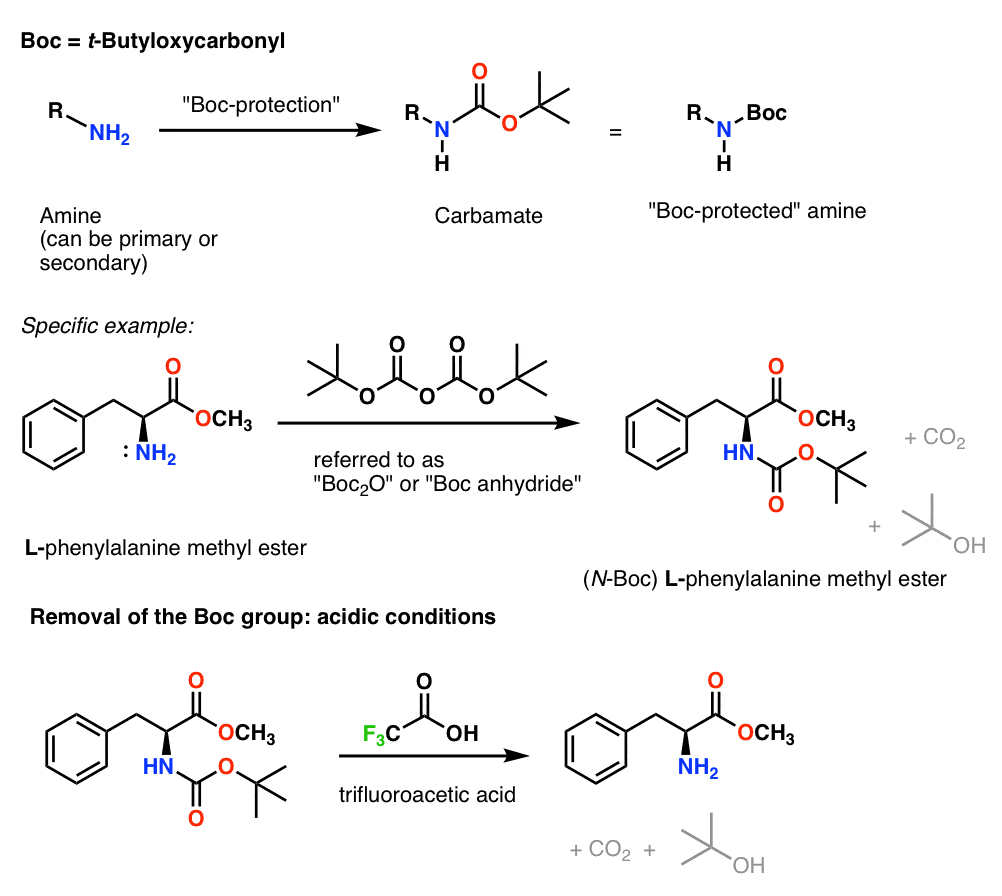
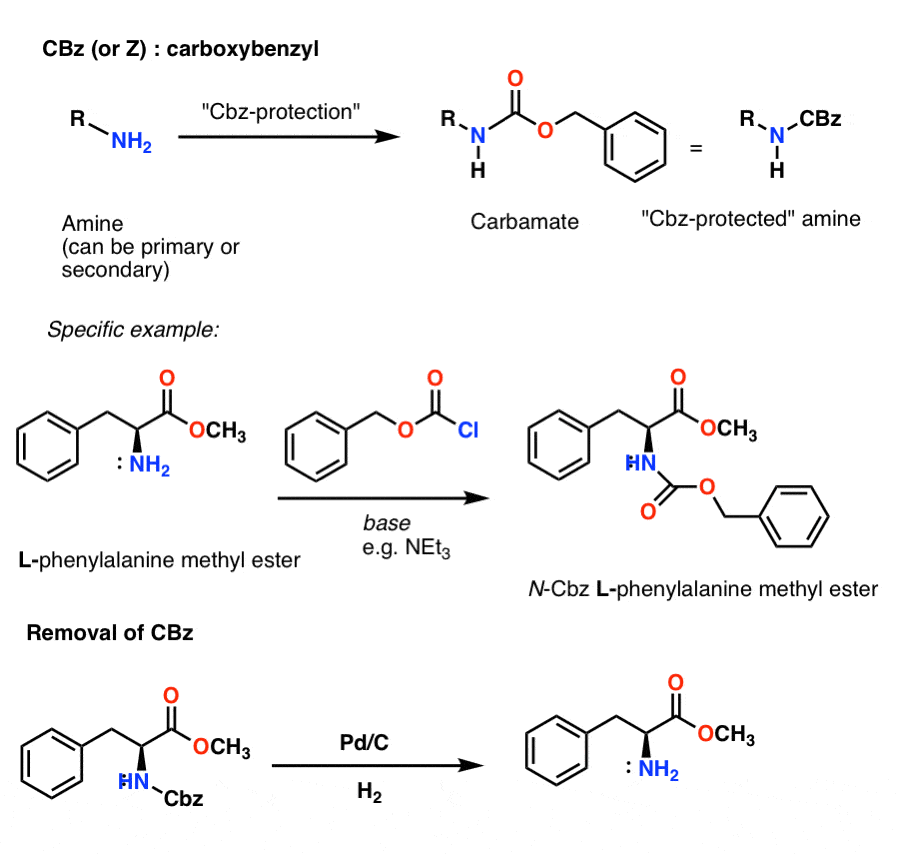
Instalace a odstranění karbamátové ochranné skupiny CBz (nebo „Z“)
Skupinu Cbz (někdy dále zkracovanou jako „Z“) lze instalovat pomocí CbzCl a mírné báze a obvykle se odstraňuje katalytickou hydrogenací (Pd-C/H2). Ta je velmi šetrná a její výhodou je, že probíhá při neutrálním pH a ponechává funkční skupiny citlivé na kyseliny nebo zásady.
Jednoduchá syntéza peptidů pomocí karbamátových ochranných skupin
Vraťme se k syntéze peptidů a použijme tuto strategii ochranných skupin k výrobě Gly-Ala.
Začneme s aminokyselinou, jako je L-alanin. Ošetřením alaninu Boc2O získáme L-alanin chráněný N-Boc. Dalším krokem je vytvoření kyselého chloridu pomocí SOCl2. Jakmile je vytvořen, přidáme náš amin (např. L-valin) v přítomnosti přebytku báze, čímž vznikne naše klíčová amidová vazba. Posledním krokem k získání dipeptidu je deprotekce aminu chráněného Boc pomocí kyseliny trifluoroctové (TFA) a voila! máme náš dipeptid.
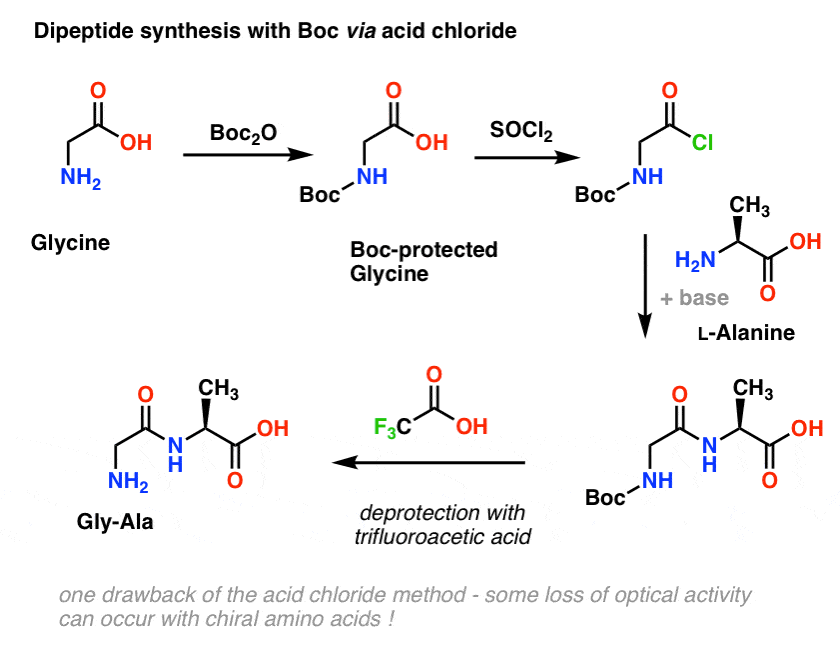
Ačkoli tato metoda může být na papíře dobrá, jedním z problémů použití kyselých chloridů v praxi je, že chirální aminokyseliny touto metodou často ztrácejí svou optickou čistotu, což je proces někdy označovaný jako „racemizace“, ale správněji se nazývá „epimerizace“ (technicky správněji, protože vodík na chirálním centru je invertován)
Protože chiralita aminokyselin je nezbytná pro jejich biologickou funkci, obvykle se používá o něco mírnější protokol, který využívá DCC nebo podobné spojovací činidlo.
V tomto případě zpracováváme glycin chráněný Boc pomocí DCC, abychom aktivovali karboxylovou kyselinu. Poté přidáme náš nukleofil aminokyseliny (L-alanin), který vytvoří dipeptid. Pokud chceme v tomto okamžiku izolovat dipeptid Gly-Ala, můžeme poté odstranit skupinu Boc pomocí TFA.
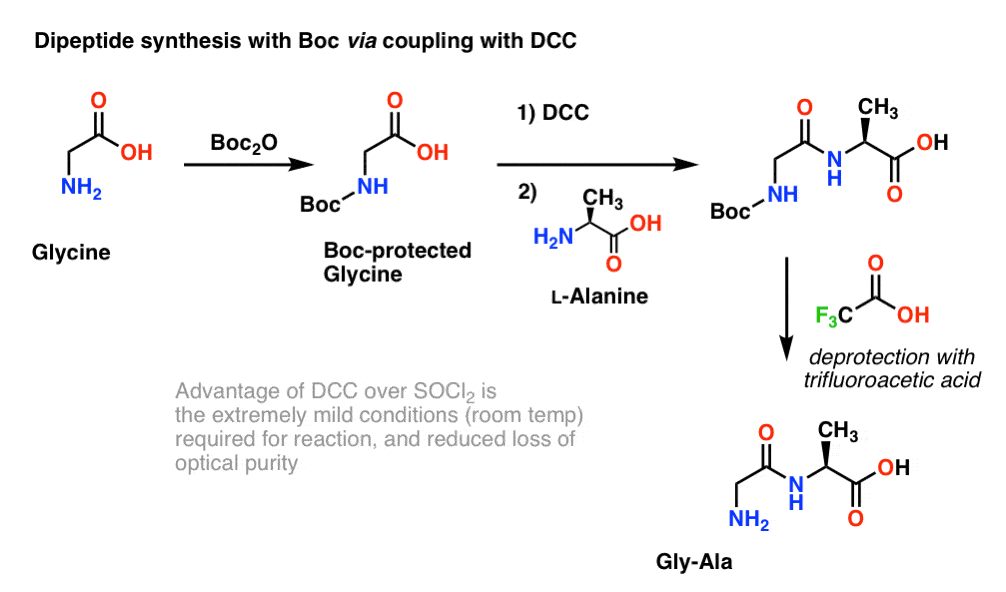
(poznámka k tomuto schématu)
Je to pořád dokola…
Všimněte si, že pokud bychom chtěli vytvořit tri-peptid, můžeme prostě pokračovat v cyklech přidávání DCC (k aktivaci karboxylové kyseliny) následovaných přidáváním nových aminokyselin a budovat peptid po jedné jednotce!
Existuje obzvláště účinná metoda pro tvorbu delších peptidů, jejímž průkopníkem je Bruce Merrifield (a která byla mimo jiné použita při syntéze inzulínu) a která se nazývá syntéza peptidů na pevné fázi, jíž se budeme zabývat příště, až se tomuto tématu budeme věnovat.
Poznámky
Pozn. 1. Podobně jako ve starém vtipu o ekonomovi, který navrhuje plán, jak se dostat z pustého ostrova:
„Předpokládejme, že máme loď.“
Glycin (stejně jako všechny aminokyseliny) je sám o sobě zwitterion. Úpravou glycinu pomocí SOCl2 by měl vzniknout chlorid kyseliny s protonovaným aminem. Ten by měl být v roztoku relativně stabilní, dokud se nepřidá báze.
Tady je problém. Protože nukleofil naší aminokyseliny (alanin) je také zwitteriontový, nemůže dojít k žádné reakci, dokud se nepřidá přebytek báze, aby se uvolnil osamělý pár na alaninovém dusíku. Po přidání báze máme „chlorid kyseliny glycinové“ a alanin společně v roztoku. Mezi nukleofilitou dusíků těchto dvou druhů není znatelný rozdíl a každý z nich bude soutěžit o reakci s nukleofilem chloridu kyseliny, což povede ke směsi Gly-Ala a Gly-GlyCl, a Gly-GlyCl pak může dále reagovat s různými nukleofily přednastavenými v roztoku za vzniku tri-, tetra- a vyšších peptidů.
Poznámka 2. John Sheehan, s nímž jsme se již dříve setkali jako s vynálezcem DCC na cestě k první syntéze penicilinu, také vyrobil ftalínem chráněný Gly-Gly pomocí Gabrielovy syntézy:
Odkaz zde (JACS, 1949, 71, 1856)
Poznámka 3. Dalším problémem při použití amidových ochranných skupin je tvorba azlaktonu, která může vést k epimerizaci chirálních aminokyselin. Viz také tento soubor problémů
Poznámka 4. „Ortogonální ochranné skupiny“. Při syntetickém plánování je často zásadně důležité mít ochranné skupiny, které jsou odstranitelné za výrazně odlišných podmínek. Tato vlastnost se často označuje jako „ortogonalita“
Například v následujícím dipeptidu máme dvě různé ochranné skupiny na dusíku – jednu Boc a jednu CBz. Výběrem „ortogonálních“ ochranných skupin je každý dusík adresovatelný – můžeme si vybrat, kterou ochrannou skupinu odstraníme, a naše syntéza může pokračovat dále. Tím se vyhneme situaci, kdy máme dva nechráněné aminy a musíme spoléhat na to, že jeden je reaktivnější než druhý. Tyto přístupy fungují velmi zřídka!
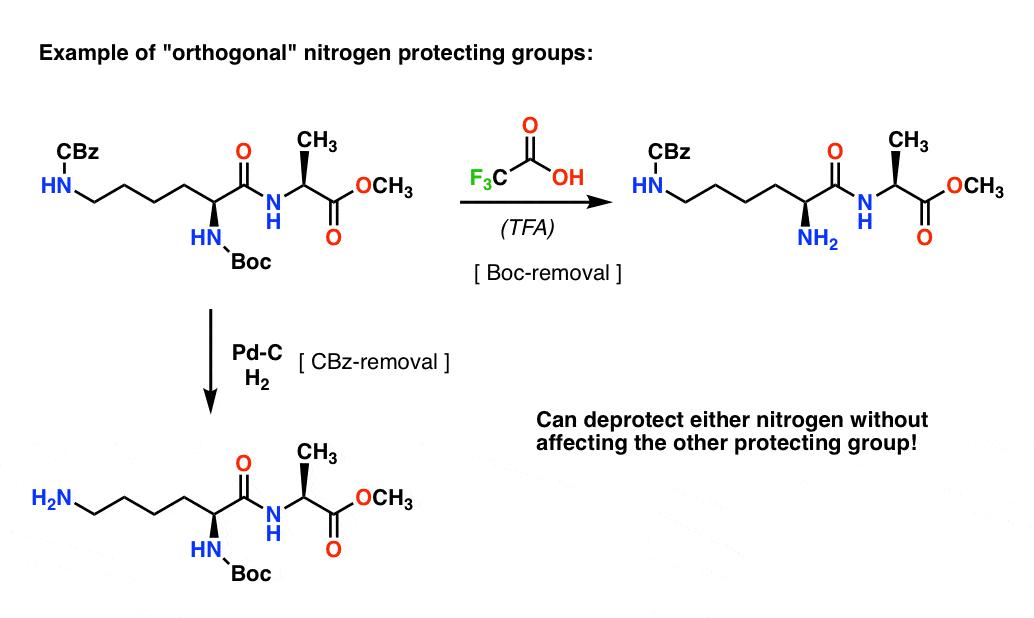
Jedna poznámka – pro zjednodušení je zde alanin zobrazen s volnou karboxylovou kyselinou, ale o něco lepší přístup by byl použít methylester alaninu, aby se zabránilo samospojení mezi volným aminem alaninu a volnou karboxylovou kyselinou.
Mate…
(pro pokročilé) Odkazy a další literatura
Karbamáty jsou užitečné jako ochranné skupiny pro aminy a nejčastěji se používají -Boc, -Cbz a -Fmoc.
- Über ein allgemeines Verfahren der Peptid-Synthese
Max Bergmann a Leonidas Zervas
Ber. 1932, 65 (7), 1192-1201
DOI: 10.1002/cber.19320650722
Ochranná skupina -Cbz (karboxybenzyl) byla poprvé použita Maxem Bergmannem a Leonidasem Zervasem v roce 1932 pro syntézu peptidů a někdy se na Zervasovu počest zkracuje na „-Z“. - ODSTRAŇOVÁNÍ OCHRANNÝCH SKUPIN t-BUTYLU A t-BUTOXYKARBONYLU KYSELINOU TRIFLUOROACETOVOU
Mechanismy, tvorba biproduktů a hodnocení scavengerů
Behrend F. Lundt, Nils L. Johansen, Aage Vølund a Jan Markussen
J. Pept. Prot. Res. 1978, 12 (5), 258-268
DOI: 10.1111/j.1399-3011.1978.tb02896.x
V praxi se při deprotektování obvykle přidávají do kyselého koktejlu (TFA) nukleofilní scavengery (např. thioly), protože při deprotektování Boc vzniknou elektrofilní t-butylové formy (např. t-butyltrifluoroacetát), které mohou reagovat s citlivými zbytky (např. Trp nebo Cys). - Způsob syntézy dlouhých peptidových řetězců na příkladu syntézy oxytocinu
Miklos Bodanszky a Vincent du Vigneaud
Journal of the American Chemical Society 1959, 81 (21), 5688-5691
DOI: 1021/ja01530a040
V první polovině 20. století se syntéza peptidů prováděla pomocí standardních technik roztokové fáze v organické chemii. Tato syntéza je nyní známá jako LPPS (liquid-phase peptide synthesis). du Vigneaud obdržel v roce 1955 Nobelovu cenu za chemii za práci, kterou prokázal, že lze dosáhnout syntézy peptidů za použití správné volby ochranných skupin a syntetických strategií. - ČASOVÁ FORMACE AZLAKTONOVÉHO KRUHU PŘI RACEMIZACI ACYL DERIVÁTŮ AMINOKYSELIN S ACETOVÝM ANHYDRIDEM
Vincent du Vigneaud a Curtis E. Meyer
Biol. Chem. 1932, 99:143-151
http://www.jbc.org/content/99/1/143.citation
Dalším problémem při použití amidových ochranných skupin je vznik azlaktonu, který může vést k epimerizaci chirálních aminokyselin. - A New Synthetic Route to Peptides
John C. Sheehan and Victor S. Frank
Journal of the American Chemical Society 1949, 71 (5), 1856-1861
DOI: 10.1021/ja01173a095
John Sheehan, vynálezce DCC na cestě k první syntéze penicilinu, vyrobil Gabrielovou syntézou také fthalylem chráněné Gly-Gly. - Nová metoda tvorby peptidových vazeb
John C. Sheehan a George P. Hess
Journal of the American Chemical Society 1955, 77 (4), 1067-1068
DOI: 1021/ja01609a099
Původní článek o syntéze peptidových/amidových vazeb pomocí DCC. - 9-Fluorenylmethoxykarbonylová funkce, nová amino-ochranná skupina citlivá na bázi
Louis A. Carpino a Grace Y. Han
Journal of the American Chemical Society 1970, 92 (19), 5748-5749
DOI: 10.1021/ja00722a043 - 9-fluorenylmethoxykarbonyl amino-ochranná skupina
Louis A. Carpino a Grace Y. Han
The Journal of Organic Chemistry 1972 37 (22), 3404-3409
DOI: 10.1021/jo00795a005
Objev a vývoj -Fmoc ochranné skupiny pro aminy přidává další vrstvu ortogonality do strategií ochrany/deprotekce aminů. Skupina -Fmoc je bazicky labilní a při syntéze peptidů se obvykle odstraňuje pomocí 20% piperidinu v DMF. Cbz se odstraňuje hydrogenací, -Boc se odstraňuje kyselinou a -Fmoc zásadou.
.