V této kapitole je uvedena taková látka, která studentům umožní nahlédnout do metod analýzy používaných při technickém zkoumání železa a oceli. Povaha této práce neumožňuje podrobné zpracování tématu – zpracování, které si může vyžádat odhad jedné nebo více z následujících látek: Uhlík (volný a kombinovaný), síra, křemík, fosfor, mangan, titan, měď, nikl, kobalt, chrom, hliník, arsen, antimon, cín, wolfram, vanad, dusík, železo. Obecně se nejvíce vyžadují odhady uhlíku, síry, křemíku a fosforu. Z ostatních uvedených prvků a sloučenin se u speciálních ocelí vyžaduje stanovení jednoho nebo více prvků. Informace o těchto stanoveních nalezne student v knize Chemical Analysis and Foundry Chemistry, Crobaugh ; The. Chemical Analysis of Iron, Blair ; „Carbon in Steel by Direct Combustion,“ Blount, in The Analyst, Jan. 1902; „Sulphur in Wrought Iron and Steel,“ Auchy, in the Jour. Amer. Chem. Soc., March 1901, a další články ve stejných časopisech. Student, který chce jít dále, by si měl, pokud je to možné, opatřit přístup k pracím a článkům Campbella, Drowna a dalších, které jsou čas od času publikovány v různých chemických a metalurgických časopisech.
Jelikož je studentův čas omezený, může prozatím odložit odhad křemíku a fosforu, ačkoli jsou uvedeny vzhledem k jejich důležitosti jak pro metalurga, tak pro slévače.
Aby student získal důkladnější přehled o předmětu, nebude od věci několik poznámek 0 složení a vlastnostech uvažovaných látek. Pokud jde o vliv různých prvků na ocel, podívejte se do knihy The Manufacture and Properties of Structural Steel od H. H. Campbella.
Uhlík existuje v železe ve třech stavech – grafitickém, rozpuštěném a kombinovaném. Kromě těchto forem byly mikroskopem identifikovány i další.
Síra existuje v železe především jako sulfid FeS, který je rozpustný v roztaveném železe.
Fosfor existuje jako fosfid železa, který je v roztaveném železe zcela rozpustný.
Křemík tvoří silicid železa, který je rovněž rozpustný v roztaveném železe.
Z těchto čtyř prvků je tedy uhlík jediný, který může existovat ve volném stavu. Rozdíly v poměru jednotlivých přítomných prvků jsou téměř nekonečné, ale následující stručná tabulka uvádí přibližné složení surového železa, kujného železa a oceli, ačkoli každý z nich podléhá značným odchylkám.
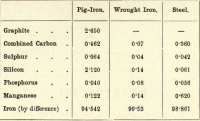
Žák má odhadnout následující:-
(1) Uhlík,
(a) celkový.
(b) grafitický.
(c) kombinovaný.
(2) Síra.
(3) Křemík. (Pokud to čas dovolí.)
(4) Fosfor. (Pokud to čas dovolí.)
Uhlík celkem
Při tomto odhadu se uhlík přeměňuje na CO2, který se absorbuje v kaustické potaši. Z hmotnosti takto získaného CO2 se vypočítá uhlík.
Na první pohled by se zdálo, že nejjednodušší postup by byl zapálit železné nebo ocelové vývrty přímo v proudu kyslíku a takto vzniklý CO2 absorbovat v KHO. Bohužel se tato metoda zatím ukázala buď jako nepřesná, nebo tam, kde se dosáhlo úplného spálení, nebyl přístroj nutný k tomu, aby vydržel vysokou teplotu nebo jiné odchylky v zacházení, vhodný pro technickou práci (viz články Blounta v časopise The Analyst). Student zjistí, že zde uvedená metoda není z technického hlediska v žádném případě ideální, pokud jde o pohodlí a rychlost, a zdá se pravděpodobné, že bude v blízké budoucnosti nahrazena nějakou rychlejší metodou přímé oxidace.
Přijatá metoda – Po nahlédnutí do mnoha prací na toto téma lze nalézt velké množství metod. Zde uvedená metoda poskytne při běžné péči přesné výsledky. Stručně je následující:
Železo se rozpustí v roztoku dvojnásobného chloridu draselného a měďnatého, okyseleného HCl. Kovová měď se vysráží a znovu rozpustí; železo se rozpustí, uhlík se ponechá v suspenzi. Poté se shromáždí a zapálí ve spalovací peci s kyslíkem a zváží se uvolněný CO2.
Roztok železa.- Odváží se 1 g surového železa. Přeneste do kádinky o objemu 300 cm3. Přidejte 100 c.cs. CuCl2,2KCl,2H2O roztok, který se připraví takto. Rozpusťte ve vodě 149,1 dílu KCl a 170,3 dílu krystalické CuCl2,2H2O. Odpařte a vykrystalizujte dvojchlorid. Rozpusťte 300 g podvojné soli v destilované vodě. Přefiltrujte přes zapálený azbest a uchovávejte ve skleněných zátkovaných lahvích.
K obsahu kádinky přidejte 7 c.cs. HCl, aby byl roztok kyselý. Přerušovaně míchejte, dokud nedojde k rozpuštění železa. Kádinku s obsahem umístěte ke konci roztoku na vodní lázeň o teplotě asi 60 °C. Probíhají následující reakce – Fe + CuCl2 = FeCl2 + Cu a Cu + CuCl2 = 2CuCl. KCl jednoduše napomáhá roztoku vysrážené mědi. Přibližně za 40 minut od přidání dvojchloridů by měl být roztok téměř úplný a většina mědi rozpuštěná. Strany kádinky omyjte trochou okyseleného dvojchloridu. Do roztoku přidejte trochu zapáleného azbestu, aby se uhlíkaté látky usadily a neucpaly filtr (podle doporučení Barby).
Pro filtraci jsou velmi vhodné speciální platinové lodičky, vybavené na principu Goochova kelímku. Student však může odfiltrovat uhlíkaté látky pomocí Goochova kelímku za pomoci umělého odsávání, přičemž uhlíkaté látky se propláchnou proudem vody poté, co kapalina projde filtrem. Uhlíky na filtru pečlivě omyjte horkou vodou. Kelímek a
obsah vysušte ve vzduchové sušárně při teplotě 100 C. Uhlíkaté látky jsou nyní připraveny k zapálení.
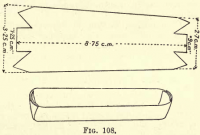
Oxidace uhlíku – Připravte si platinovou lodičku tak, že ustřihnete kus platinové fólie podle obr. 108, jejíž strany a konce ohnete tak, aby vznikl žlábek. Přeneste uhlíkaté látky a azbest z Goochu do člunu.
Spalovací pec, příslušenství a armatury musí být v pořádku. Opět se použije přístroj na čištění kyslíku, ale tentokrát je opatřen trojcestnou trubicí s kohouty vloženými mezi sklad a čističe. To umožňuje, aby přístrojem procházel proud vzduchu. Spalovací trubice může být z tvrdého jenského skla, porcelánu nebo platiny. Mezi pecí a potašovými baňkami se používají dvě U trubice. Konec první trubice nejblíže peci obsahuje bezvodou CuSO4 a druhý konec bezvodou CuCl. Druhá U trubice obsahuje sušený CaCl2. Tyto dvě trubice tvoří „čisticí soupravu“. CuCl absorbuje veškerý Cl a ostatní látky veškerou H2O. Tato souprava poslouží pro mnoho stanovení. Následují draselné baňky a ochranné trubice a po ruce by měla být odsávačka, která v případě potřeby protáhne aparaturou proud vzduchu. Draselné baňky se nabíjejí 8E. KHO a ochranná trubice CaCl2. Pec a žárovky se vyzkouší podle předchozího popisu (viz Uhlí a koks), trubice se naplní podle náčrtku, loďka se prozatím udržuje ve vzduchové peci při teplotě 100 °C.
Když je vše připraveno, hořáky se na nějakou dobu vypnou, vloží se loďka a obsah. Hořáky se zapálí od předního konce, postupně se pracuje směrem dozadu a pomalý proud kyslíku o dvou bublinkách za sekundu se po předchozím zapnutí zapíná, dokud není trubice plná kyslíku. Regulujte teplotu, dokud loďka nezíská matně červenou barvu, a pokud roztok v baňkách vykazuje známky stékání zpět do pece, zvyšte proud kyslíku na tři nebo čtyři bublinky za sekundu.
Od vložení loďky stačí k úplnému spálení asi padesát minut. Vypněte kyslík a pouštějte proud vzduchu po dobu deseti minut.
Nyní se potašové baňky a ochranná trubice vyjmou a zváží a uhlík se vypočítá jako obvykle.
(b) Grafitický uhlík -Železo se podle některých rozpouští v HCl, podle jiných v HNO3, kdy grafitický uhlík zůstává jako zbytek. Pro surové železo dává obě metody při opatrnosti dobré výsledky, ale pro oceli obsahující grafit Blair doporučuje roztok v kyselině dusičné. (Tuto metodu konzultujte s Blairem.)
Odvažte 5 g vývrtů surového železa. Rozpusťte v 50 c.cs. SE. HCl za pomoci mírného tepla. Vařte několik minut. Zřeďte na 100 c.cs. (téměř). Přefiltrujte přes Goochův kelímek. Dobře promyjte horkou vodou a poté vroucím E. KHO. (Tím se rozpustí případný SiO2.) Znovu promyjte horkou vodou, abyste odstranili KHO. Kelímek a obsah se vysuší.
Uhlík se stanoví jako předtím spalováním a procento se vypočítá jako obvykle.
(c) Kombinovaný uhlík (rozdílem).- Jelikož je znám celkový uhlík a grafitický uhlík, získá se kombinovaný uhlík odečtením grafitického od celkového uhlíku.
Přímé metody odhadu naleznete v uvedených autoritách.
Odhad síry v železe &ocelích
Existují značné rozdíly v názorech na nejlepší metodu odhadu síry v železe a oceli. Uznává se, že stará metoda roztoku aqua regia a srážení BaCl2 je velmi nepřesná; ale pomalý roztok v HNO3 s velmi malou nebo žádnou přítomností HCl, následovaný opatrným srážením BaCl2 za přítomnosti určitého přebytku HCl a s náležitou péčí, pokud jde o dobu a podmínky srážení, a opatření proti kontaminaci sraženiny železem – s těmito opatřeními a péčí lze dosáhnout dobrých výsledků. Blair naproti tomu doporučuje roztok v HCl, přičemž S se uvolňuje jako H2S, který se absorbuje v roztoku (alkalickém) Pb(NO3)2 za vzniku PbS, který se rozpustí v HCl + KClO3 a S se vysráží jako BaSO4. Další metody viz Blair, Stillman, Auchy, Crobaugh a Drown. Další běžně používanou metodou je vývin S jako H2S s následnou absorpcí v roztoku chloridu kademnatého. Vysrážený sulfid kademnatý se rozpustí v HCl a S se odhadne titrací roztokem jódu, nebo ještě častěji se H2S absorbuje v Br. vodě a pak se vysráží jako BaSO4 nebo se absorbuje v NaOH a titruje jódem; tato druhá metoda je oblíbená. (Viz Blair.) Zde je uvedena tato metoda:-
Oxidace pomocí HNO3 (tzv. metoda Aqua Regia): Odváží se 5 g borky a přenese se do hluboké 200 cm3 kádinky. Opatrně přidejte asi 40 c.cs. 16E. HNO3 v dávkách po 10 ccm, přičemž kádinku zakryjte velkým hodinovým sklem a dbejte na to, aby působení nebylo příliš prudké. Když děj zjevně ustane, zaznamenejte, zda jsou všechny částice rozpuštěny (kromě uhlíku). Pokud ne, zahřejte na pískové lázni a přidejte 3 nebo 4 kapky 16E. HCl a zahřívejte, dokud se nerozpustí.
Když je roztok úplný, přidejte trochu Na2CO3, aby se případná H2SO4 přeměnila na Na2SO4, který je při odpařování netěkavý.
Odstraňte z pískové lázně a přidejte 5 c.s. silné HCl v množství větším, než je nutné k rozpuštění všech sloučenin železa vysrážených Na2CO3. Odfiltrujte SiO2 a C. Dobře promyjte. Odpařte do sucha, aby se SiO2 stal nerozpustným. Doplňte HCl a odpařujte, dokud Fe2Cl6 nezačne krystalizovat. Pak přidejte 5 c.cs. HCl a přefiltrujte, pokud je přítomen nějaký zbytek. (Pokud není přítomen žádný, nebyl v roztoku žádný SiO2 a odpařování mohlo být vynecháno.) Sraženinu pečlivě přefiltrujte a promyjte v Goochově roztoku, přičemž kapalina a promývací roztok se doplní asi na 100 c.cs.
Zahřejte k varu. Přidejte 10 cm3 nasyceného roztoku BaCl2. Vařte 30 minut. Nechte stát přes noc. Přefiltrujte přes Goochův filtr. Promyjte trochou E. HCl. a poté vodou. Vysušte, zapalte a zvažte jako obvykle BaSO4, který by měl být bílý a neměl by být znečištěn solemi železa.
Procento S vypočítejte obvyklým způsobem. Protože některá použitá činidla mohou obsahovat síru, musí se provést slepý pokus se stejným množstvím jako při vlastní analýze a zjištěná síra se odečte od předchozího výsledku.
ESTIMULACE SILIKONU
Zde uvedená metoda je Drowova a je rychlá a přesná. Železo se rozpustí v HNO3 a následně v H2SO4 s odpařením do sucha. Následuje roztok, přičemž křemík zůstane ve zbytku jako SiO2.
Podrobnosti: Odváží se 2 gm borky a přenese se na platinovou nebo porcelánovou misku. Přidejte 30 c.cs. 8E. HNO3 Když působení zjevně ustane, přidejte 20 c.cs. 18E. H2SO4 a odpařte. (Blair doporučuje jemný závan horkého vzduchu na povrch kapaliny. Vzduch se ohřívá průchodem malé spirály měděné trubky zahřáté nad bunsenem. Odpařování se tak urychlí a zabrání se spirtování.) V odpařování se pokračuje, dokud se neuvolní velké množství výparů SO3. Ochlaďte a opatrně zřeďte destilovanou vodou na 130 cm3. Zahřívejte, dokud se všechen FeSO4 nerozpustí. Přefiltrujte a promyjte nejprve trochou E. HCl a poté horkou vodou. Tato filtrace se nejlépe provádí pomocí bezpopelnatého filtračního papíru o průměru 7 cm (zkontrolujte popel zapálením dvou nebo tří papírů). Vysušte; přeneste do platinového kelímku; zapalte jako obvykle a zvažte. Do kelímku přidejte 5 cm3 silné H2SO4 a 5 cm3 silné HF. Opatrně odpařte do sucha za použití horkého vzduchu, aby se odpařování urychlilo. Zapalte a znovu zvažte. Pokud jsou H2SO4 a HF čisté, rozdíl hmotností představuje SiO2. H2SO4 a HF (zejména HF) zkontrolujte odpařením slepého vzorku. Jakýkoli zjištěný zbytek se musí započítat.
ESTIMULACE FOSFORU
I zde různé autority uvádějí řadu metod, z nichž většina při pečlivém dodržování dává přesné výsledky. Dvě metody, které jsou nejvhodnější pro technickou analýzu, jsou metoda objemové redukce, kterou připravila subkomise (pánové Barba, Blair, Drown, Dudley a Shimer) Mezinárodního výboru pro ocelářské normy v USA, a modifikovaná redukční metoda, jak ji uvedli pánové Dudley a Pease, Jour. Anal. Appl. Chem., vii. 108. První metoda je plně popsána v Blair’s Analysis of Iron; druhá metoda je zde uvedena.
Železo se rozpustí a P se vysráží jako fosfomolybdenan amonný. Ten se rozpustí a působením Zn a H2SO4 se redukuje MoO3 a redukovaná kapalina se pak titruje K2Mn2O8 (standardní roztok) a z počtu použitých c.cs lze vypočítat obsah P.
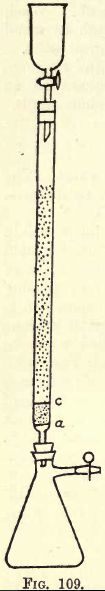
Podrobnosti. -Tam, kde je třeba provést velké množství práce, je nutný třepací přístroj (viz katalogy chemických dodávek). Student však může potřebné třepání provádět ručně. Než se přistoupí k analýze, musí se připravit redukční aparatura (modifikace Jonesova reduktoru) (viz obr. 109).
Na a je jemně perforovaný kotouč z pevné platinové fólie. Mezi a a c je asi ¾ palce čistého bílého písku, c je další perforovaný platinový kotouč.
Nad tímto kotoučem je zkumavka naplněna jemně granulovaným amalgamovaným zinkem, připraveným takto:- Rozpusťte 5 g. Hg v 25 ccm silného HNO3, zředí se vodou a roztok se doplní na 1 litr. Do tohoto roztoku
se vsype půl kilogramu granulovaného zinku, který projde sítem 20, ale neprojde 30 sítem. Třepejte jednu nebo dvě minuty. Roztok vylijte. Omyjte a vysušte zinek, který je nyní amalgamovaný. Nálevka a baňka se k přístroji připojí podle obrázku.
Připravte si následující činidla :-
(a) Silný oxidační roztok K2Mn2O8. 12 g čistého K2Mn2O8 v 1 litru vody. Přefiltrujte a naplňte do lahví.
(b) Roztok molybdenanu.-Rozpusťte 50 gms. MoO3 v 200 c.cs, NH4HO (S.G. .96). Přefiltrujte a k filtrátu přidejte 500 c.cs. HNO3 (S.G. 1,2). Před použitím nechte stát nejméně 24 hodin.
(c) Roztok kyselého síranu amonného – K 500 ccm destilované vody přidejte 27,5 ccm. NH4HO (S.G. 0,96) a poté 24 ccm čisté H2SO4 (S.G. 1,84) a zřeďte na 1000 ccm.
(d) Standardní roztok K2Mn2O8 – Rozpusťte 2 g krystalického K2Mn2O8 v 1000 ccm destilované vody. Roztok standardizujte takto : Odvažte 3 dávky po .1 až .3 g důkladně očištěného železného drátu, jehož obsah železa je znám. Přeneste do Erlenmeyerovy baňky o objemu 100 cm3 a do každé přidejte 40 cm3. 8E. H2SO4. Po rozpuštění se vaří 5 minut; zředí se na 150 cm3 a projde se reduktorem a promyje, čímž se objem zvýší na 200 cm3 podle pokynů v analýze. Titrujte každou šarži pomocí K2Mn2O8. Výsledky by měly souhlasit pro kovové železo s přesností na 1/100 miligramu. V odebraném drátu se provede požadovaný přídavek na nečistoty. Předpokládejme, že 1 cm3 K2Mn2O8 = 0,0034923 gm Fe, pak vynásobte tuto hodnotu v Fe poměrem MoO3 k Fe, tj. 0,9076, a součin poměrem P
přítomného k MoO3, tj. 0,019, máme
1 cm3 K2Mn2O8 = 0,0000602 gm. P
Analýza
Odvažte 1 gm vývrtu. Přeneste do Erlenmeyerovy baňky o objemu 200 cm3. Přidejte 70 c.cs. 5E. HNO3. Po dokončení roztoku minutu povařte a přidejte 10 cm3 „oxidačního“ roztoku K2Mn2O8. Vařte, dokud nezmizí růžové zbarvení a neoddělí se MnO2. Odstraňte a za stálého míchání postupně přidávejte krystalky čistého (bezfosforového) FeSO4, dokud se obsah nevyjasní. Roztok zahřejte na 80 °C (je-li přítomen As, na 35 °C). Přidejte 75 cm3 roztoku molybdenanu při teplotě 27 °C. Baňku uzavřete gumovou zátkou a 5 minut protřepávejte. Nechte 5 minut stát. Poté přefiltrujte přes 9 cm filtr a promývejte roztokem kyselého síranu amonného, dokud několik kapek promývacího roztoku nedá žádné zbarvení sulfidem amonným.
Sraženinu na papíře rozpusťte 5 c.cs. NH4HO (S.G. 0,90) a 25 ccm vody, přičemž se roztok nechá stéct zpět do původní baňky, čímž se rozpustí veškerá sraženina ulpívající na jejích stěnách. Promývejte, dokud množství filtrátu a promývacího roztoku nedosáhne 150 c.cs. Přidejte 10 ccm silné H2SO4 (S.G. 1,84) a zřeďte na 200 ccm. Roztok je nyní připraven k redukci.
Do nálevky nalijte 100 cm3 teplé ~E/2 H2SO4. Připojte baňku k filtrační pumpě a otevřete svorku tak, aby roztok téměř, ale ne zcela, vytékal z nálevky. Poté do nálevky přidejte následující prázdný roztok-5 c.cs. NH4HO (S.G. 0,90), 10 c.cs. H2SO4 (S.G. 1,84) a 50 c.cs. vody, smíchané dohromady. Svorku opět otevřete tak, aby tato směs téměř vytekla z nálevky. Nyní do nálevky přidejte 200 c.cs, E/2 H2SO4 a téměř ji propusťte.
Odpojte baňku, přičemž nejprve uzavřete olejový kohout nálevky. Obsah baňky titrujte K2Mn2O8. Obecně se takto spotřebuje asi 0,1 c.cs manganistanu a toto množství se musí odečíst od budoucích odečtů.
Nyní přelijte roztok, který má být redukován, do nálevky. Připojte čistou baňku. Připojte a spusťte filtrační čerpadlo. Otevřete kohout a svorku tak, aby roztok téměř protekl. Vypláchněte baňku, která obsahovala roztok, 100 c.cs. E/2 H2SO4. Přidejte jej do nálevky a zpracujte jako předtím.
Nakonec přidejte a téměř propusťte dalších 100 cm3 kyseliny.
Redukovaný roztok ve filtrační baňce by nyní měl být jasně zelený.
Odstraňte jako předtím a titrujte roztokem manganistanu. Zelená barva se změní na růžově hnědou, pak na růžově žlutou, pak na bezbarvou a nakonec se získá stálá růžová (po jedné minutě stání). Ze získaného údaje odečteme slepý údaj a z výše uvedených údajů vypočítáme procento přítomného P.
Namísto této volumetrické metody někteří chemici dávají přednost přímému vážení žluté fosfomolybdenanové sraženiny. Podrobnosti viz Blair’s Analysis of Iron, str. 108.
Poznámka: Student by měl, pokud je to možné, využít odkazů na speciální autority. V této době by již měl být schopen konzultovat, porovnávat a do jisté míry uvážlivě používat takové materiály. Žádná učebnice nemůže podat vyčerpávající pojednání o „železe a ocelích“, ani o žádném z témat pojednávaných v této části; proto musí analytik, který chce vyniknout v technické práci, pečlivě prostudovat odkazy, které jsou zde uvedeny, spolu s aktuální literaturou. Bylo uvedeno kolorimetrické stanovení kombinovaného uhlíku Eggertzovou metodou; mangan lze stanovit poněkud podobně Peterovou kolorimetrickou metodou nebo acetátovou metodou (viz Blair atd.).
.