Obrázek 1. Signální dráha Toll-like receptoru
Co je to Toll-like receptor?
Toll-like receptory (TLR) jsou třídou proteinů, které hrají klíčovou roli ve vrozené imunitě. Jsou to transmembránové receptory s jednou doménou, které patří mezi receptory rozpoznávání vzorů (pattern recognition receptors, PRR), které jsou obvykle exprimovány ve strážních buňkách, jako jsou makrofágy dendritické buňky a mnoho dalších neimunitních buněk, jako jsou fibroblasty a epiteliální buňky. Rozpoznávají strukturně zachovalé molekuly pocházející z mikrobů, které se nazývají molekulární vzory spojené s patogeny (PAMPs), nebo molekuly pocházející z poškozených buněk, označované jako vzory spojené s poškozením (DAMPs). Mezi PAMPs patří různé složky bakteriální buněčné stěny, jako je lipopolysacharid (LPS), peptidoglykan (PGN) a lipopeptidy, a také flagellin, bakteriální DNA a virová dvouřetězcová RNA. DAMPs zahrnují intracelulární proteiny, jako jsou proteiny tepelného šoku, a také fragmenty proteinů z extracelulární matrix. PRR aktivují následné signální dráhy, které vedou k indukci vrozené imunitní odpovědi produkcí zánětlivých cytokinů, interferonu typu I (IFN) a dalších mediátorů. Tyto procesy nejenže spouštějí okamžité obranné reakce hostitele, jako je zánět, ale také připravují a organizují adaptivní imunitní reakce specifické pro antigen. Tyto reakce jsou nezbytné pro odstranění infikujících mikrobů a také klíčové pro následné instrukce antigenně specifických adaptivních imunitních reakcí.
Obrázek 2. Schéma molekulární struktury TLRs.
Rodina receptorů podobných TLR
Rodina TLR zahrnuje 10 členů (TLR1-TLR10) u člověka a 12 členů (TLR1-TLR9, TLR11-TLR13) u myši. TLR se lokalizují na povrchu buněk nebo v intracelulárních kompartmentech, jako je ER, endosom a lysosom. TLR na povrchu buněk zahrnují TLR1, TLR2, TLR4, TLR5, TLR6 a TLR10, zatímco intracelulární TLR jsou lokalizovány v endosomu a zahrnují TLR3, TLR7, TLR8, TLR9, TLR11, TLR12 a TLR13 (obrázek 1). TLR na povrchu buněk rozpoznávají především mikrobiální membránové složky, jako jsou lipidy, lipoproteiny a proteiny. Intracelulární TLR rozpoznávají nukleové kyseliny pocházející z bakterií a virů a také rozpoznávají vlastní nukleové kyseliny u chorobných stavů, jako je autoimunita.
Funkce receptorů podobných Toll je obvykle založena na procesu dimerizace dvou molekul TLR, ale ne vždy. Například TLR-1 a TLR-2 se při rozpoznávání molekul PAMPs, mezi které patří hlavně lipoproteiny, peptidoglykany, lipotechinové kyseliny (LTA, Gram-), zymosan, mannan a tGPI-mucin, vzájemně spojí a vytvoří dimer. TLR-2 může také tvořit dimer s TLR-6, když rozpoznávají stejné PAMPs uvedené výše. TLR-4 může rozpoznat lipopolysacharid (LPS, Gram+) a vytvořit homodimer s jinou molekulou TLR-4. TLR-5 mohou rozpoznat bakteriální bičík, ale netvoří dimer. TLR-11 je funkční u myší a rozpoznává především uropatogenní bakterie. TLR-3, 7, 8, 9, 13 jsou exprimovány na povrchu endozomů v cytoplazmě. TLR3 rozpoznává virovou dvouvláknovou RNA (dsRNA), malé interferující RNA a vlastní RNA pocházející z poškozených buněk. TLR-7 je převážně exprimován v plazmocytoidních DC (pDC) a rozpoznává jednovláknovou (ss) RNA z virů. Rozpoznává také RNA z bakterií streptokoka B v konvenčních DC (cDC). TLR8 reaguje na virovou a bakteriální RNA. TLR-9 rozpoznává bakteriální a virovou DNA, která je bohatá na nemetylované CpG-DNA motivy. TLR13 rozpoznává bakteriální 23S rRNA a neznámé složky viru vezikulární stomatitidy.
Ačkoli existuje tolik typů molekul TLR, které rozpoznávají širokou škálu ligandů, všechny tyto TLR sdílejí společný strukturní rámec ve svých extracelulárních, ligandy vázajících doménách. Všechny tyto domény mají podkovovitou strukturu vybudovanou z motivů bohatých na leucin. Při vazbě ligandu obvykle dvě extracelulární domény vytvoří dimer ve tvaru písmene „m“, který obklopí molekulu ligandu, čímž se transmembránové a cytoplazmatické domény dostanou do těsné blízkosti a spustí následnou signální kaskádu (obrázek 2).
Signální dráha receptorů podobných tollům
1. Signalizační kaskáda Toll-like receptorů
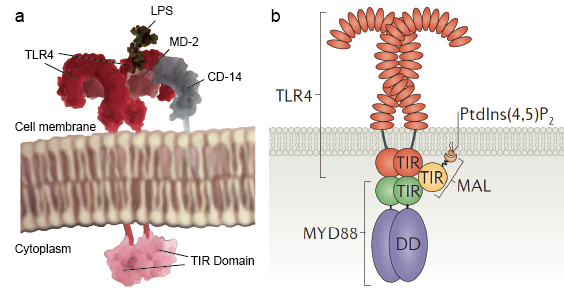
Toll-like receptory umožňují sentinelovým buňkám, jako jsou makrofágy, detekovat mikroby prostřednictvím PAMPs, například LPS. LPS je složkou buněčné stěny bakterií. Mechanismus rozpoznávání lipopolysacharidu receptory podobnými Toll je složitý a vyžaduje několik akcesorických proteinů. Sérový protein, LPS-vázající protein, váže monomery LPS a přenáší je na protein zvaný CD14. CD14 může být rozpustný nebo se může vázat na povrch buněk prostřednictvím glykosylfosfatidylinositolové kotvy. CD 14 přenáší a nakládá LPS na extracelulární doménu receptorů podobných Toll. TLR jsou schopny detekovat LPS pomocí pomocného proteinu zvaného MD-2. Když se LPS naváže na komplex TLR-CD14-MD2, dojde k homodimerizaci TLR. Konformační změna extracelulárních domén iniciuje dimerizaci cytoplazmatické domény Toll IL-1 receptoru (TIR). Konformační změna TIR poskytuje nové lešení, které umožňuje nábor adaptorových proteinů k vytvoření postreceptorového signálního komplexu. TIR obsahující adaptorový protein myeloidní diferenciační protein primární odpovědi 88 (MyD88).
MyD88 funguje jako adaptor spojující TLR/IL-1R s následnými signálními molekulami, které mají DD. Rozpoznává konformační změnu v doméně TIR TLRs, váže se na nový receptorový komplex a přenáší signalizaci pomocí interakce amino(N)-terminální domény smrti (DD) s kinázami asociovanými s IL-1R (IRAKs). Výsledkem je komplexní kaskáda se signálními invencemi, která varuje buňku před invazí patogenu. Existují 4 IRAK (IRAK 1, 2, 4, M). Obsahují N-terminální DD a centrální serin/treonin-kinázovou doménu. IRAK1 a IRAK4 mají vlastní kinázovou aktivitu, zatímco IRAK2 a IRAK-M nemají detekovatelnou kinázovou aktivitu. IRAK4 se aktivuje pomocí MyD88 a pokračuje v aktivaci IRAK1. IRAK1 pak aktivuje navazující TRAF6. TRAF6 je členem rodiny TRAF (tumor necrosis factor receptor – TNFR), který zprostředkovává signální dráhy cytokinů. Po stimulaci je TRAF6 rekrutován do receptorového komplexu a aktivován IRAK-1, který se váže na doménu TRAF TRAF6. Poté se komplex IRAK-1/TRAF6 oddělí od receptoru a spojí se s kinázou 1 aktivovanou TGF-beta (TAK1) a s proteiny vázajícími TAK1, TAB1 a TAB2. Komplex TRAF6, TAK1, TAB1 a TAB2 se přesune do cytoplazmy, kde vytvoří velký komplex s dalšími proteiny, jako jsou ligázy E2 Ubc13 a Uev1A. Bylo prokázáno, že komplex Ubc13 a Uev1A katalyzuje syntézu polyubikvitinového řetězce TRAF6 navázaného na Lys 63, a tím vyvolává aktivaci TAK1 a nakonec NF-kB zprostředkovanou TRAF6. Tyto výše popsané signální dráhy se nazývají dráhy závislé na MyD88, protože signál vychází z molekuly MyD88. Existuje také další dráha nazývaná MyD88-independedt dráha, jejíž signál nevychází z MyD88. Místo toho signál vychází z proteinu TRIF. TRIF interaguje s TRAF6 a TRAF3. TRAF6 rekrutuje kinázu RIP-1, která následně interaguje s komplexem TAK1 a aktivuje jej, což vede k aktivaci NF-kB a MAPK a indukci zánětlivých cytokinů. Naproti tomu TRAF3 rekrutuje kinázy související s IKKTBK1 a IKKi spolu s NEMO pro fosforylaci a aktivaci IRF3. IRF3 vytvoří dimer a přemístí se z cytoplazmy do jádra, indukuje expresi IFN typu I.
2. Signalizace po proudu
TLR signalizují vlastně hlavně prostřednictvím náboru specifických adaptorových molekul, což vede k aktivaci transkripčních faktorů NF-kB a IRF, které diktují výsledek vrozené imunitní odpovědi. Takže tato cesta následné signalizace má aktivovat transkripční faktor IRFs, signální dráhu NF-kB a dráhu MAKP. Podrobnější informace o dráze NF-kB a dráze MAKP najdete na adrese:
Signální dráha NF-kB, signální dráha P38 a signální dráha MAKP.
3. Regulace dráhy
Příčinou je určitá negativní regulace řadou molekul prostřednictvím různých mechanismů, aby se zabránilo nadměrným imunitním reakcím, které vedou ke škodlivým následkům spojeným s autoimunitou a zánětlivým onemocněním, nebo aby se tyto reakce ukončily. Aktivace dráhy závislé na MyD88 je potlačena ST2825, SOCS1 a Cbl-b a aktivace dráhy závislé na TRIF je potlačena SARM a TAG. Tyto molekuly se spojují s MyD88 nebo TRIF, aby jim zabránily ve vazbě na TLR nebo navazující molekuly. Aktivace TRAF3 je negativně regulována SOCS3 a DUBA. Na TRAF6 se zaměřuje řada inhibičních molekul, jako jsou A20, USP4, CYLD, TANK, TRIM38 a SHP. Aktivace TAK1 je inhibována TRIM30a a A20.
4. Vztah k nemocem
Jelikož se TLR podílí na snímání LPS a mohl by hrát roli při sepsi, je cílení na TLR důležité pro léčbu řady nemocí. Kromě zásahu do odpovědí TLR za účelem léčby infekcí způsobených patogeny bylo zřejmým klinickým využitím poznatků získaných ze studií TLR použití ligandů TLR jako adjuvans pro vakcíny. Kromě toho se v klinice zkouší také inhibice TLR, jejímž cílem je omezit nadměrný zánět, který je pravděpodobně způsoben nadměrnou aktivací určitého TLR.
| Takeda, Kiyoshi a Shizuo Akira. „Signální dráhy TLR“. Semináře z imunologie. Vol. 16. No. 1. Academic Press, 2004. | |
| Akira, Shizuo, and Kiyoshi Takeda. „Signalizace Toll-like receptorů.“ Nature reviews immunology 4.7 (2004): 499-511. | |
| Lim, Kian-Huat a Louis M. Staudt. „Signalizace Toll-like receptorů.“ Cold Spring Harbor perspectives in biology 5.1 (2013): a011247. | |
| aTaro Kawai, Takumi Kawasaki. „Signální dráhy Toll-like receptorů“. Pattern Recognition Receptors and Cancer 8916 (2015): 7. | |
| Gay, Nicholas J., et al. „Assembly and localization of Toll-like receptor signalling complexes“. Nature reviews Immunology 14.8 (2014): 546-558. | |
| O’Neill, Luke AJ, Douglas Golenbock a Andrew G. Bowie. „The history of Toll-like receptors redefining innate immunity“ (Historie receptorů podobných Toll receptorům, které redefinují vrozenou imunitu). Nature Reviews Immunology 13.6 (2013): 453-460. | |
| Botos, Istvan, David M. Segal a David R. Davies. „Strukturní biologie Toll-like receptorů“. Structure 19.4 (2011): 447-459. |
.