Cellen, hvorfra grenen kommer ud, er den konidiophore fodcelle, som adskiller sig fra andre vegetative celler ved at have en brunpigmenteret sekundær vægforstærkning på indersiden af sin oprindelige væg. Stænglen vokser apikalt, indtil den når en længde på ca. 100 µm, hvorefter spidsen svulmer op og danner konidiophoreblæren, der har en diameter på ca. 10 µm. Et enkelt lag af talrige primære sterigmata, kaldet metulae, spirer derefter fra vesiklen, og sekundære sterigmata, phialiderne, spirer fra de udsatte spidser af metulae. Phialiderne er stamcellerne, som efterfølgende gennemgår gentagne asymmetriske delinger for at danne de lange kæder af enteroblastiske konidier, som er ca. 3 µm i diameter (fig. 7).
Klassisk genetisk analyse ved isolering og analyse af mutanter har fastslået den grundlæggende genetiske struktur for Aspergillus’ konidiation. Det blev anslået, at mellem 300 og 1.000 genloci var involveret i konidiation ved at sammenligne mutationsfrekvenserne på loci, der påvirker konidiation, med mutationsfrekvenserne for andre funktioner (Martinelli & Clutterbuck, 1971). En analyse af mRNA-arter viste, at ca. 6.000 blev udtrykt i vegetativt mycelium, og yderligere 1.200 blev fundet i kulturer, der omfattede konidiophore og konidier; 200 af disse yderligere mRNA’er blev fundet i selve konidierne. Kun ca. 2 % af mutanterne af A. nidulans, der manglede konidier, havde defekter i de stadier, der vedrører konidiophorevækst og -udvikling, og 85 % af konidiationsmutanterne var også defekte i vegetativ hyfervækst og i opnåelse af kompetence.
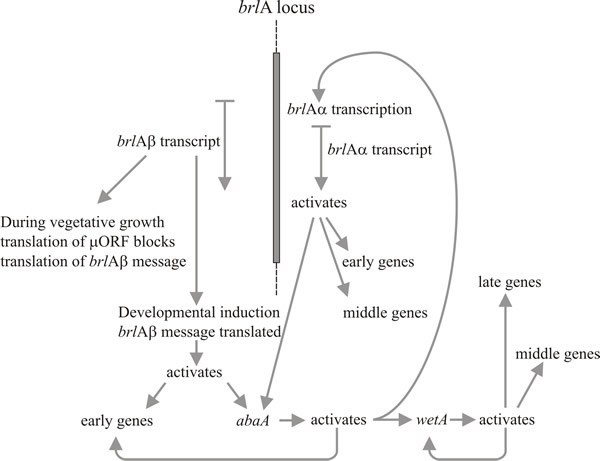
Især to gener spiller en nøglerolle i konidiophore-morfogenese: det drejer sig om genet “bristle” (brlA), som har defekter i vesikeldannelse og metula-dannelse, og “abacus” (abaA), hvor konidier erstattes af perlelængder af hyfer, så det er formodentlig defekt i konidieudspring fra phialiden og den endelige septation. Et tredje gen, wetA, er defekt i et tidligt stadium af sporeformningen. Konidier fra wetA-mutanter mangler pigment og hydrofobicitet; de autolyser efter få timer og udtrykker ikke en række sporespecifikke mRNA’er. WetA-genets transkript mangler i brlA- og abaA-mutanter (dvs. brlA og abaA er epistatiske over for wetA), og undersøgelser af dobbeltmutanter viser, at disse tre gener virker i rækkefølgen: brlA → abaA → wetA.
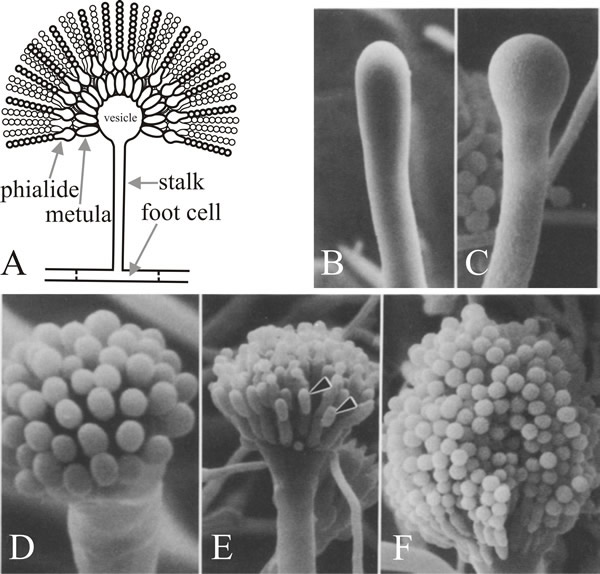
Et slående træk ved mutationsanalysen af konidiophore-udviklingen hos A. nidulans er, at mutanter af kun disse tre gener forårsager defekter i konidiophore- og spore-morfogenese, mens op til 1.000 andre genloci forårsager fravær af konidiation, når de er muteret. Dette antyder, at brlA, abaA og wetA er regulatorer, der integrerer ekspressionen af andre gener, som er nødvendige for konidiation, men som ikke selv er dedikeret til det. Mange af Aspergillus-konidiationsmutanterne var også defekte i seksuel reproduktion, så en anden konklusion er, at der er en vis økonomi i brugen af morfogenetiske gener i forskellige udviklingsprocesser. Det kan formodes, at forskellige udviklingsmåder anvender strukturelle gener, som ikke udelukkende er udviklingsgener, men som fungerer i mange veje, og som får deres udviklingsspecificitet tildelt af de regulatorer, som de reagerer på. Dette er indbegrebet af ideen om, at nøglen til eukaryote udvikling ligger i evnen til at bruge relativt få reguleringsgener til at integrere mange andres aktiviteter.
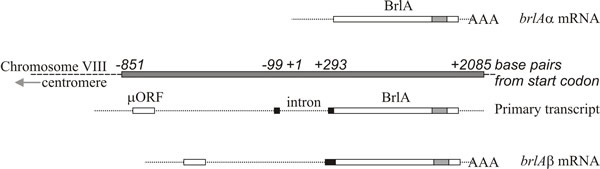
Molekylær analyse støtter fortolkningen af, at brlA, abaA og wetA er regulatorer; brlA-sekvensen koder for et zinkfingerprotein, som er en sekvensspecifik DNA-bindende transkriptionsaktivator af udviklingsregulerede målgener (fig. 8). Det er imidlertid ikke hele historien, for brlA-produktet har forskellige affiniteter for forskellige målgener. Faktisk består brlA-lokusset af overlappende transkriptionsenheder (fig. 9), idet nedstrømsenheden betegnes brlAα og opstrømsenheden brlAβ; mellem dem løser deres produkter to klassiske udviklingsproblemer, nemlig hvordan man reagerer på et signal, og hvordan man opretholder dette svar, når signalet er forsvundet.
De to brlA-transskriptenheder deler den samme læseramme i det meste af deres længde, men brlAβ har yderligere 23 aminosyrerester i den amino-terminale ende af denne læseramme, og dens transkript besidder også en separat læseramme på 41 aminosyrerester (kaldet µORF) nær dens 5′-terminus. µORF-produktet undertrykker translation fra den nedstrøms læseramme (BrlA), og selv om brlAβ-transkriptet kan påvises i vegetative hyfer, produceres BrlA-peptidet ikke. Repressionen forårsaget af µORF overvindes først, når myceliet er kompetent, hvilket sandsynligvis signaleres som en kvælstofbegrænsning (et almindeligt miljøsignal for initiering af sporulation i Ascomycota), hvilket reducerer aminoacyl-tRNA-puljerne og forstyrrer translationsreguleringen ved µORF. Når µORF’s virkning er standset, kan BrlA-peptidet oversættes fra eksisterende transkript.
Den, der opdagede denne proces, beskrev aktiveringen af konidiationsvejen som “translational triggering” (Timberlake, 1993), hvilket antyder, at den translationale trigger er en måde at gøre differentieringen følsom over for hyphaens næringsstatus. Den kompetente hypha er således forberedt til at foretage konidiophoreudvikling, men den irreversible aktivering af konidiationsvejen forhindres af en translationel repression, der opretholder den vegetative vækst, indtil sporulationsforholdene er ideelle.
Aktivering af brlA ses derfor som det første skridt i konidiophoreudviklingen, og dets produkt aktiverer igen et panel af konidiationsspecifikke gener, hvoraf den næste regulator, abaA, er en af dem. AbaA-produktet er også et DNA-bindende transkriptionelt regulatorprotein, som øger ekspressionen af brlA-inducerede strukturelle gener. brlA- og abaA-generne er gensidige aktivatorer, fordi abaA også aktiverer brlA. Naturligvis skal brlA-ekspression finde sted, før abaA kan udtrykkes, men den deraf følgende abaA-aktivering af brlA forstærker sidstnævntes ekspression og gør effektivt fremskridt i vejen uafhængigt af ydre begivenheder. AbaA-produktet aktiverer også yderligere strukturgener og det sidste reguleringsgen, wetA, som aktiverer sporespecifikke strukturgener. Da brlA og abaA ikke udtrykkes i differentierende konidier, er wetA sandsynligvis involveret i inaktivering af deres ekspression i sporer (og måske også i phialiden; når den aktuelle sporkerne når det modningsstadium, der kræver wetA-regulerede gener, skal phialidkernerne “vendes tilbage” til konidie-initieringstilstanden for at starte dannelsen af den næste spore). Ekspressionen af wetA aktiveres i første omgang i phialiden ved en sekventiel virkning af brlA og abaA, og den er derefter autoreguleret (wetA-produktet aktiverer wetA-transkriptionen). Positiv autoregulering af wetA opretholder efterfølgende ekspressionen af wetA, efter at konidiet er blevet adskilt (fysisk og cytologisk) fra phialiden.
Timberlake (1993) kaldte denne mekanisme for feedbackfiksering: gensidig aktivering, feedbackaktivering og autoregulering af de centrale regulatoriske sekvenser styrker ekspressionen af hele vejen, hvilket gør den uafhængig af de eksterne miljømæssige signaler, der har sat den i gang, og gør det muligt for sporerne at fortsætte modningen, selv efter adskillelse fra phialiden. Konidiophoreudvikling er ligesom mange andre morfogenetiske processer naturligt opdelt i sekventielle trin. Dette regulatoriske netværk viser, hvordan translationel udløsning kan knytte en morfogenetisk vej til udvikling af kompetence på den ene side og til initiering som reaktion på miljømæssige signaler på den anden side. Efter initiering resulterer feedbackfiksering i udviklingsbestemmelse i den klassiske embryologiske betydning af fortsat morfogenese, selv når den fjernes fra det initierende miljø.
Vi har i dette afsnit bevidst valgt at basere vores beskrivelse på forskning udført for ca. 50 år siden, som startede med isolering af et stort antal mutationer med ændrede konidiationsfænotyper og fortsatte med “klassiske” undersøgelser af gensegregationer og genkomplementering (Martinelli & Clutterbuck, 1971). Ud over at vise, hvordan vores forståelse af sporulation er blevet opnået, viser det værdien af at bruge disse ‘gammeldags’ teknikker til at undersøge sådanne fænomener.
Det er imidlertid ikke muligt at ignorere den omfattende forskning, der er blevet gennemført i de molekylære mekanismer, der ligger til grund for vækst og udvikling af Aspergillus. Disse undersøgelser har bekræftet, at den vigtigste begivenhed i sporulationen er aktivering af zinkfinger-transskriptionsfaktoren, der er kodet af brlA, og at abaA- og wetA-generne er nødvendige regulatorer af konidiation. Den abaA-kodede transkriptionsfaktor aktiveres af brlA efter differentiering af metulae og i de midterste stadier af konidiophoreudviklingen, og det af abaA aktiverede genwetA fungerer i den sene fase af konidiationen og styrer syntesen af vigtige cellevægskomponenter og omdanner metabolismen i det modnende konidium. I Aspergillus nidulans skaber disse tre gener den centrale regulatoriske vej, som sammen med andre gener kontrollerer konidiationsspecifik genekspression og sekvensen af genaktivering, der er involveret i erhvervelse af udviklingskompetence, konidiophoreudvikling og spore modning (Lee et al., 2016).
Mange aspekter af disse udviklingsveje er blevet bevaret i andre aspergilli. Medlemmer af slægten Aspergillus er blandt de mest almindeligt forekommende svampe, og alle reproducerer sig aseksuelt ved at danne lange kæder af konidier. Flere arter, herunder Aspergillus oryzae og Aspergillus niger, anvendes i industrien til enzymproduktion og fødevareforarbejdning, mens Aspergillus flavus er ansvarlig for madforringelse ved at producere de mest potente kendte naturligt forekommende kræftfremkaldende stoffer, nemlig aflatoxinerne. En anden problematisk art er det opportunistiske humane patogen Aspergillus fumigatus, som producerer et stort antal små hydrofobiske konidier som sit primære spredningsmiddel og er blevet et udbredt luftbårent svampepatogen i de udviklede lande. Hos immunsvækkede patienter forårsager A. fumigatus en invasiv aspergillose med en høj dødelighed. BrlA-AbaA-WetA-udviklingssignalvejen er blevet bevaret i konidiation af disse Aspergillus-arter (Yu, 2010; Tao & Yu, 2011; Krijgsheld et al., 2013). Endvidere har proteomiske, transkriptomiske og metabolomiske undersøgelser givet et detaljeret billede af de dynamiske ændringer, der sker i mange tusinde gener, transskriptioner, enzymer og metaboliske reaktioner under dannelse, modning, hviletid og spiring af Aspergillus konidier (van Leeuwen et al., 2013; Novodvorska et al., 2016; Teertstra et al., 2017).
opdateret juli, 2019