Ioniseringsenergier for s- og p-blokelementer
Ioniseringsenergierne for grundstofferne i tredje række i det periodiske system viser det samme mønster som for \(Li\) og \(Be\) (Tabel \(\(\PageIndex{2}\))): De successive ioniseringsenergier stiger støt, når elektroner fjernes fra valensorbitalerne (3s eller 3p i dette tilfælde), efterfulgt af en særlig stor stigning i ioniseringsenergien, når elektroner fjernes fra fyldte kerneniveauer, som angivet ved den fede diagonale linje i tabel \(\(\PageIndex{2}\)). I den tredje række i det periodiske system svarer den største stigning i ioniseringsenergien således til at fjerne den fjerde elektron fra \(Al\), den femte elektron fra Si og så videre – dvs. at fjerne en elektron fra en ion, der har den foregående ædelgas’ valenselektronkonfiguration. Dette mønster forklarer, hvorfor kemien af grundstofferne normalt kun involverer valenselektroner. Der kræves for meget energi for enten at fjerne eller dele de indre elektroner.
| Element | \(I_1\) | \(I_2\) | \(I_3\) | \(I_4\) | \(I_5\) | \(I_6\) | \(I_7\) | |
|---|---|---|---|---|---|---|---|---|
| *Inner-shell-elektron | ||||||||
| Na | 495.8 | 4562.4* | – | – | – | – | – | – |
| Mg | 737.7 | 1450.7 | 7732.7 | – | – | – | – | – |
| Al | 577.4.4.4 | 1816.7 | 2744.8 | 11.577.4.4 | – | – | – | |
| Si | 786.5 | 1577.1 | 3231.6 | 4355.5 | 16.090.6 | – | – | |
| P | 1011.8 | 1907.4.4 | 2914.1 | 4963.6 | 6274.0 | 21,267.4.3 | – | |
| S | 999.6 | 2251.8 | 3357 | 4556.2 | 7004.3 | 8495.8 | 27,107.4.3 | |
| Cl | 1251.2 | 2297.7 | 3822 | 5158.6 | 6540 | 9362 | 11.018,2 | |
| Ar | 1520.6 | 2665.9 | 3931 | 5771 | 7238 | 8781.0 | 11,995.3 | |
Eksempel \(\PageIndex{1}\): Højeste fjerde ioniseringsenergi
På grundlag af deres placering i det periodiske system skal du forudsige, hvilket af disse grundstoffer der har den højeste fjerde ioniseringsenergi: B, C eller N.
Givet: tre grundstoffer
Spørgsmål: grundstof med den højeste fjerde ioniseringsenergi
Strategi:
- Oplys elektronkonfigurationen for hvert grundstof.
- Festlæg, om der fjernes elektroner fra en fyldt eller delvist fyldt valensskal. Forudsig, hvilket grundstof der har den højeste fjerde ioniseringsenergi, idet du erkender, at den højeste energi svarer til fjernelse af elektroner fra en fyldt elektronkerne.
Løsning:
A Disse grundstoffer ligger alle i den anden række i det periodiske system og har følgende elektronkonfigurationer:
- B: 2s22p1
- C: 2s22p2
- N: Den fjerde ioniseringsenergi for et grundstof (\(I_4\)) er defineret som den energi, der kræves for at fjerne den fjerde elektron:
Da kulstof og nitrogen har henholdsvis fire og fem valenselektroner, svarer deres fjerde ioniseringsenergi til at fjerne en elektron fra en delvist fyldt valensskal. Den fjerde ioniseringsenergi for bor svarer derimod til at fjerne en elektron fra den fyldte 1s2-underskal. Dette skulle kræve meget mere energi. De faktiske værdier er som følger: B, 25,026 kJ/mol; C, 6223 kJ/mol; og N, 7475 kJ/mol.
Øvelse \(\PageIndex{1}\): Laveste anden ioniseringsenergi
På grundlag af deres placering i det periodiske system skal du forudsige, hvilket af disse grundstoffer der har den laveste anden ioniseringsenergi: Svar
\(\ce{Sr}\)
Den første kolonne af data i tabel \(\(\PageIndex{2}\) viser, at den første ioniseringsenergi har tendens til at stige på tværs af den tredje række i det periodiske system. Dette skyldes, at valenselektronerne ikke skærmer hinanden særlig godt, hvilket gør det muligt for den effektive kerneladning at stige støt på tværs af rækken. Valenselektronerne tiltrækkes derfor stærkere til kernen, så atomstørrelserne falder og ioniseringsenergierne stiger. Disse virkninger repræsenterer to sider af samme sag: stærkere elektrostatiske vekselvirkninger mellem elektronerne og kernen øger yderligere den energi, der kræves for at fjerne elektronerne.
Derimod falder den første ioniseringsenergi ved Al (3s23p1) og ved S (3s23p4). Elektronkonfigurationerne for disse “undtagelser” giver svaret på hvorfor. Elektronerne i aluminiums fyldte 3s2-underskal er bedre til at skærme 3p1-elektronen, end de er til at skærme hinanden fra kerneladningen, så s-elektronerne trænger tættere ind til kernen end p-elektronen gør, og p-elektronen fjernes lettere. Reduktionen ved S sker, fordi de to elektroner i samme p-orbital frastøder hinanden. Dette gør S-atomet lidt mindre stabilt, end man ellers ville forvente, hvilket gælder for alle grundstoffer i gruppe 16.
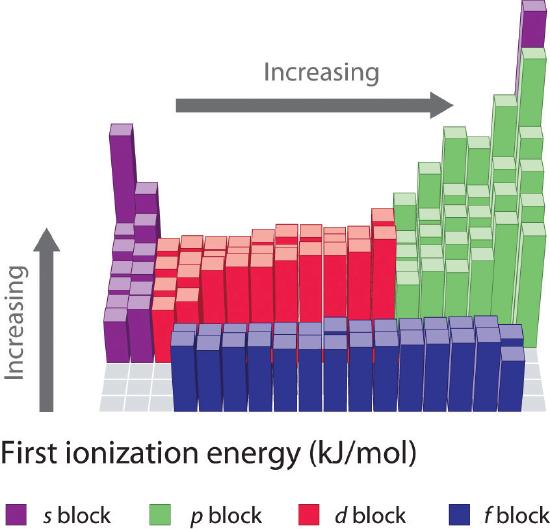
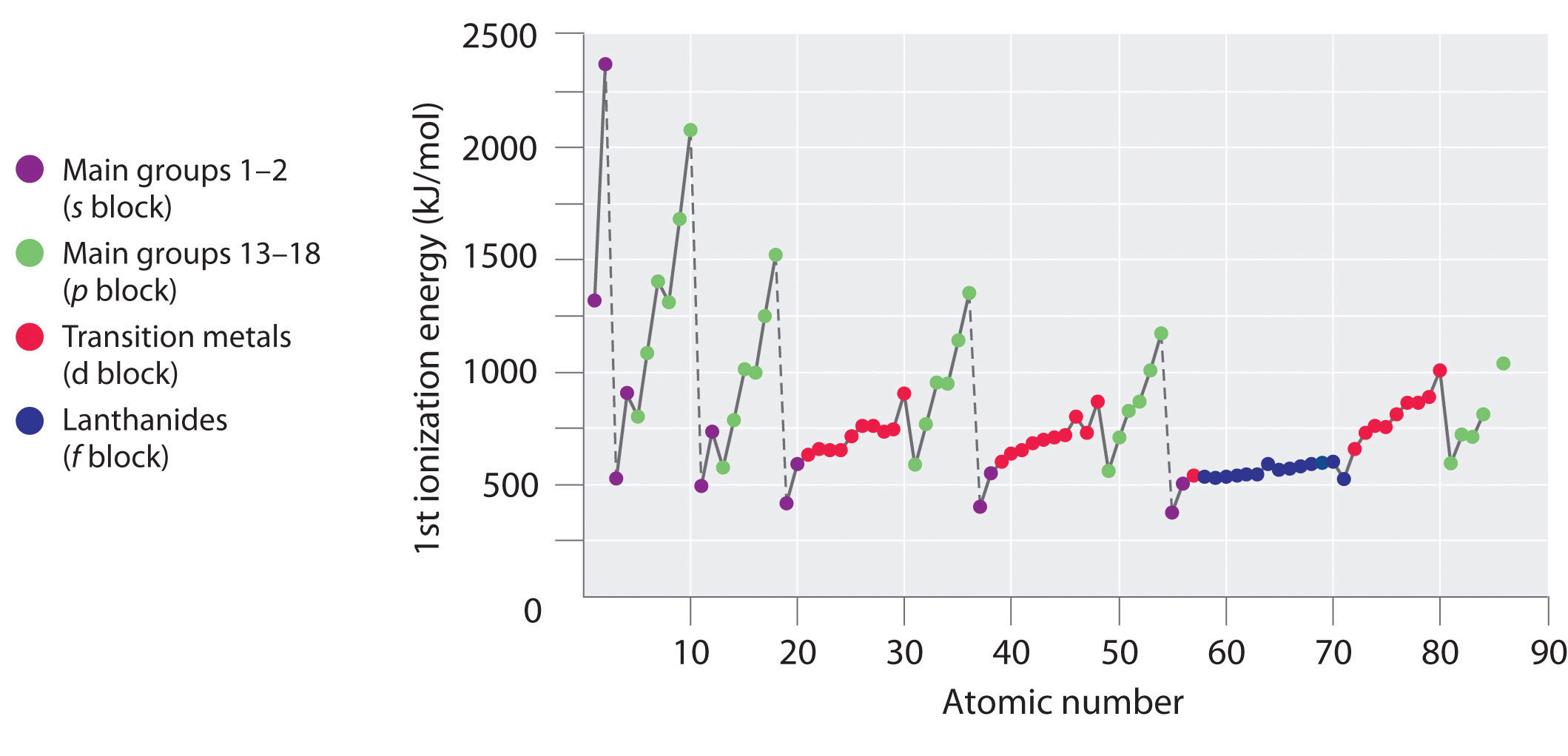
De første ioniseringsenergier for grundstofferne i de første seks rækker i det periodiske system er plottet i figur \(\PageIndex{1}\) og er præsenteret numerisk og grafisk i figur \(\PageIndex{2}\). Disse figurer illustrerer tre vigtige tendenser:
- De ændringer, der ses i anden (Li til Ne), fjerde (K til Kr), femte (Rb til Xe) og sjette (Cs til Rn) række i s- og p-blokkene, følger et mønster, der svarer til det mønster, der er beskrevet for den tredje række i det periodiske system. Overgangsmetallerne indgår dog i fjerde, femte og sjette række, og lanthaniderne indgår i sjette række. De første ioniseringsenergier for overgangsmetallerne ligner hinanden noget, og det samme gælder for lanthaniderne. Ioniseringsenergierne stiger fra venstre mod højre på tværs af hver række, med afvigelser, der forekommer ved ns2np1 (gruppe 13), ns2np4 (gruppe 16) og ns2(n – 1)d10 (gruppe 12).
- Første ioniseringsenergier falder generelt nedad i en kolonne. Selv om hovedkvantetallet n stiger nedad i en kolonne, er fyldte indre skaller effektive til at skærme valenselektronerne, så der er en relativt lille stigning i den effektive kerneladning. Som følge heraf bliver atomerne større, efterhånden som de får elektroner. Valenselektroner, der er længere væk fra kernen, er mindre tæt bundet, hvilket gør dem lettere at fjerne, hvilket medfører, at ioniseringsenergien falder. En større radius svarer typisk til en lavere ioniseringsenergi.
- På grund af de to første tendenser ligger de grundstoffer, der lettest danner positive ioner (har de laveste ioniseringsenergier), i det periodiske systems nederste venstre hjørne, mens de grundstoffer, der er sværest at ionisere, ligger i det periodiske systems øverste højre hjørne. Følgelig stiger ioniseringsenergierne generelt diagonalt fra nederst til venstre (Cs) til øverst til højre (He).

Generelt stiger \(I_1\) diagonalt fra nederst til venstre i det periodiske system til øverst til højre.
Gallium (Ga), som er det første grundstof efter den første række af overgangsmetaller, har følgende elektronkonfiguration: 4s23d104p1. Dets første ioniseringsenergi er betydeligt lavere end for det umiddelbart foregående grundstof, zink, fordi galliums fyldte 3d10-underskal ligger inden for 4p-underskallen, hvilket afskærmer den enkelte 4p-elektron fra kernen. Eksperimenter har afsløret noget endnu mere interessant: den anden og tredje elektron, der fjernes, når gallium ioniseres, kommer fra 4s2-orbitalet og ikke fra 3d10-underskallen. Galliums kemi er domineret af den resulterende Ga3+-ion med dens 3d10-elektronkonfiguration. Denne og lignende elektronkonfigurationer er særligt stabile og forekommer ofte i de tungere elementer i p-blokken. De omtales undertiden som pseudo-ædelgaskonfigurationer. For grundstoffer, der har disse konfigurationer, kendes der faktisk ingen kemiske forbindelser, hvor elektronerne er fjernet fra den (n – 1)d10 fyldte underskal.