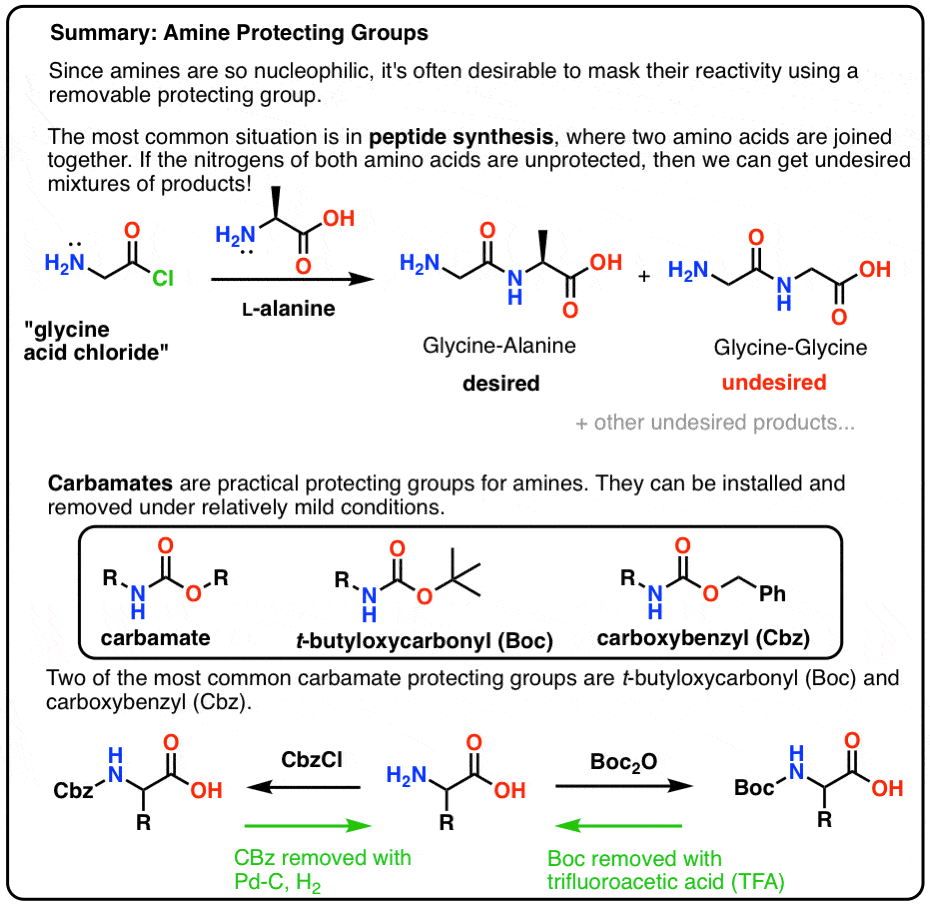
I dette indlæg introducerer vi carbamater som en nyttig beskyttelsesgruppe for aminer, især i forbindelse med fremstilling af peptider.
Her er et hurtigt oversigtsbillede af, hvad vi vil komme ind på i dette indlæg, med flere detaljer nedenfor.
Indholdsfortegnelse
- An Introduction To Simple Peptide Synthesis
- Let’s Mix Up A Batch of Gly-Ala
- A Very Bad Initial Plan
- “Hark! Hvad er det her for noget lort?”
- En beskyttelseshat til NH2
- Mate! Brug en carbamat, makker!
- Boc og CBz er biernes knæ
- Installation og fjernelse af “Boc”-beskyttelsesgruppen
- Installation og fjernelse af CBz- (eller “Z”-) carbamatbeskyttelsesgruppen
- En simpel peptidsyntese ved hjælp af carbamatbeskyttelsesgrupper
- Det fortsætter…
- Notes
- (Avanceret) Referencer og yderligere læsning
En introduktion til simpel peptidsyntese
I et nyligt indlæg gennemgik vi 3 almindelige måder at fremstille amider på:
- Tilsætning af aminer til acylhalogenider/anhydrider
- Partiel hydrolyse af nitriler
- Kobling af carboxylsyrer med aminer ved hjælp af et dehydreringsmiddel som DCC (N,N’-dicyclohexylcarbodiimid).
Det, der manglede i dette indlæg, var enhver omtale af syntese af den bedstefar af de mest nyttige amidforbindelser, som menneskeheden kender, og med det mener jeg peptider.
En peptidbinding er det navn, vi giver den amidbinding, der forbinder to aminosyrer.
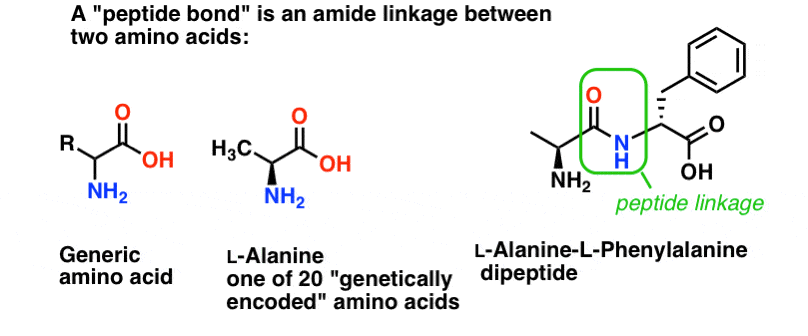
Og aminosyrer er vigtige, fordi… vent. Du ved allerede, hvorfor aminosyrer er vigtige, ikke? Hvis du ikke ved det lige nu, så kom tilbage efter at have læst dette.
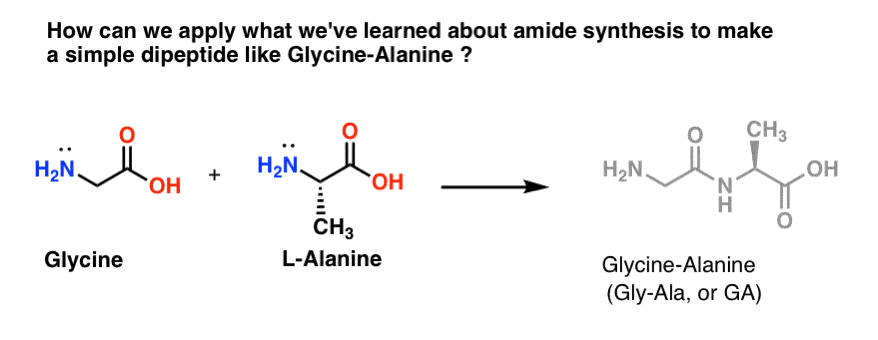
Lad os blande et parti Gly-Ala
Lad os prøve at anvende nogle af vores nyfundne amidsyntese-færdigheder til at forsøge at bygge et virkelig simpelt dipeptid, glycin-alanin. Hvis vi kan bygge et simpelt dipeptid nu, kan vi bruge det, vi har lært, til at vise, hvordan endnu mere komplekse peptider fremstilles i et senere indlæg. Vidste du, at nobelprismodtager Bruce Merrifield syntetiserede insulin ved at sammenføje en aminosyre ad gangen? Ja, virkelig.
Af de tre metoder, vi nævnte til fremstilling af amider, er kun to potentielt anvendelige til dannelse af peptidbindinger: 1) syrekloridmetoden eller 2) syntese via et koblingsmiddel som DCC. .
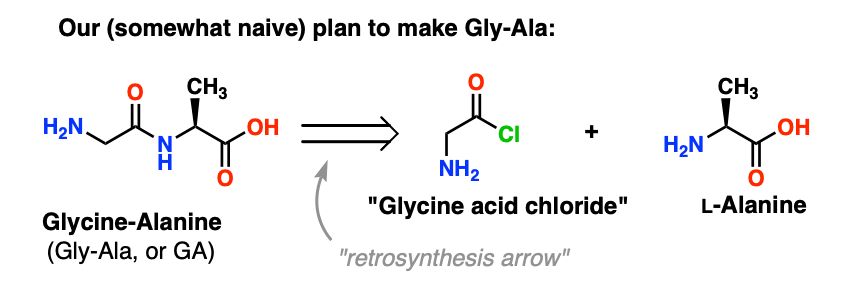
3. En meget dårlig indledende plan
Vores første forsøg på peptidsyntese vil indebære, at vi tønder fremad med en meget naiv angrebsplan og håber, at det hele lykkes i sidste ende. Hold fast folkens, for det bliver noget rod.
Vi vil starte med at foreslå syrekloridmetoden til syntese af Gly-Ala.
Så vi ser bagud fra Gly-Ala-dipeptidet, vil vores plan have os til at syntetisere peptidbindingen gennem reaktionen af alanin med syreklorid afledt fra glycin:
Der er et lille problem med denne plan. Det er måske lidt svært at få øje på i første omgang.
Lad os antage, at vi har fremstillet syrekloridet af glycin* , og at vi har “glycinsyreklorid” og alanin sammen i samme kolbe sammen med lidt overskydende base for at sætte fart på tingene.
Vi tegner reaktionen fremadrettet:
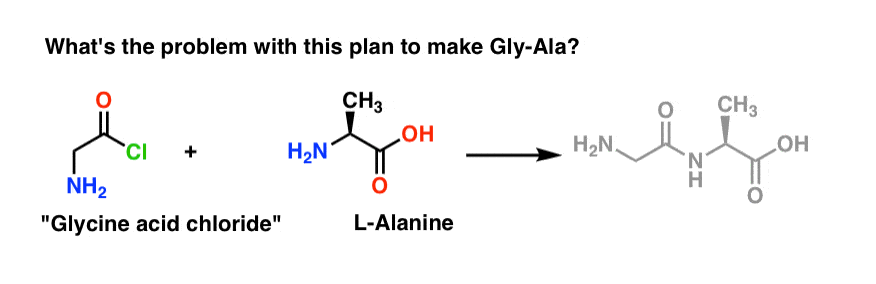
Hvad kan gå galt?
“Hark! hvad er det her for noget lort? “
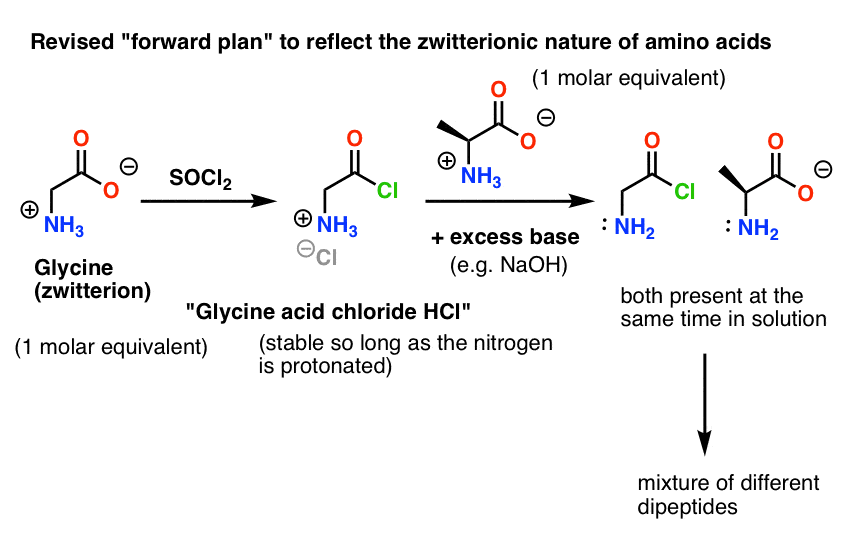
Vores plan er at lave en opløsning af syrekloridet af glycin (1 molær ækvivalent), og så lade det tålmodigt vente rundt i kolben, indtil vi tilsatte en molær ækvivalent alanin, hvorefter det ville reagere med den nukleofile NH2-gruppe i alanin.
Problemet med vores plan er, at vi ikke har med et enkelt molekyle “glycinsyrechlorid” at gøre – vi har med noget omkring et mol (6,02 x 1023 molekyler) af det at gøre. Og glycinsyrekloridet har allerede en nukleofil NH2-gruppe!
“Glycinsyreklorid” er som tegnet ikke et stabilt molekyle, fordi det kan reagere med sig selv.
Det betyder, at en opløsning af glycinsyrechlorid overladt til sig selv ville danne en polymer af glycin med strukturen Gly-Gly-Gly-Gly-Gly…
Selv en opløsning af glycinsyrechlorid i nærværelse af alanin ville ikke kun danne det ønskede Gly-Ala, men også Gly-Gly (med et tilknyttet acylhalogenid), som kan gå videre og lave mere ballade med en anden nukleofil, hvad enten det er Gly eller Ala:
(og nej, der er ikke meget, der adskiller NH2 i “glycinsyrechlorid” fra NH2 i alanin. De er omtrent lige reaktive.)
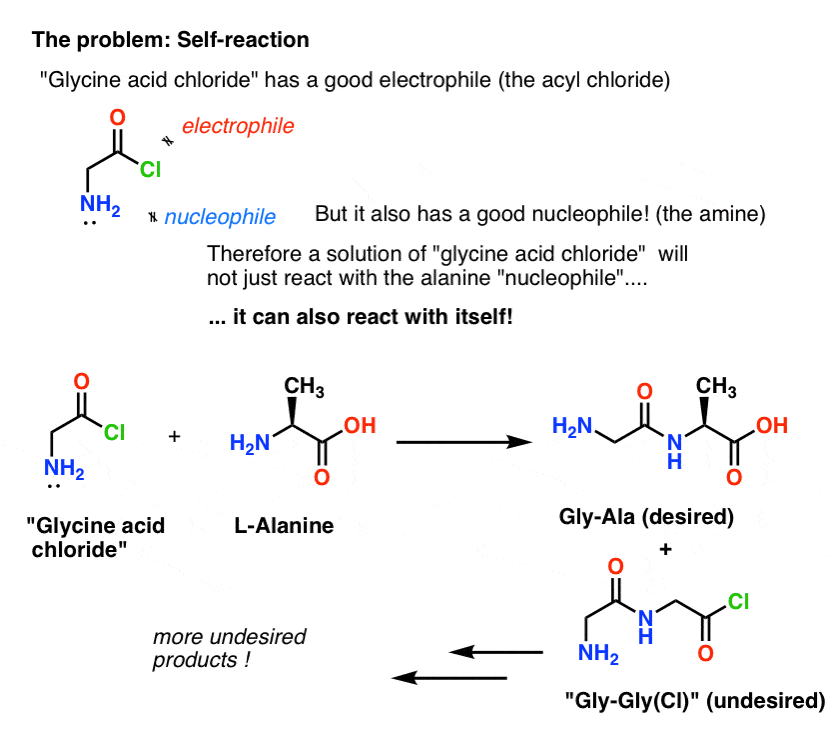
Læren her er, at når man har en opløsning af et molekyle, der indeholder både en nukleofil og en elektrofil, kan det selvreagere. Der er et navn for denne proces, som måske lyder bekendt: polymerisering.
Så hvordan forhindrer vi dette i at ske?
En beskyttelseshat for NH2
Den bedste måde er at “dække” nitrogenet på en eller anden måde med en beskyttelsesgruppe (PG), der gør NH2-gruppen ikke-nukleofil. Den skal også have følgende egenskaber:
- let og selektivt installeret
- inert over for de ønskede reaktionsbetingelser (f.eks. SOCl2 for at lave syrekloridet fra carboxylsyren)
- let og selektivt fjernet uden at påvirke slutproduktet
Vi har set beskyttelsesgruppestrategier før, især med alkoholer og brugen af Grignard-reagenser.
Her er, hvordan en beskyttelsesgruppestrategi for vores syntese af “Gly-Gly” kunne se ud. Vi installerer en beskyttelsesgruppe (“PG”) på glycin og laver derefter syrekloridet. PG’en skal vælges således, at den gør nitrogenet ikke-nukleofilt (dvs. det vil ikke reagere med syrekloridet).
Vi kan derefter danne vores peptidbinding med ubeskyttet alanin og derefter fjerne PG’en under milde forhold.
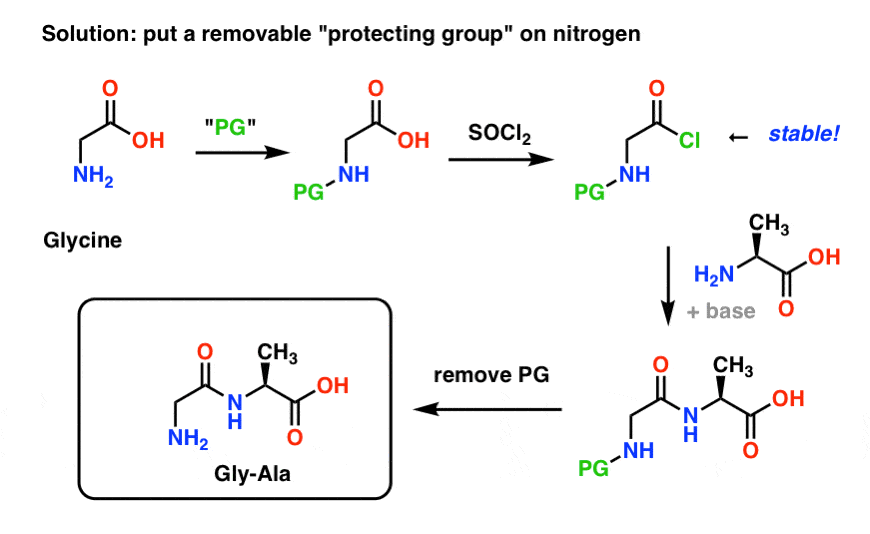
En beskyttelsesgruppestrategi for nitrogen, som vi allerede har udforsket, er Gabriel-syntesen, som anvender phthalimid (man kan tænke på et phthalimid som et beskyttet nitrogen). Dette er faktisk blevet brugt til at syntetisere Gly-Gly (“glycylglycine”) ! Et af problemerne er imidlertid, at der kræves relativt barske forhold (rigelig varme) for både at installere og fjerne phthalimidgruppen, og dette er ikke et særlig sundt miljø for overlevelsen af følsomme, chirale aminosyrer, som let kan racemiseres.
Et andet potentielt valg er at beskytte nitrogenet som et amid, men spaltningsamider kan også kræve barske forhold. Da vi desuden alligevel forsøger at smede en amidbinding (peptid) her, kan vi få selektivitetsproblemer ved at fjerne den – ødelægge landsbyen for at redde den.
Mate! Brug en carbamat, makker!
Det mest populære valg af beskyttelsesgruppe for amin kvælstof er den funktionelle carbamatgruppe. En carbamat ligner et uægte barn af en ester og et amid, hvor N og O flankerer en carbonyl.
Nitrogenet i en carbamat er relativt ikke-nukleofilt, og desuden er carbamater:
- let at installere på nitrogen
- inert over for en lang række reaktionsbetingelser
- let at fjerne uden at påvirke eksisterende amidgrupper
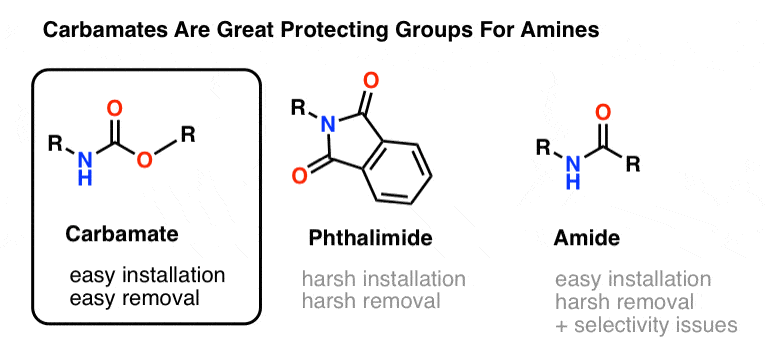
Det gør dem perfekte til vores formål.
Boc og CBz er biernes knæ
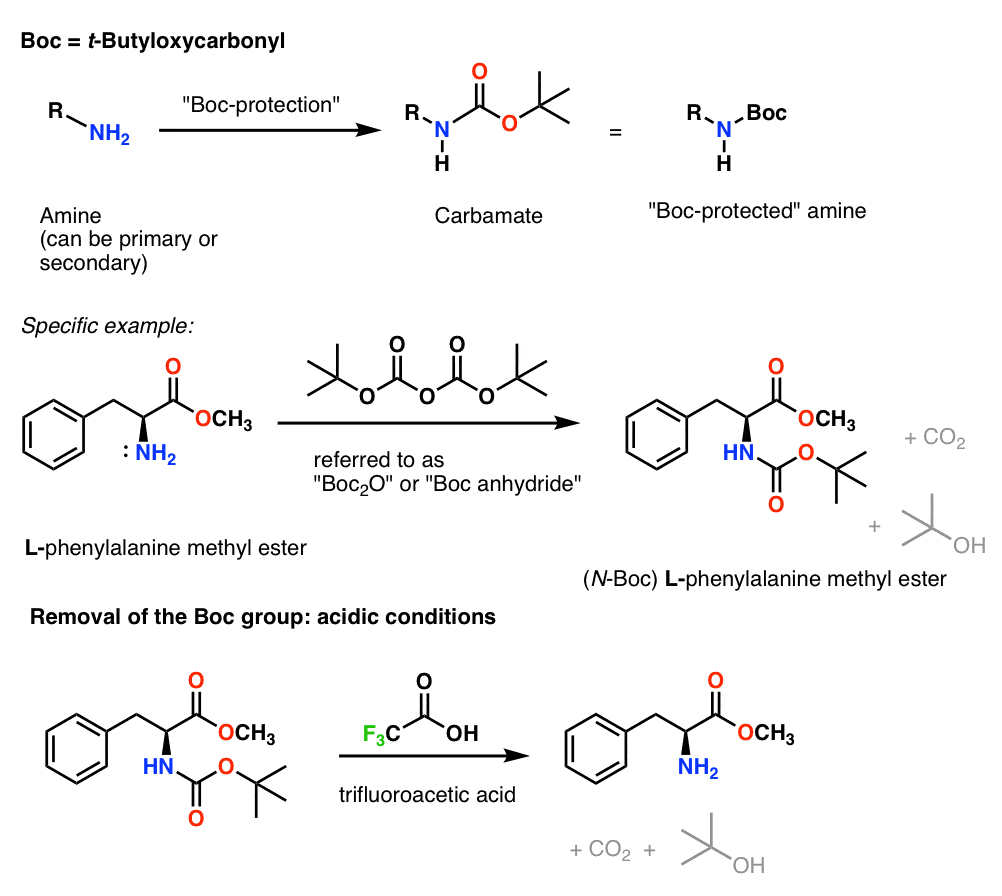
To populære carbamatbeskyttelsesgrupper er Boc (t-butyloxycarbonyl) og CBz (carboxybenzyl).
For vores formål kan disse to beskyttelsesgrupper betragtes som mere eller mindre ækvivalente, da de begge kan anvendes effektivt til peptidsyntese.
Den væsentligste forskel ligger i virkeligheden i, hvordan de fjernes (dvs. “deprotektionstrinnet”). Valget mellem det ene eller det andet bliver afgørende, når man har et komplekst molekyle med flere beskyttelsesgrupper; det falder ind under kategorien “avanceret syntetisk strategi”, som er mere et emne for Org 3.
Installation og fjernelse af “Boc”-beskyttelsesgruppen
Boc-gruppen installeres normalt med “Boc2O” (undertiden benævnt “Boc-anhydrid”) og fjernes med syre. Det sædvanlige valg er “ren” (dvs. ufortyndet) trifluoreddikesyre (TFA), som sprænger Boc-grupperne meget rent og frigør CO2 og t-butylalkohol.
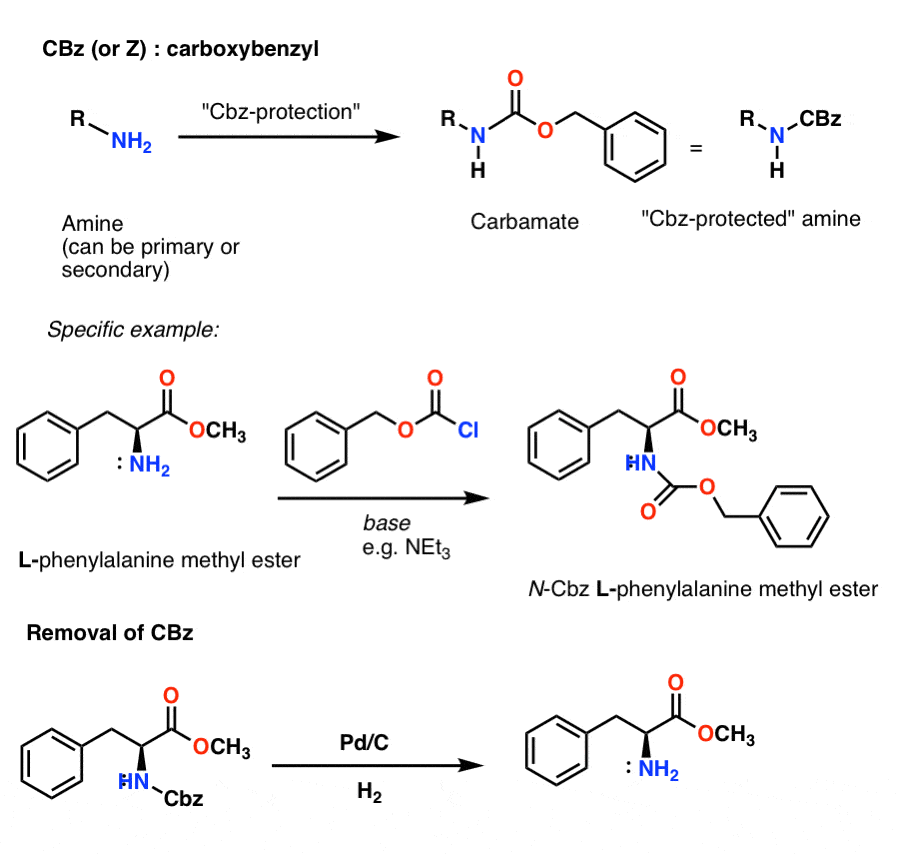
Installation og fjernelse af CBz (eller “Z”) carbamatbeskyttelsesgruppen
Cbz-gruppen (undertiden yderligere forkortet som “Z”) kan installeres med CbzCl og mild base, og fjernes normalt via katalytisk hydrogenering (Pd-C/H2). Dette er ekstremt mildt og har den fordel, at det sker ved neutral pH-værdi, hvorved syre- eller basefølsomme funktionelle grupper forbliver uberørte.
En simpel peptidsyntese ved hjælp af carbamatbeskyttelsesgrupper
Lad os gå tilbage til peptidsyntese og anvende denne beskyttelsesgruppestrategi til at fremstille Gly-Ala.
Vi starter med en aminosyre som L-alanin. Ved at behandle alanin med Boc2O får vi N-Boc-beskyttet L-alanin. Det næste trin er at danne et syrechlorid ved hjælp af SOCl2. Når det er dannet, tilføjer vi derefter vores amin (f.eks. L-valin) i tilstedeværelse af overskydende base, hvorved vi danner vores nøgleamidbinding. Det sidste trin for at opnå dipeptidet er at afprotektere den Boc-beskyttede amin med trifluoroeddikesyre (TFA), og voila! vi har vores dipeptid.
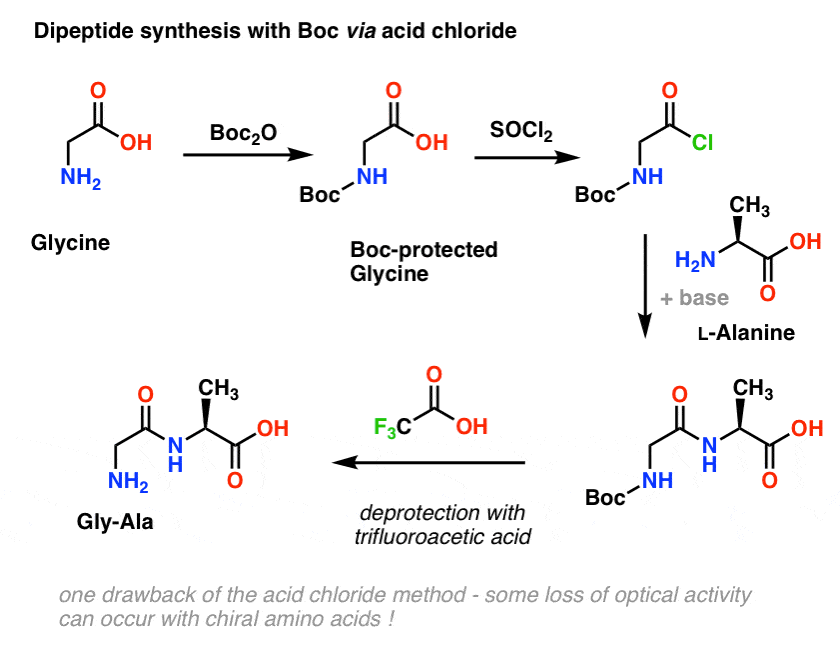
Og selv om denne metode kan være god på papiret, er et problem ved anvendelse af syreklorider i praksis, at chirale aminosyrer ofte mister deres optiske renhed gennem denne metode, en proces, der undertiden kaldes “racemisering”, men mere korrekt kaldet “epimerisering” (teknisk set mere korrekt, fordi et hydrogen på et chiralt center er omvendt)
Da aminosyrernes chiralitet er afgørende for deres biologiske funktion, anvendes generelt en lidt mildere protokol, der anvender DCC eller et lignende koblingsreagens.
Her behandler vi Boc-beskyttet glycin med DCC for at aktivere carboxylsyren. Derefter tilsætter vi vores aminosyre-nukleofil (L-alanin), som danner dipeptidet. Hvis vi ønsker at isolere Gly-Ala-dipeptidet på dette tidspunkt, kan vi derefter fjerne Boc-gruppen med TFA.
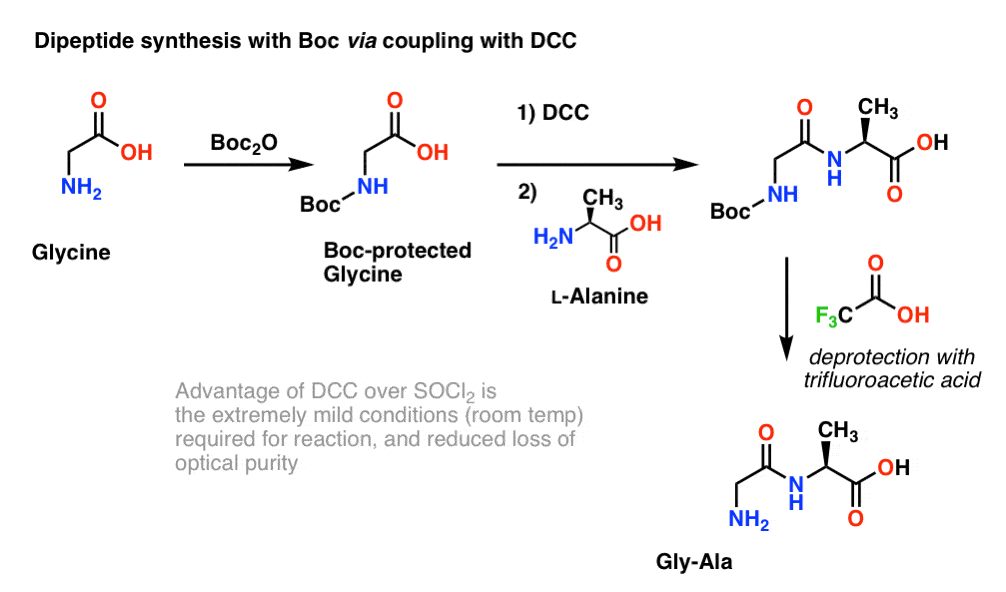
(note om dette skema)
Det bliver ved…
Bemærk, at hvis vi ønskede at lave et tri-peptid, kan vi bare blive ved med at udføre cyklusser med tilsætning af DCC (for at aktivere carboxylsyren) efterfulgt af tilsætning af nye aminosyrer, hvorved vi opbygger peptidet en enhed ad gangen!
Der findes en særlig effektiv metode til opbygning af længere peptider, som Bruce Merrifield har været pioner på (og som bl.a. er anvendt til syntese af insulin), kaldet fastfase-peptidsyntese, som vi vil behandle næste gang, vi er inde på dette emne.
Noter
Note 1. Svarer til den gamle vittighed om økonomen, der foreslår en plan for at komme væk fra en øde ø:
“Antag, at vi har en båd”.
Glycin (som alle aminosyrer) er i sig selv en zwitterion. Behandling af glycin med SOCl2 skulle give syrekloridet med en protoneret amin. Dette skulle være relativt stabilt i opløsning, så længe der ikke tilsættes base.
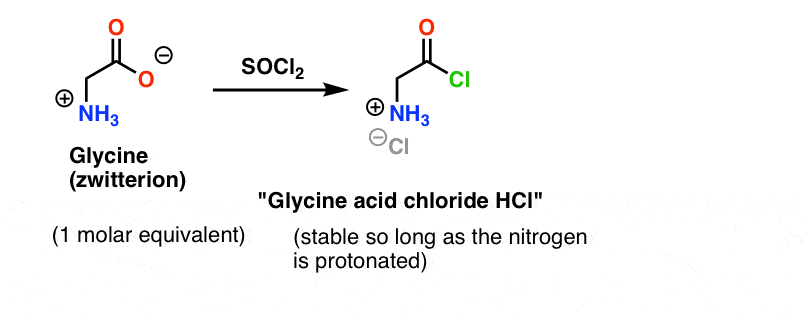
Her er problemet. Da vores aminosyre-nukleofil (alanin) også er zwitterionisk, kan der ikke ske nogen reaktion, før der tilsættes et overskud af base for at frigøre et lonepar på alaninnitrogenet. Efter tilsætning af base har vi “glycinsyrechlorid” og alanin sammen i opløsning. Der er ingen nævneværdig forskel i nukleofilitet mellem nitrogenerne i disse to arter, og hver af dem vil konkurrere om at reagere med syrechlorid-nukleofilen, hvilket fører til en blanding af Gly-Ala og Gly-GlyCl, og Gly-GlyCl kan derefter reagere yderligere med de forskellige nukleofile stoffer, der er forudindstillet i opløsningen, for at give tri-, tetra- og højere peptider.
Note 2. John Sheehan, som vi tidligere har mødt som opfinder af DCC på vej til den første til at syntetisere penicillin, fremstillede også phthalylbeskyttet Gly-Gly gennem en Gabriel-syntese:
Reference her (JACS, 1949, 71, 1856)
Note 3. Et andet problem ved anvendelse af amidbeskyttelsesgrupper er azlactondannelse, som kan føre til epimerisering af chirale aminosyrer. Se også dette opgavesæt.
Note 4. “Ortogonale beskyttelsesgrupper”. I syntetisk planlægning er det ofte af afgørende betydning at have beskyttelsesgrupper, der kan fjernes under klart forskellige betingelser. Denne egenskab kaldes ofte “ortogonalitet”
For eksempel har vi i det følgende dipeptid to forskellige beskyttelsesgrupper på nitrogen – en Boc- og en CBz-gruppe. Ved at vælge “ortogonale” beskyttelsesgrupper kan hvert nitrogen angribes – vi kan vælge, hvilken beskyttelsesgruppe vi vil fjerne, og vores syntese kan fortsætte derfra. Derved undgår vi at komme i en situation, hvor vi har to ubeskyttede aminer og er nødt til at stole på, at den ene er mere reaktiv end den anden. Disse fremgangsmåder virker meget sjældent!
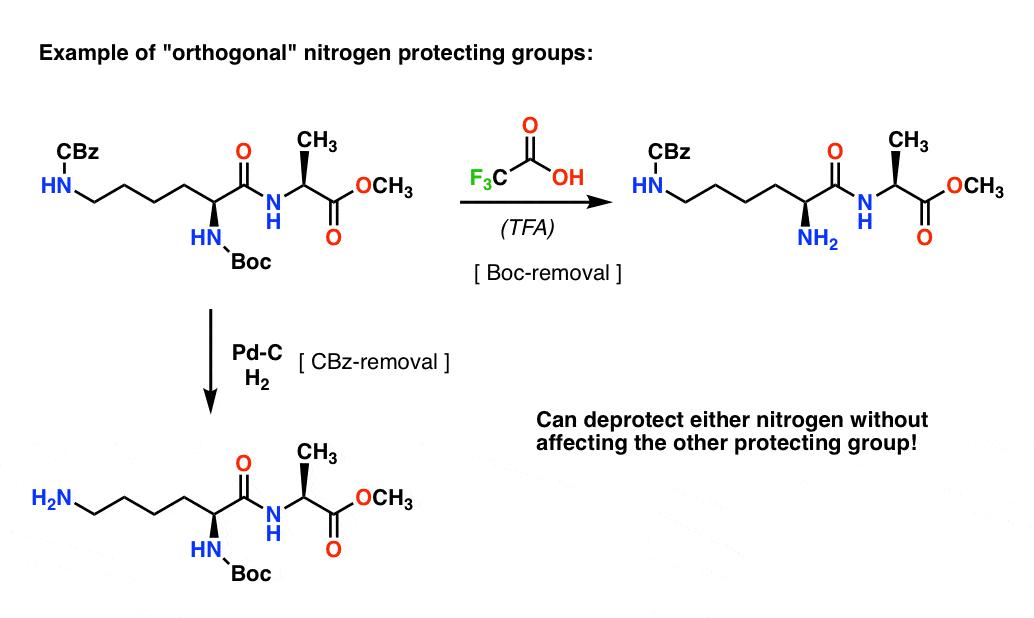
En bemærkning – for enkelhedens skyld er alanin her afbildet med en fri carboxylsyre, men en lidt bedre fremgangsmåde ville være at bruge methylester af alanin for at undgå enhver selvkobling mellem alanins frie amin og den frie carboxylsyre.
Mate…
(Avanceret) Referencer og videre læsning
Carbamater er nyttige som beskyttelsesgrupper for aminer, og de mest almindeligt anvendte er -Boc, -Cbz og -Fmoc.
- Über ein allgemeines Verfahren der Peptid-Synthese
Max Bergmann og Leonidas Zervas
Ber. 1932, 65 (7), 1192-1201
DOI: 10.1002/cber.19320650722
Cbz (carboxybenzyl)-beskyttelsesgruppen blev først anvendt af Max Bergmann og Leonidas Zervas i 1932 til syntese af peptider, og den forkortes undertiden “-Z” til ære for Zervas. - FJERNELSE AF t-BUTYL- OG t-BUTOXYCARBONYLSKYDNINGSGRUPPER MED TRIFLUOROACETIC ACID
Mekanismer, biproduktdannelse og evaluering af opløsningsmidler
Behrend F. Lundt, Nils L. Johansen, Aage Vølund og Jan Markussen
J. Pept. Prot. Res. 1978, 12 (5), 258-268
DOI: 10.1111/j.1399-3011.1978.tb02896.x
I praksis tilsættes nukleofile scavengers (f.eks. thioler) normalt til syrecocktailen (TFA) ved deprotektion, da deprotektion af Boc vil give elektrofilt t-butylarter (f.eks. t-butyltrifluoroacetat), der kan reagere med følsomme rester (f.eks. Trp eller Cys). - A Method of Synthesis of Long Peptide Chains Using a Synthesis of Oxytocin as a Example
Miklos Bodanszky and Vincent du Vigneaud
Journal of the American Chemical Society 1959, 81 (21), 5688-5691
DOI: 1021/ja0153030a040
I første halvdel af det 20. århundrede blev peptidsyntesen udført ved hjælp af standardiserede opløsningsfaseteknikker inden for organisk kemi. Dette er nu kendt som LPPS (liquid-phase peptide synthesis). du Vigneaud modtog Nobelprisen i kemi i 1955 for sit arbejde med at vise, at det var muligt at opnå peptidsyntese ved hjælp af det korrekte valg af beskyttelsesgrupper og syntetiske strategier. - DEN TEMPORÆRE FORMATION AF AZLACTON-RINGEN VED RACEMISERING AF ACYLDERIVATIVER AF AMINOACIDER MED ACETISK ANHYDRID
Vincent du Vigneaud og Curtis E. Meyer
Biol. Chem. 1932, 99:143-151
http://www.jbc.org/content/99/1/143.citation
Et andet problem ved anvendelse af amidbeskyttelsesgrupper er azlactondannelse, som kan føre til epimerisering af chirale aminosyrer. - En ny syntetisk rute til peptider
John C. Sheehan og Victor S. Frank
Journal of the American Chemical Society 1949, 71 (5), 1856-1861
DOI: 10.1021/ja0101173a095
John Sheehan, opfinderen af DCC på vej til den første syntese af penicillin, fremstillede også phthalylbeskyttet Gly-Gly gennem en Gabriel-syntese. - En ny metode til dannelse af peptidbindinger
John C. Sheehan og George P. Hess
Journal of the American Chemical Society 1955, 77 (4), 1067-1068
DOI: 1021/ja01609a099
Originalartikel om syntese af peptidbindinger/amidbindinger ved hjælp af DCC. - 9-Fluorenylmethoxycarbonylfunktion, en ny basefølsom aminobeskyttelsesgruppe
Louis A. Carpino og Grace Y. Han
Journal of the American Chemical Society 1970, 92 (19), 5748-5749
DOI: 10.1021/ja00722a043 - 9-Fluorenylmethoxycarbonyl aminobeskyttelsesgruppe
Louis A. Carpino og Grace Y. Han
The Journal of Organic Chemistry 1972 37 (22), 3404-3409
DOI: 10.1021/jo00795a005
Den opdagelse og udvikling af -Fmoc-beskyttelsesgruppen for aminer tilføjer endnu et lag ortogonalitet til strategierne for beskyttelse/beskyttelse af aminer. -Fmoc-gruppen er baselabilt og fjernes i peptidsyntesen typisk med 20% piperidin i DMF. Cbz fjernes ved hydrogenering, -Boc fjernes med syre, og -Fmoc med base.