T-regulatoriske celler (Tregs), tidligere kendt som T-suppressorceller, er en delmængde af T-celler med direkte roller i både autoimmunitet og respons på patogener.
Tregs mindsker inflammation via sekretion af immunosuppressive cytokiner (IL-10, TGF-b) og også via direkte undertrykkelse af inflammatoriske effektor-T-celler (såsom Th1- og Th17-celler).
Tregs kontrollerer og forebygger sandsynligvis autoimmune sygdomme ved at bidrage til opretholdelse af tolerance over for selvantigener. Den terapeutiske fordel ved Treg-overførsel er veletableret i dyremodeller, og der er bestræbelser på at påbegynde menneskelige Treg-behandlinger i gang med henblik på transplantation og patienter med type 1-diabetes.
I betragtning af betydningen af denne unikke T-celleundergruppe i så mange immunresponser føler mange investigatorer sig forsømmelige, hvis de immunofænotype deres cellepopulationer af interesse uden at inkludere en Treg-måling i blandingen. Men det kan være kompliceret at kvantificere Tregs.
For eksempel – Hvad er de bedste markører at bruge? Hvordan ved man med sikkerhed, at man måler ægte suppressor-T-celler?
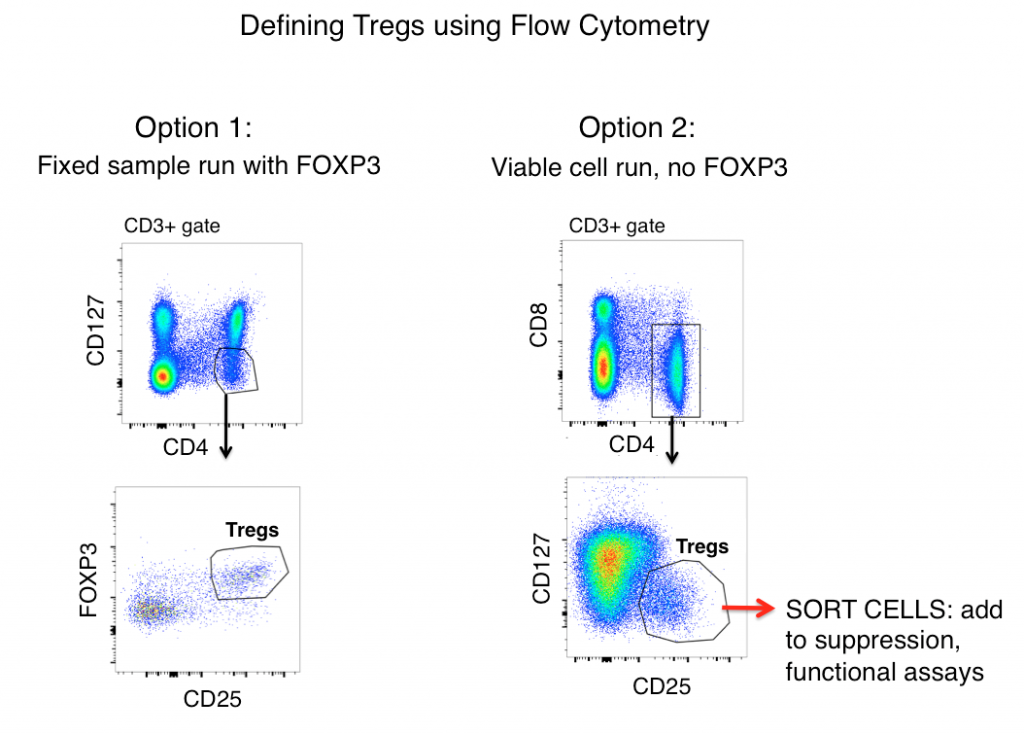
Gatingstrategier til definition af Tregs ved flowcytometri
Standard Treg-gatingstrategien for både muse- og menneskeprøver (efter først at have gateret doublets ud og gateret på levende celler) omfatter antigenerne CD3, CD4, CD25, FOXP3 og CD127.
Når man udelukkende ser på antigenekspression, defineres Tregs ofte som CD3+, CD4+, CD25hi, FOXP3+ og CD127lo (vist i figuren nedenfor som mulighed 1). Ved hjælp af disse markører kan der ofte ses en klar population fra prøver som f.eks. musesplenocytter og humane PBMC.
Men aktiverede T-celler opregulerer ofte CD25, og FOXP3-ekspression er blevet fundet på “effektor”- (ikke-suppressive) T-celle-linjer. Derfor kan inflammatoriske T-celler, når man alene stoler på flowcytometrisk fænotyping til at definere Tregs, være en ulv i fåreklæder (Treg) og føre til ukorrekt datatolkning.
En celle ligner måske en and, men kvækker den? Måling af effektorfunktionerne i din mulige Treg-population vil i høj grad bidrage til at belyse nøjagtigheden af din flow gating-strategi. For at fastslå, om de celler, du definerer som Tregs, funktionelt ligner dem, omfatter mulighed 2 (se nedenfor) udeladelse af FOXP3 fra dit panel, sortering af CD3+, CD4+, CD25hi, CD127lo-celler og derefter bestemmelse af funktionerne i din “Treg”-population via cytokinanalyse og/eller undertrykkelsesko-kulturassager med ikke-Treg-T-celler (CD3+ CD4+ CD25-, CD127hi). FOXP3 kan typisk ikke indgå i paneler, hvor der kræves levedygtige celler efter sortering, da intracellulær farvning er påkrævet.
Definering af den stigende variation af Treg-undergrupper
Der findes mange varianter af Tregs, herunder tTregs, pTregs og iTregs.
For eksempel genereres tTregs (også kendt som nTregs) i thymus og har et TcR-repertoire, der er forudindtaget mod selvpeptider. En anden smag, kendt som pTregs, genereres i periferien, og iTregs induceres i kultur via TGF-b.
Der er makere forbundet med disse forskellige Treg-undergrupper, og de bør overvejes til medtagelse i et Treg-antistofpanel, hvis subsetting af dem er af interesse. For eksempel anses CD39 hos mennesker for at være en pålidelig tTreg-markør. Desuden har Helios i både mus og mennesker vist sig at kunne skelne tTregs pålideligt fra p- og iTreg-undergrupperne.
Definering af en enkelt celle som en Treg – er det muligt?
En væsentlig begrænsning på Treg-området er manglen på et enkeltcelle-suppressionsassay.
Definering af en individuel T-celle som medlem af en særskilt hukommelseslinje, såsom Th1, Th2 eller Th17, kan opnås via analyseanalyse med enkeltcelleopløsning, såsom intracellulær cytokinfarvning, da disse celler primært, hvis ikke udelukkende, defineres ved de cytokiner, de producerer.
For at vise, at en enkelt celle er en Treg-celle, ønsker vi imidlertid ideelt set at kunne kvantificere, at denne ene udvalgte celle kan undertrykke funktionen af effektor-T-celler (eller andre celleundergrupper) i samdyrkning. I øjeblikket er den eneste måde at teste Treg-suppressiv funktion på i en bulkkultur, hvor man kan konkludere, at nogle (men ikke alle, muligvis ikke engang de fleste) af de celler, der betegnes som Tregs, er suppressive.
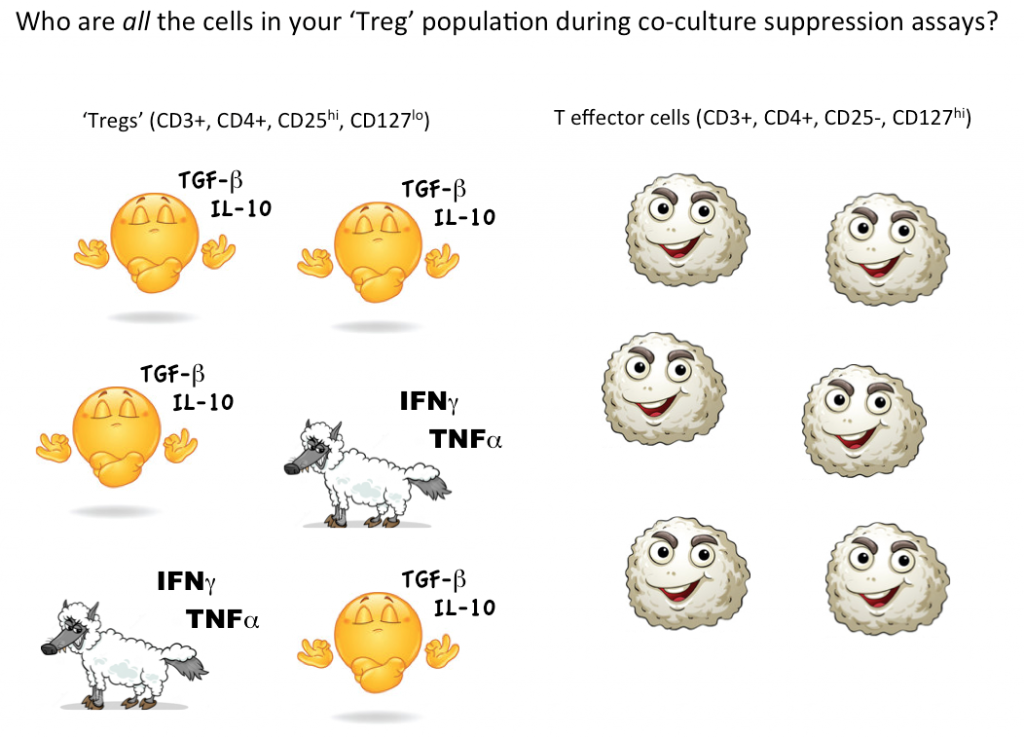
Tænker vi igen på de potentielle “effektor-T-celle”-ulve i fåreklæder, ved vi simpelthen ikke, hvor mange ikke-suppressive, endda inflammatoriske celler der gemmer sig i vores Treg-gating-strategi. Anvendelse af flowcytometri til først at gate på og sortere levedygtige celler med markører, der er i overensstemmelse med Tregs, og derefter funktionel testning for at se, om de celler, der er defineret ved din gating-strategi, som gruppe faktisk opfører sig som Tregs, er i øjeblikket den bedste måde at kvantificere Tregs i din prøve.
Gennem at udføre de rigtige gating-strategier til at definere Tregs ved flowcytometri og tage højde for det voksende antal Treg-undergrupper, kan du udpege dine Treg-populationer af interesse. Nøglen er at teste disse populationer funktionelt efter at have identificeret dem, fordi det i øjeblikket er vanskeligt, hvis ikke umuligt, at definere en enkelt celle som en Treg. Der gøres dog dagligt fremskridt, og i sidste ende vil det være muligt at mærke enkelte Treg-celler korrekt.
For at lære mere om analyse af T-celler og andre celletyper ved hjælp af flowcytometri og for at få adgang til alle vores avancerede materialer, herunder 20 uddannelsesvideoer, præsentationer, arbejdsbøger og privat gruppemedlemskab, skal du skrive dig på ventelisten til Flow Cytometry Mastery Class.
