Generisk navn: naftifine hydrochloride
Doseringsform: creme
Medicinsk gennemgået af Drugs.com. Sidst opdateret den 1. jan. 2021.
- Overblik
- Bivirkninger
- Bivirkninger
- Dosering
- Professionel
- Graviditet
- Mere
Indikationer og anvendelse for Naftifine Cream
Naftifine hydrochlorid creme er indiceret til behandling af interdigital tinea pedis, tinea cruris og tinea corporis forårsaget af organismen Trichophyton rubrum.
Naftifincreme Dosering og administration
Kun til lokal brug. Naftifinhydrochloridcreme er ikke til oftalmisk, oral eller intravaginal brug. Påfør et tyndt lag naftifinhydrochloridcreme en gang dagligt på de angrebne områder plus en ½ tomme margen af sund, omgivende hud i 2 uger.
Doseringsformer og styrke
På hvert gram er der 20 mg naftifinhydrochlorid (2%) i en hvid til offwhite base.
Kontraindikationer
Ingen
Varsler og forholdsregler
Lokale bivirkninger
Underbryd behandlingen, hvis der udvikles irritation eller følsomhed ved brug af naftifinhydrochloridcreme. Anvis patienterne til at kontakte deres læge, hvis disse tilstande udvikler sig efter brug af naftifinhydrochloridcreme.
Bivirkninger
Erfaringer fra kliniske forsøg
Da kliniske forsøg udføres under meget varierende forhold, kan bivirkningsrater observeret i kliniske forsøg med et lægemiddel ikke direkte sammenlignes med rater i kliniske forsøg med et andet lægemiddel og afspejler muligvis ikke de rater, der observeres i klinisk praksis.
I de kliniske forsøg blev 903 forsøgspersoner udsat for naftifin 1% og 2% cremeformuleringer. I alt 564 forsøgspersoner med interdigital tinea pedis, tinea cruris eller tinea corporis blev behandlet med naftifinhydrochloridcreme.
I to randomiserede, vehicle-kontrollerede forsøg (400 forsøgspersoner blev behandlet med naftifinhydrochloridcreme). Populationen var 12 til 88 år gammel, primært mandlig (79 %), 48 % kaukasisk, 36 % sort eller afroamerikansk, 40 % latinamerikansk eller latinamerikansk, og havde enten overvejende interdigital tinea pedis eller tinea cruris. De fleste forsøgspersoner fik doser en gang dagligt, topisk, i 2 uger for at dække de angrebne hudområder plus en ½ tomme margen af den omkringliggende sunde hud. I de to vehikel-kontrollerede forsøg oplevede 17,5 % af de naftifinhydrochloridcreme-behandlede forsøgspersoner en bivirkning sammenlignet med 19,3 % af de vehikel-behandlede forsøgspersoner. Den mest almindelige bivirkning (større end eller lig med 1 %) er pruritus. De fleste bivirkninger var lette i sværhedsgrad. Incidensen af bivirkninger i den naftifinhydrochloridcreme-behandlede population var ikke signifikant forskellig fra den vehicle-behandlede population.
I et tredje randomiseret, vehicle-kontrolleret forsøg blev 116 pædiatriske forsøgspersoner med tinea corporis behandlet med naftifinhydrochloridcreme. Populationen var i alderen over eller lig med 2 år til under 18 år (gennemsnitsalder 9 år), overvejende mandlige (61 %), 47 % hvide, 51 % sorte eller afroamerikanske, 92 % latinamerikanske eller latinamerikanske og inficeret med tinea corporis. Naftifine hydrochlorid-creme blev topisk påført en gang dagligt i 2 uger på alle angrebne kropsoverflader med tinea corporis plus en ½ tomme margen af sund hud omkring de angrebne læsioner. Forekomsten af bivirkninger i den naftifinhydrochloridcreme-behandlede population var ikke signifikant forskellig fra den vehicle-behandlede population.
I to åbne pædiatriske farmakokinetik- og sikkerhedsforsøg modtog 49 pædiatriske forsøgspersoner i alderen 2 til under 18 år med interdigital tinea pedis, tinea cruris og tinea corporis naftifinhydrochloridcreme. Incidensen af bivirkninger i den pædiatriske population svarede til den, der blev observeret i den voksne population.
Erfaring efter markedsføring
Følgende bivirkninger er blevet identificeret under anvendelse af naftifinhydrochlorid efter godkendelsen: rødme/irritation, inflammation, maceration, hævelse, svie, svie, blærer, serøst afløb, skorpedannelse, hovedpine, svimmelhed, leukopeni, agranulocytose.
Da disse reaktioner rapporteres frivilligt fra en population af usikker størrelse, er det ikke altid muligt at foretage et pålideligt skøn over deres hyppighed eller at fastslå en årsagssammenhæng med lægemiddeleksponeringen.
BRUG I SPECIFIKKE POPULATIONER
Graviditet
Risiko-resumé
Der er ingen tilgængelige data med naftifinhydrochloridcreme hos gravide kvinder til at informere om den lægemiddelrelaterede risiko for større fødselsdefekter og abort. I reproduktionsstudier på dyr blev der ikke set nogen skadelige virkninger på fosterudviklingen ved orale doser administreret i organogeneseperioden op til 18 gange den maksimale anbefalede humane dosis (MRHD) hos drægtige rotter eller subkutane doser administreret i organogeneseperioden op til 2 gange MRHD hos drægtige rotter eller 4 gange MRHD hos drægtige kaniner .
Den estimerede baggrundsrisiko for større fødselsdefekter og abort for den angivne population er ukendt. Alle graviditeter har en baggrundsrisiko for fødselsdefekter, tab eller andre uønskede resultater. I den generelle befolkning i USA er den estimerede baggrundsrisiko for større fødselsdefekter og abort i klinisk anerkendte graviditeter henholdsvis 2 % til 4 % og 15 % til 20 %.
Data
Data om dyr
Der er udført undersøgelser af systemisk embryofetal udvikling i rotter og kaniner. Til sammenligning af doser fra dyr til mennesker baseret på sammenligning af kropsoverfladeareal (mg/m2) er MRHD fastsat til 8 g 2% creme pr. dag (2,67 mg/kg/dag for et individ på 60 kg).
Orale doser på 30, 100 og 300 mg/kg/dag naftifinhydrochlorid blev administreret i organogeneseperioden til drægtige hunrotter. Der blev ikke konstateret nogen behandlingsrelaterede virkninger på fosterudviklingen ved doser op til 300 mg/kg/dag (18 gange MRHD). Subkutane doser på 10 og 30 mg/kg/dag naftifinhydrochlorid blev indgivet i organogeneseperioden til drægtige hunrotter. Der blev ikke konstateret nogen behandlingsrelaterede virkninger på fosterudviklingen ved 30 mg/kg/dag (2 gange MRHD). Subkutane doser på 3, 10 og 30 mg/kg/dag naftifinhydrochlorid blev indgivet i organogeneseperioden til drægtige hunkaniner. Der blev ikke konstateret nogen behandlingsrelaterede virkninger på fosterudviklingen ved 30 mg/kg/dag (4 gange MRHD).
Der blev foretaget en undersøgelse af peri- og postnatal udvikling hos rotter. Orale doser på 30, 100 og 300 mg/kg/dag naftifinhydrochlorid blev administreret til hunrotter fra gestationsdag 14 til amningsdag 21. Ved 300 mg/kg/dag (18 gange MRHD) blev der konstateret nedsat tilvækst af kropsvægt hos hunnerne i drægtighedsperioden og hos afkommet i laktationsperioden. Der blev ikke konstateret udviklingstoksicitet ved 100 mg/kg/dag (6 gange MRHD).
Aldring
Risikoresumé
Der foreligger ingen oplysninger om tilstedeværelsen af naftifinhydrochloridcreme i modermælk, om lægemidlets virkninger på det ammede spædbarn eller om lægemidlets virkninger på mælkeproduktionen. Manglen på kliniske data under amning udelukker en klar bestemmelse af risikoen ved naftifinhydrochloridcreme for et spædbarn under amning; derfor bør udviklingen og de sundhedsmæssige fordele ved amning overvejes sammen med moderens kliniske behov for naftifinhydrochloridcreme og eventuelle potentielle bivirkninger på det ammede spædbarn fra naftifinhydrochloridcreme eller fra den underliggende moderlige tilstand.
Pædiatrisk brug
Sikkerheden og effektiviteten af naftifinhydrochloridcreme er blevet fastslået hos pædiatriske patienter i alderen 12 år og derover med interdigital tinea pedis og tinea cruris og i alderen 2 år og derover med tinea corporis .
Anvendelse af naftifinhydrochloridcreme i disse aldersgrupper understøttes af dokumentation fra tilstrækkelige og velkontrollerede undersøgelser hos voksne og børn, med yderligere sikkerheds- og PK-data fra to åbne forsøg udført på 49 pædiatriske forsøgspersoner, der blev eksponeret for naftifinhydrochloridcreme .
Sikkerheden og effektiviteten af naftifinhydrochloridcreme til behandling af tinea cruris og interdigital tinea pedis hos pædiatriske patienter under 12 år er ikke blevet fastslået. Sikkerhed og effektivitet af naftifinhydrochloridcreme til behandling af tinea corporis hos pædiatriske patienter under 2 år er ikke blevet fastslået.
Geriatrisk brug
Kliniske undersøgelser af naftifinhydrochloridcreme omfattede ikke et tilstrækkeligt antal forsøgspersoner på 65 år og derover til at afgøre, om de reagerer anderledes end yngre forsøgspersoner.
Naftifincreme Beskrivelse
Naftifinhydrochloridcreme, USP er en hvid til offwhite creme udelukkende til lokal brug. Hvert gram indeholder 20 mg naftifinhydrochlorid, USP, (2 %), en syntetisk allylamin-svampedræbende forbindelse.
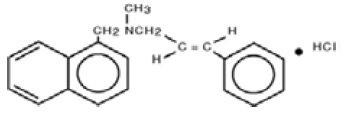
Kemisk set er naftifin HCl (E)-N-Cinnamyl-N-methyl-1-napthalenemethylaminhydrochlorid.
Molekylformlen er C21H21N-HCl med en molekylvægt på 323,86.
Strukturformlen for naftifinhydrochlorid, USP er:
Naftifinhydrochloridcreme, USP indeholder følgende inaktive ingredienser: benzylalkohol, cetylalkohol, cetylestervoks, isopropylmyristat, polysorbat 60, renset vand, natriumhydroxid, sorbitanmonostearat og stearylalkohol. Der kan tilsættes saltsyre for at justere pH-værdien.
Naftifincreme – Klinisk farmakologi
Virkningsmekanisme
Naftifinhydrochloridcreme er et aktuelt svampedræbende lægemiddel .
Farmakodynamik
Farmakodynamikken af naftifinhydrochloridcreme er ikke blevet fastlagt.
Farmakokinetik
In vitro- og in vivo-undersøgelser af biotilgængelighed har vist, at naftifin trænger ind i stratum corneum i tilstrækkelig koncentration til at hæmme væksten af dermatofytter.
Farmakokinetikken af naftifinhydrochloridcreme blev evalueret efter topisk anvendelse én gang dagligt i 2 uger på 21 voksne forsøgspersoner, både mænd og kvinder, med både tinea pedis og tinea cruris. Medianen af den samlede mængde creme, der blev påført, var 6,4 g (interval 5,3 g til 7,5 g) pr. dag. Resultaterne viste, at den systemiske eksponering (dvs. maksimal koncentration (Cmax) og arealet under kurven fra tid 0 til 24 timer (AUC0-24) for naftifin steg i løbet af den 2 ugers behandlingsperiode hos alle de 21 forsøgspersoner. Det geometriske gennemsnit (variationskoefficient eller CV%) af AUC0-24 var 117 (41,2) ng*hr/mL på dag 1 og 204 (28,5) ng*hr/mL på dag 14. Geometrisk gennemsnit (CV %) Cmax var 7 ng/mL (55,6) på dag 1 og 11 ng/mL (29,3) på dag 14. Mediantiden til Cmax (Tmax) var 8 timer (interval 4 til 24 timer) på dag 1 og 6 timer (interval 0 til 16 timer) på dag 14. Akkumulation efter 14 dages topisk anvendelse var mindre end to gange. Trough-koncentrationerne steg generelt i løbet af den 14-dages undersøgelsesperiode. Naftifin blev fortsat påvist i plasma hos 13/21 (62 %) forsøgspersoner på dag 28. De gennemsnitlige (standardafvigelse eller SD) plasmakoncentrationer var 1,6 ± 0,5 ng/mL (interval under kvantificeringsgrænsen (BLQ) til 3 ng/mL). I det samme farmakokinetiske forsøg udført hos patienter med tinea pedis og tinea cruris var den mediane fraktion af dosis, der blev udskilt i urinen i behandlingsperioden, 0,0016 % på dag 1 mod 0,0020 % på dag 14.
I et andet forsøg, der omfattede 22 forsøgspersoner, blev farmakokinetikken af naftifinhydrochloridcreme evalueret hos 20 pædiatriske forsøgspersoner i alderen 13 til mindre end 18 år med både tinea pedis og tinea cruris. Forsøgspersonerne blev behandlet med en median dosis på 8,1 g (interval 6,6 g til 10,1 g) påført på de berørte områder en gang dagligt i 2 uger. Resultaterne viste, at den systemiske eksponering steg i løbet af behandlingsperioden. Geometrisk gennemsnit (CV%) AUC0-24 var 138 (50,2) ng*hr/mL på dag 1 og 192 (74,9) ng*hr/mL på dag 14. Geometrisk gennemsnit (CV %) Cmax var 9,21 ng/mL (48,4) på dag 1 og 12,7 ng/mL (67,2) på dag 14. Medianfraktionen af den dosis, der blev udskilt i urinen i behandlingsperioden, var 0,0030 % på dag 1 og 0,0033 % på dag 14.
Et tredje forsøg evaluerede farmakokinetikken af naftifinhydrochloridcreme hos 27 pædiatriske forsøgspersoner i alderen 2 til mindre end 12 år med mindst moderat tinea corporis. Forsøgspersonerne blev opdelt i yngre (2 til mindre end 6 år, 17 forsøgspersoner) og ældre (6 til mindre end 12 år, 10 forsøgspersoner) grupper. Median doser på 1,3 g (interval 1 g til 3,1 g) og 2,3 g (interval 2,2 g til 4,2 g) blev påført en gang dagligt i 2 uger i henholdsvis den yngre og den ældre gruppe på det angrebne område plus en ½ tomme margin. Plasma- og urinfarmakokinetiske vurderinger blev foretaget på dag 1 kun i den ældre gruppe og på dag 14 i begge grupper. Alle forsøgspersoner viste målbare niveauer af naftifin i plasma efter topisk påføring af naftifinhydrochloridcreme. Efter en enkelt dosis på dag 1 hos forsøgspersoner i alderen 6 til under 12 år var de geometriske middelværdier (CV%) af Cmax og AUC0-24 henholdsvis 3,60 (76,6) ng/mL og 49,8 (64,4) ng*h/mL. På dag 14 i denne gruppe var Cmax og AUC0-24 henholdsvis 3,31 (51,2) ng/mL og 52,4 (49,2) ng*h/mL på dag 14 i denne gruppe. Hos forsøgspersoner i alderen 2 til under 6 år var Cmax og AUC0-24 på dag 14 henholdsvis 3,98 (186) ng/mL og 54,8 (150) ng*h/mL. I den ældre gruppe af forsøgspersoner i alderen 6 til 12 år var de systemiske eksponeringer (både Cmax og AUC0-24) på dag 1 og 14 sammenlignelige. Medianfraktionen af den dosis, der blev udskilt i urinen i løbet af 24 timer efter lægemiddelanvendelse på henholdsvis dag 1 og dag 14, var 0,0029 % og 0,0014 %.
Mikrobiologi
Selv om den nøjagtige virkningsmekanisme mod svampe ikke er kendt, synes naftifinhydrochlorid at forstyrre sterolbiosyntesen ved at hæmme enzymet squalen2, 3-epoxidase.Denne hæmning af enzymaktiviteten resulterer i nedsatte mængder af steroler, især ergosterol, og en tilsvarende ophobning af squalen i cellerne.
Mekanisme for resistens
Der er endnu ikke blevet identificeret en mekanisme for resistens over for naftifin.
Naftifin har vist sig at være aktivt mod de fleste isolater af følgende svampe, både in vitro og i kliniske infektioner, som beskrevet i afsnittet INDIKATIONER OG ANVENDELSE:
Trichophyton rubrum
Nonklinisk toksikologi
Carcinogenese, mutagenese, forringelse af fertilitet
I en 2-årig dermal carcinogenicitetsundersøgelse blev naftifinhydrochloridcreme administreret til Sprague-Dawley rotter i topiske doser på 1%, 2% og 3% (10, 20 og 30 mg/kg/dag naftifinhydrochlorid). Der blev ikke observeret nogen lægemiddelrelaterede tumorer i denne undersøgelse op til den højeste dosis, der blev evalueret i denne undersøgelse på 30 mg/kg/dag (12 gange MRHD baseret på AUC-sammenligning).
Naftifinhydrochlorid viste ingen tegn på mutagent eller klastogent potentiale baseret på resultaterne af to in vitro genotoksicitetstest (Ames-assay og kromosomaberrationstest i kinesiske hamster-ovarieceller) og en in vivo genotoksicitetstest (mikronukleus-assay i knoglemarv af mus).
Oral indgift af naftifinhydrochlorid til rotter under parring, drægtighed, fødsel og amning viste ingen virkninger på vækst, fertilitet eller reproduktion ved doser på op til 100 mg/kg/dag (6 gange MRHD).
Kliniske undersøgelser
Tinea cruris
Naftifinhydrochloridcreme er blevet undersøgt for sikkerhed og effekt i et randomiseret, dobbeltblindet, vehicle-kontrolleret, multicenterforsøg i 146 forsøgspersoner med symptomatisk og dermatofytekulturpositiv tinea cruris. Forsøgspersonerne blev randomiseret til at modtage naftifinhydrochloridcreme eller præparat. Forsøgspersonerne påførte naftifinhydrochlorid-creme eller medium på det angrebne område plus en ½-tommers margen af sund hud omkring det angrebne område én gang dagligt i 2 uger. Tegn og symptomer på tinea cruris (tilstedeværelse eller fravær af erytem, pruritus og skældannelse) blev vurderet, og der blev foretaget KOH-undersøgelse og dermatofytkultur ved det primære effektmål i uge 4.
Den gennemsnitlige alder af forsøgspopulationen var 47 år, og 87 % var mænd og 43 % var hvide. Ved baseline blev det bekræftet, at forsøgspersonerne havde tegn og symptomer på tinea cruris, positiv KOH-undersøgelse og bekræftet tilstedeværelse af dermatofyter baseret på dyrkningsresultater fra et centralt mykologisk laboratorium. Analysen af intent-to-treat-populationen var en sammenligning af andelene af forsøgspersoner med fuldstændig helbredelse ved besøget i uge 4 (se tabel 1). Komplet helbredelse blev defineret som både klinisk helbredelse (fravær af erytem, pruritus og skældannelse) og mykologisk helbredelse (negativ KOH- og dermatofytkultur).
Procenten af forsøgspersoner med klinisk helbredelse og procentdelen af forsøgspersoner med mykologisk helbredelse ved uge 4 er præsenteret individuelt i tabel 1 nedenfor.
|
Endpoint |
Naftifine Hydrochloride Cream, 2% |
Vehikel |
|
N=75 |
N=71 |
|
|
Komplet Curea |
19 (25%) |
2 (3%) |
|
Effektiv behandlingb |
45 (60%) |
7 (10%) |
|
Mycological Curec |
54 (72%) |
11 (16%) |
|
a. Fuldstændig helbredelse er et sammensat endepunkt af både mykologisk helbredelse og klinisk helbredelse. Klinisk helbredelse er defineret som fravær af erytem, pruritus og skældannelse (grad 0). |
||
|
b. Effektiv behandling er et negativt KOH-præparat og en negativ dermatofytekultur, erytem, skældannelse og pruritus af grad 0 eller 1 (fraværende eller næsten fraværende). |
||
|
c. Mykologisk helbredelse er defineret som negativ KOH- og dermatofytkultur. |
||
Interdigital Tinea Pedis
Naftifinhydrochloridcreme er blevet undersøgt for effektivitet i et randomiseret, dobbeltblindet, vehicle-kontrolleret, multicenterforsøg på 217 forsøgspersoner med symptomatisk og dermatofytkulturpositiv interdigital tinea pedis
. Forsøgspersonerne blev randomiseret til at modtage naftifinhydrochlorid-creme eller vehikel. Forsøgspersonerne påførte naftifinhydrochlorid-creme eller vehikel på det angrebne område af foden plus en ½-tommers margen af sund hud omkring det angrebne område én gang dagligt i 2 uger. Tegn og symptomer på interdigital tinea pedis (tilstedeværelse eller fravær af erytem, pruritus og skældannelse) blev vurderet, og der blev foretaget KOH-undersøgelse og dermatofytkultur ved det primære effektmål i uge 6.
Den gennemsnitlige alder af forsøgspopulationen var 42 år, og 71 % var mænd og 57 % var hvide. Ved baseline blev det bekræftet, at forsøgspersonerne havde tegn og symptomer på interdigital tinea pedis, positiv KOH-undersøgelse og bekræftet dermatofytekultur. Det primære effektmål var andelen af forsøgspersoner med en fuldstændig helbredelse ved besøget i uge 6 (se tabel 2). Komplet helbredelse blev defineret som både en klinisk helbredelse (fravær af erytem, pruritus og skældannelse) og mykologisk helbredelse (negativ KOH- og dermatofytkultur).
Effektivitetsresultaterne ved uge 6, fire uger efter behandlingens afslutning, er præsenteret i tabel 2 nedenfor. Naftifinhydrochloridcreme påviste fuldstændig helbredelse hos forsøgspersoner med interdigital tinea pedis, men fuldstændig helbredelse hos forsøgspersoner med kun tinea pedis af moccasin-typen blev ikke påvist.
|
Endpoint |
Naftifine hydrochloride Cream, 2% |
Vehikel |
|
N=147 |
N=70 |
|
|
Komplet Curea |
26 (18%) |
5 (7%) |
|
Effektiv behandlingb |
83 (57%) |
14 (20%) |
|
Mycological Curec |
99 (67%) |
15 (21%) |
|
a. Komplet helbredelse er et sammensat endepunkt for både mykologisk helbredelse og klinisk helbredelse. |
||
|
b. Effektiv behandling er et negativt KOH-præparat og en negativ dermatofytekultur, erytem, skældannelse og pruritus af grad 0 eller 1 (fraværende eller næsten fraværende). |
||
|
c. Mykologisk helbredelse er defineret som negativ KOH- og dermatofytkultur. |
||
Tinea corporis
Naftifinhydrochloridcreme er blevet undersøgt for sikkerhed og effekt i et randomiseret, dobbeltblindet, vehicle-kontrolleret, multicenterforsøg på 184 forsøgspersoner med symptomatisk og dermatofytkulturpositiv tinea corporis. Forsøgspersonerne blev randomiseret til at modtage naftifinhydrochloridcreme eller præparat. Forsøgspersonerne påførte undersøgelsesmidlet på alle angrebne kropsoverflader med tinea corporis plus en ½ tomme margen af sund hud omkring de angrebne læsioner i to uger. Tegn og symptomer på tinea corporis (tilstedeværelse eller fravær af erytem, induration og pruritus) blev vurderet, og der blev foretaget KOH-undersøgelse og dermatofytkultur til vurdering af det primære effektmål på dag 21.
Populationen i forsøget var pædiatrisk (større end eller lig med 2 til mindre end 18 år) med en medianalder på 9 år (naftifinhydrochloridcreme) eller 8 år (vehikel). 61 % af forsøgspersonerne var mænd og 45 % var hvide. Ved baseline blev det bekræftet, at forsøgspersonerne havde tegn og symptomer på tinea corporis, positiv KOH-undersøgelse og bekræftet dermatofytekultur. Det primære effektmål var andelen af forsøgspersoner med en fuldstændig helbredelse ved besøget på dag 21. Komplet helbredelse blev defineret som både en klinisk helbredelse (fravær af erytem, induration og pruritus på alle læsioner, der var til stede ved baseline) og mykologisk helbredelse (negativ KOH- og dermatofytkultur).
Effektivitetsresultaterne på dag 21, en uge efter behandlingens ophør, er præsenteret i tabel 3 nedenfor.
|
Naftifine Hydrochloride Cream, 2% |
Vehikel |
|
|
Endpunkt |
N=91 |
N=93 |
|
Komplet Curea |
42 (46%) |
26 (28%) |
|
Effektiv behandlingb |
53 (58%) |
32 (34%) |
|
Mycological Curec |
57 (63%) |
36 (39%) |
|
a. Komplet helbredelse er et sammensat endepunkt for både mykologisk helbredelse og klinisk helbredelse. |
||
|
b. Effektiv behandling er et negativt KOH-præparat og negativ dermatofytekultur, erytem, induration og pruritus af grad 0 eller 1 (fraværende eller mild). |
||
|
c. Mykologisk helbredelse er defineret som negativ KOH- og dermatofytkultur. |
||
Hvordan leveres/opbevaring og håndtering
Naftifinhydrochloridcreme, USP 2 %, er en hvid til råhvid creme, der leveres i følgende størrelse:
45 grams tuber – NDC 70700-161-18
60 grams tuber – NDC 70700-161-17
Lagre naftifinhydrochloridcreme ved 25°C (77°F); afvigelser tilladt til 15° til 30°C (59° til 86°F) .
Patientrådgivning
- Informér patienterne om, at naftifinhydrochloridcreme kun er til lokal brug. Naftifinhydrochloridcreme er ikke beregnet til oral, intravaginal eller oftalmisk brug.
- Hvis der udvikles irritation eller følsomhed ved brug af naftifinhydrochloridcreme skal behandlingen afbrydes og passende behandling iværksættes. Patienterne skal henvises til at kontakte deres læge, hvis disse tilstande udvikler sig efter brug af naftifinhydrochloridcreme.
Distribueret af:
Xiromed, LLC,
Florham Park, NJ 07932
Rev. 09/2020
PI-161-00
Pakningsetiket PRINCIPAL DISPLAY PANEL SECTION – 45g Tube

NDC 70700-161-18
Naftifine Cream, 2%
Xiromed, LLC
Kun til topisk brug
ikke til øjenlægebrug, Oral eller intravaginal brug
45 g
Kun på recept
Pakkeetikettens hoveddisplaypanel – 60g tube

NDC 70700-161-17
Naftifine Cream, 2%
Xiromed, LLC
Kun til topisk brug
ikke til øjenlægebrug, Oral eller intravaginal brug
60 g
Kun på recept
| NAFTIFINE HYDROCHLORID naftifinhydrochloridcreme |
|||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||
Mærketager – Xiromed, LLC (080228637)
Registrerende virksomhed – Xiromed Pharma España, S.L. (468835741)
Mere om naftifine topisk
- Bivirkninger
- Under graviditet eller amning
- Doseringsinformation
- Prisangivelse & Kuponer
- En Español
- 7 Anmeldelser
- Lægemiddelklasse: Aktuel svampemidler
Forbrugerressourcer
- Patientinformation
- Naftifine Topical (Avanceret læsning)
Professionelle ressourcer
- Oplysningsinformation
- Naftifine (Professionel patientrådgivning)
- Naftifine Gel (FDA)
Andre mærker Naftin
Relaterede behandlingsvejledninger
- Tinea Pedis
- Tinea Corporis
- Tinea Cruris
Medicinsk ansvarsfraskrivelse