Subatomare partikler
Alle grundstoffer består af ekstremt små partikler af stof kaldet atomer. Vi kan definere et atom som den enkleste partikel af et grundstof, der har de kemiske egenskaber for dette grundstof. Kemiske egenskaber omfatter elementets fysiske tilstand (gas, væske eller fast stof), de typer bindinger, som elementet kan danne, hvordan det reagerer med andre grundstoffer osv. Derfor har alle de atomer, der udgør grundstoffet kulstof, de samme kemiske egenskaber.
Fysikere har haft held til at sprænge atomer fra hinanden i dusinvis af forskellige subatomare partikler, men kun 3 af dem er stabile. Disse er protonerne, neutronerne og elektronerne. Protoner er positivt ladede partikler, har masse og befinder sig i midten, eller atomets kerne. Neutroner har ingen ladning, har masse og befinder sig også i atomets kerne. Neutroner binder sig til protoner på en måde, der er med til at stabilisere atomkernen. For mange eller for få neutroner kan resultere i en atomkerne, der er ustabil og kan henfalde og danne andre grundstoffer. Vi kalder disse atomer for radioaktive atomer. Selv om neutronens masse er lidt større end protonens masse, kan vi tildele dem begge den relative masse 1 (1 atomare masseenhed eller amu). Neutroner og protoner udgør næsten hele et atomers masse. Den tredje type af stabile partikler er elektronen. Elektroner har en negativ ladning, men er ekstremt små og har en masse på kun 1/1850 af en protons eller neutrons masse. De er så små, at de i praktisk henseende ikke bidrager til atomets masse. Elektroner bevæger sig rundt om atomkernen med enormt høje hastigheder og bevæger sig faktisk næsten med lysets hastighed. Selv om vi ofte beskriver elektronerne som værende i baner, der kredser om atomkernen, ligesom planeter kredser om solen, lærer den moderne fysik os, at denne model er ukorrekt. Disse “orbitaler” er faktisk områder i rummet omkring kernen, hvor elektronerne vil befinde sig det meste af tiden. Dette område omtales ofte som elektronernes “sky”. Det er ganske vist stadig et specifikt område, men det er en smule mere amorf end en kugleformet bane. For enkelhedens skyld tænker vi dog ofte på disse som satellitlignende cirkulære orbitaler. Billedet nedenfor repræsenterer vores nuværende model af et kvælstofatom.
Kernekernen af kvælstof indeholder 7 protoner (orange) og 7 neutroner (grøn). De skraverede områder omkring kernen repræsenterer elektronorbitalerne (skyer). Elektroner (blå) findes et eller andet sted inden for disse orbitaler. (Bemærk: billedet er ikke tegnet i målestok. Det er blevet foreslået, at hvis kernen var på størrelse med en basketball, ville elektronerne være omkring seks kilometer eller 3¾ miles væk!)
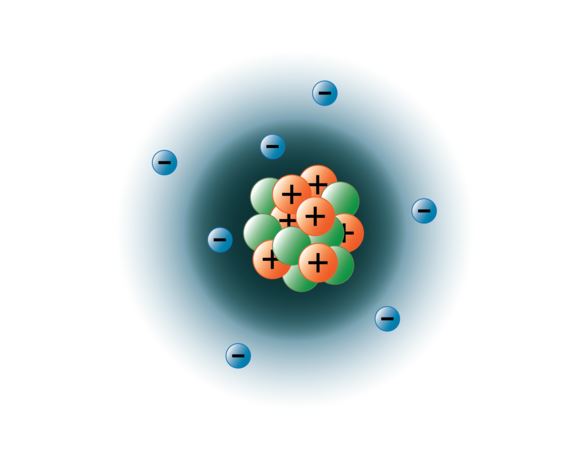
Billede skabt af BYU-I studerende Hannah Crowder Fall 2013
Atomnummer
Kig på det periodiske system igen, og læg mærke til tallet øverst i hver kasse. Dette tal er atomnummeret for grundstoffet og er unikt for hvert enkelt grundstof. For eksempel er atomnummeret for brint 1. Intet andet grundstof har et atomnummer på 1. For kulstof er atomnummeret 6, og igen har intet andet grundstof et atomnummer på 6. Atomnummerets betydning er, at det fortæller os, hvor mange protoner der er i kernen af hvert grundstof. Derfor har alle hydrogenatomer 1 proton, og alle kulstofatomer har 6 protoner. Da atomer desuden har en neutral ladning, fortæller atomnummeret os også antallet af elektroner i atomet. I kemisk notation udtrykkes atomnummeret for et grundstof som et subscript, der står foran symbolet for grundstoffet. For eksempel vil kulstof blive udtrykt som 6C.
Massenummer (atommasse)
Massenummeret for et atom fortæller, som navnet antyder, atomets samlede masse. Da en elektrons masse er ekstremt lille (ubetydelig), bruges den ikke i beregningen af massetallet. Husk også på, at massen af hver proton såvel som hver neutron er 1 atommassenhed. Derfor er massetallet summen af protonerne og neutronerne i atomet. Da massetallet er antallet af protoner plus antallet af neutroner, og atomnummeret er antallet af protoner, kan du finde antallet af neutroner ved blot at trække atomnummeret fra massetallet. Som et eksempel kan vi antage, at vi har et grundstof med et atomnummer på 8 og et massetal på 17. Ud fra disse oplysninger kan du udlede, at dette grundstof har 8 protoner, 8 elektroner og 9 neutroner (17-8=9). Lad mig nu kaste dig en kugle i hovedet. Som nævnt ovenfor har alle atomer af et givet grundstof det samme antal protoner (atomnummer), men forskellige atomer af et givet grundstof kan have et forskelligt antal neutroner. Vi siger, at der er tale om forskellige isotoper af grundstoffet. Der findes f.eks. tre isotoper af brint. Den mest almindelige isotop, som udgør 99,98 % af alle brintatomer, har et massetal på 1. Den består derfor af 1 proton, ingen neutroner og en elektron. De andre mindre hyppigt forekommende isotoper af brint har massetal på henholdsvis 2 og 3. Disse isotoper er forskellige med hensyn til antallet af neutroner i deres kerner, men alle tre har én proton og én elektron. I virkeligheden findes der naturligt forekommende isotoper af hvert grundstof, som hver især har deres eget unikke massetal. I kemisk notation udtrykkes massetallet for en given isotop som en overskrift, der står foran symbolet for grundstoffet. De tre isotoper for brint vil blive udtrykt som 1H, 2H og 3H. Da hvert grundstof er sammensat af flere isotoper, er et af de spørgsmål, der opstår, “hvad er den faktiske masse af et givet grundstof?” Hvis du igen ser på det periodiske system ovenfor, vil du bemærke et tal i bunden af hvert felt. Dette er atomvægten for grundstoffet. For eksempel er atomvægten for hydrogen 1,00794 amu. Dette tal er fremkommet ved at beregne den gennemsnitlige masse af de 3 isotoper af brint. Lad os f.eks. antage, at vi havde 10 drenge i vores klasse. Hvis vi ville kende drengenes gennemsnitlige vægt, ville vi lægge deres individuelle vægt sammen og derefter dividere det samlede resultat med 10. Dette ville give os deres gennemsnitlige vægt. Det er i princippet sådan, atomvægtene bestemmes. Da 1H er den hyppigst forekommende isotop af brint, giver det mening, at atomvægten for brint er meget tæt på atommassen af 1H.
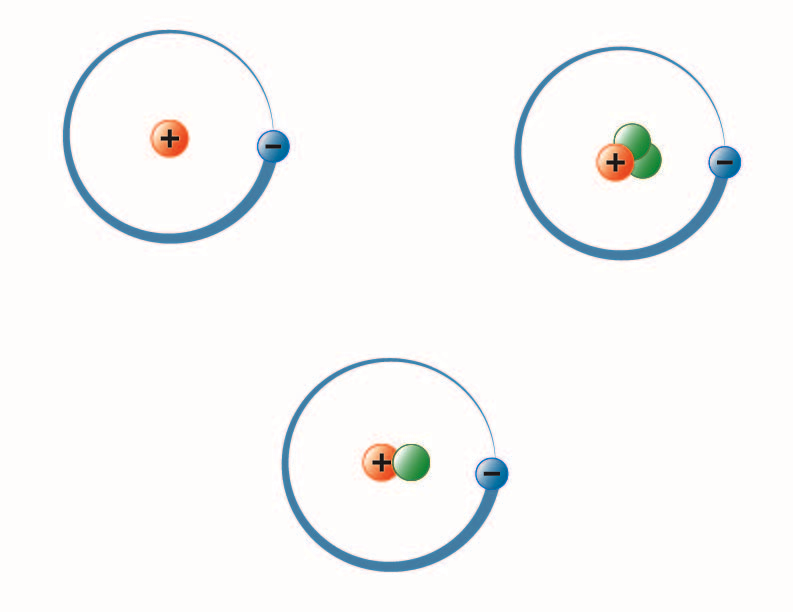
Billede skabt af BYU-I-studerende Hannah Crowder Fall 2013
Billedet ovenfor repræsenterer de tre isotoper af brint. Den mest almindelige (øverst til venstre) har én proton og ingen neutroner i kernen. Deuterium (nederst) har én proton og én neutron, og tritium (øverst til højre) har én proton og to neutroner.
**Du kan bruge knapperne nedenfor til at gå til næste eller forrige læsning i dette modul**

