Figur 1. Toll-like receptor-signalvejen
Hvad er Toll-like receptor?
Toll-like receptorer (TLR’er) er en klasse af proteiner, der spiller en central rolle i den medfødte immunitet. De er trans-membranreceptorer med et enkelt domæne og hører til mønstergenkendelsesreceptorer (PRR), som normalt udtrykkes i sentinelceller som f.eks. makrofager dendritiske celler og mange andre ikke-immune celler som f.eks. fibroblaster og epitelceller. De genkender strukturelt bevarede molekyler, der stammer fra mikrober, som kaldes patogen-associerede molekylære mønstre (PAMP’er), eller selvafledte molekyler, der stammer fra beskadigede celler, som kaldes skadeassocierede molekylære mønstre (DAMP’er). PAMP’er omfatter forskellige bakterielle cellevægkomponenter såsom lipopolysaccharid (LPS), peptidoglykan (PGN) og lipopeptider samt flagellin, bakteriel DNA og viralt dobbeltstrenget RNA. DAMP’er omfatter intracellulære proteiner som f.eks. varmechokproteiner samt proteinfragmenter fra den ekstracellulære matrix. PRR’er aktiverer downstream-signalveje, der fører til induktion af medfødte immunresponser ved at producere inflammatoriske cytokiner, type I-interferon (IFN) og andre mediatorer. Disse processer udløser ikke kun umiddelbare værtsforsvarsresponser som f.eks. inflammation, men også en start og orkestrering af antigenspecifikke adaptive immunresponser. Disse responser er afgørende for clearance af inficerende mikrober samt afgørende for den efterfølgende instruktion af antigenspecifikke adaptive immunresponser.
Figur 2. Det skematiske diagram over TLR’ernes molekylære struktur.
Toll-lignende receptorfamilie
TLR-familien omfatter 10 medlemmer (TLR1-TLR10) hos mennesker og 12 (TLR1-TLR9, TLR11-TLR13) hos mus. TLR’er lokaliseres til celleoverfladen eller til intracellulære kompartmenter såsom ER, endosom og lysosom. TLR’er på celleoverfladen omfatter TLR1, TLR2, TLR4, TLR5, TLR6 og TLR10, mens intracellulære TLR’er er lokaliseret i endosomet og omfatter TLR3, TLR7, TLR8, TLR9, TLR11, TLR12 og TLR13 (figur 1). TLR’er på celleoverfladen genkender hovedsagelig mikrobielle membrankomponenter såsom lipider, lipoproteiner og proteiner. Intracellulære TLR’er genkender nukleinsyrer, der stammer fra bakterier og vira, og genkender også selv-nukleinsyrer i sygdomstilstande som autoimmunitet.
Toll-like-receptorens funktion er normalt baseret på en dimeriseringsproces af to TLR-molekyler, men ikke altid. For eksempel vil TLR-1 og TLR-2 binde sig til hinanden for at danne en dimmer, når de genkender PAMP-molekyler, der hovedsagelig omfatter lipoproteiner, peptidoglykaner, lipotekosyrer (LTA, Gram-), zymosan, mannan og tGPI-mucin. TLR-2 kan også danne en dæmper med TLR-6, når de genkender de samme PAMP’er, som er anført ovenfor. TLR-4 kan genkende lipopolysaccharid (LPS, Gram+) og danne en homodimer med et andet TLR-4-molekyle. TLR-5 kan genkende bakteriel flagellin, men de danner ikke en dimmer. TLR-11 er funktionel hos mus og genkender hovedsagelig uropatogene bakterier. TLR-3, 7, 8, 8, 9, 13 udtrykkes på endosomoverfladen i cytoplasmaet. TLR3 genkender viralt dobbeltstrenget RNA (dsRNA), små interfererende RNA’er og selv-RNA’er, der stammer fra beskadigede celler. TLR-7 er overvejende udtrykt i plasmacytoide DC’er (pDC’er) og genkender enkeltstrenget (ss) RNA fra vira. Det genkender også RNA fra streptokokker B-bakterier i konventionelle DC’er (cDC’er). TLR8 reagerer på viralt og bakterielt RNA. TLR-9 genkender bakteriel og viral DNA, der er rig på umethylerede CpG-DNA-motiver. TLR13 genkender bakterielt 23S rRNA og ukendte komponenter af vesikulær stomatitisvirus.
Og selv om der findes så mange typer af TLR-molekyler, som genkender en lang række ligander, har alle disse TLR’er en fælles strukturel ramme i deres ekstracellulære, ligandbindende domæner. Disse domæner har alle hesteskoformede strukturer, der er opbygget af leukinrige gentagelsesmotiver. Ved ligandbinding danner to ekstracellulære domæner typisk en ”m”-formet dimer, der tager ligandmolekylet i en sandwich, hvilket bringer transmembran- og cytoplasmiske domæner tæt på hinanden og udløser en nedstrøms signalkaskade (figur 2).
Toll-like receptor-signalvej
1. Toll-like receptor-signalkaskade
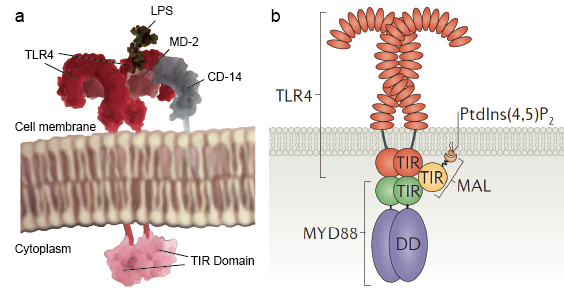
Toll-like receptorer gør det muligt for sentinelceller som f.eks. makrofager at detektere mikrober gennem PAMP’er som f.eks. LPS. LPS er en bestanddel af bakteriernes cellevæg. Mekanismen for lipopolysaccharidgenkendelse af Toll-like-receptorer er kompleks og kræver flere supplerende proteiner. Et serumprotein, LPS-bindingsprotein, binder LPS-monomerer og overfører dem til et protein kaldet CD14. CD14 kan være opløselig eller binde sig til celleoverfladen gennem et glycosylphosphatidylinositol-anker. CD 14 overfører og indlæser LPS til det ekstracellulære domæne af Toll-like-receptorer. TLR’er er i stand til at detektere LPS ved hjælp af et tilbehørsprotein kaldet MD-2. Derefter induceres homodimerisering af TLR’er, når LPS bindes til komplekset af TLR-CD14-MD2. Konformationsændringen af de ekstracellulære domæner indleder dimerisering af det cytoplasmatiske Toll IL-1-receptordomæne (TIR). TIR-konformationsændringen giver et nyt stillads, der gør det muligt at rekruttere adaptorproteiner til at danne et post-receptor-signalkompleks. TIR’en indeholder et adaptorprotein, myeloid differentiation primary-response protein 88 (MyD88).
MyD88 fungerer som en adaptor, der forbinder TLR’er/IL-1R’er med nedstrøms signalmolekyler, der har DD’er. Det genkender konformationsændringen i TLR’ernes TIR-domæne, binder sig til det nye receptorkompleks og overfører signaleringen ved amino (N)-terminal dødsdomæne (DD)-interaktion med IL-1R-associerede kinaser (IRAK’er). Dette resulterer i en kompleks kaskade med signalering, der advarer cellen om patogeninvasion. Der findes 4 IRAK’er (IRAK 1, 2, 4, M). De indeholder et N-terminalt DD og et centralt serin/threonin-kinase-domæne. IRAK1 og IRAK4 har intrinsisk kinaseaktivitet, mens IRAK2 og IRAK-M ikke har nogen påviselig kinaseaktivitet. IRAK4 aktiveres af MyD88, og det fortsætter med at aktivere IRAK1. IRAK1 aktiverer derefter nedstrøms TRAF6. TRAF6 er et medlem af den tumornekrosefaktorreceptor (TNFR)-associerede faktor (TRAF)-familie, som medierer cytokinsignalveje. Ved stimulering rekrutteres TRAF6 til receptorkomplekset og aktiveres af IRAK-1, der binder sig til TRAF-domænet af TRAF6. Derefter dissocieres IRAK-1/TRAF6-komplekset fra receptoren og associeres med TGF-beta-aktiveret kinase 1 (TAK1) og TAK1-bindende proteiner, TAB1 og TAB2. Komplekset af TRAF6, TAK1, TAB1 og TAB2 bevæger sig ind i cytoplasmaet, hvor det danner et stort kompleks med andre proteiner, som f.eks. E2-ligaserne Ubc13 og Uev1A. Ubc13- og Uev1A-komplekset har vist sig at katalysere syntesen af en Lys 63-bundet polyubiquitinkæde af TRAF6 og derved inducere TRAF6-medieret aktivering af TAK1 og i sidste ende af NF-kB. Disse signalveje, der er beskrevet ovenfor, kaldes MyD88-afhængige veje, da signalet starter fra MyD88-molekylet. Der findes også en anden vej, der kaldes MyD88-afhængig vej, hvor signaleringen ikke starter fra MyD88. I stedet starter signalet fra TRIF-proteinet. TRIF interagerer med TRAF6 og TRAF3. TRAF6 rekrutterer kinasen RIP-1, som igen interagerer med og aktiverer TAK1-komplekset, hvilket fører til aktivering af NF-kB og MAPK’er og induktion af inflammatoriske cytokiner. I modsætning hertil rekrutterer TRAF3 de IKK-relaterede kinaserTBK1 og IKKi sammen med NEMO til IRF3-fosforylering og aktivering. IRF3 danner en dimer og translokeres til kernen fra cytoplasmaet, inducerer ekspression af type I IFN.
2. Downstream-signalering
TLR’er signalerer faktisk hovedsagelig gennem rekruttering af specifikke adaptormolekyler, hvilket fører til aktivering af transkriptionsfaktorerne NF-kB og IRF’er, som dikterer resultatet af de medfødte immunresponser. Så denne vejs downstream-signalering skal aktivere IRFs transkriptionsfaktor, NF-kB-signalvejen og MAKP-signalvejen. Du kan finde mere detaljerede oplysninger om NF-kB- og MAKP-signalvejen fra:
NF-kB-signalvejen, P38-signalvejen og MAKP-signalvejen.
3. Regulering af signalvejen
Der er naturligvis en vis negativ regulering af en række molekyler gennem forskellige mekanismer for at forhindre eller afslutte de overdrevne immunresponser, der fører til skadelige konsekvenser i forbindelse med autoimmunitet og inflammatorisk sygdom. Aktivering af den MyD88-afhængige vej undertrykkes af ST2825, SOCS1 og Cbl-b, og aktivering af den TRIF-afhængige vej undertrykkes af SARM og TAG. Disse molekyler associerer sig med MyD88 eller TRIF for at forhindre dem i at binde sig til TLR’er eller nedstrømsmolekyler. TRAF3-aktivering er negativt reguleret af SOCS3 og DUBA. TRAF6 er målrettet mod en række hæmmende molekyler som f.eks. A20, USP4, CYLD, TANK, TRIM38 og SHP. TAK1-aktivering hæmmes af TRIM30a og A20.
4. Forholdet til sygdomme
Da TLR er involveret i LPS-sensorering og kan spille en rolle i sepsis, er målretning af TLR’er vigtig for behandlingen af flere sygdomme. Ud over at gribe ind i TLR-reaktioner for at behandle patogeninfektioner var en oplagt klinisk anvendelse af den viden, der blev opnået ved TLR-undersøgelser, at anvende TLR-ligander som vaccineadjuvante midler. Desuden har man også forsøgt sig med TLR-hæmning i klinikken, hvor målet er at begrænse overdreven inflammation, der formodentlig er drevet af overaktivering af en bestemt TLR.
| Takeda, Kiyoshi, og Shizuo Akira. “TLR-signalveje.” Seminarer i immunologi. Vol. 16. No. 1. Academic Press, 2004. | |
| Akira, Shizuo, og Kiyoshi Takeda. “Toll-like receptor-signalering”. Nature reviews immunology 4.7 (2004): 499-511. | |
| Lim, Kian-Huat, og Louis M. Staudt. “Toll-like receptor-signalering”. Cold Spring Harbor perspectives in biology 5.1 (2013): a011247. | |
| ogTaro Kawai, Takumi Kawasaki. “Toll-like receptor-signalveje.” Pattern Recognition Receptors and Cancer 8916 (2015): 7. | |
| Gay, Nicholas J., et al. “Assembly and localization of Toll-like receptor signalling complexes.” Nature reviews Immunology 14.8 (2014): 546-558. | |
| O’Neill, Luke AJ, Douglas Golenbock, og Andrew G. Bowie. “Historien om Toll-lignende receptorer, der omdefinerer den medfødte immunitet”. Nature Reviews Immunology 13.6 (2013): 453-460. | |
| Botos, Istvan, David M. Segal, og David R. Davies. “Den strukturelle biologi af Toll-like receptorer”. Structure 19.4 (2011): 447-459. |