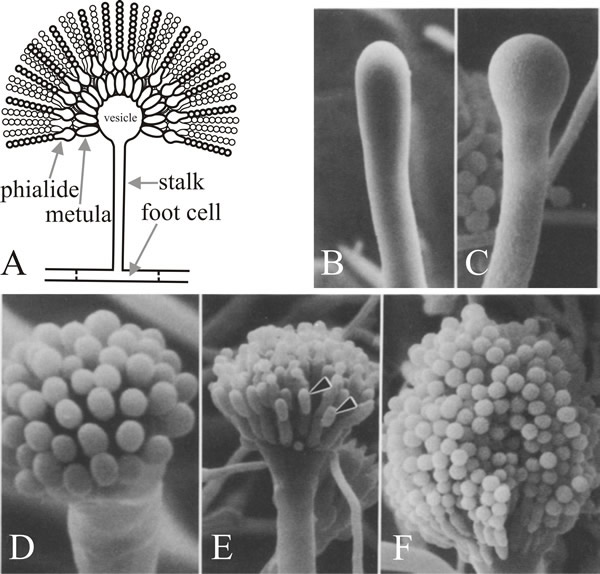
La cellule d’où émerge la branche est la cellule du pied du conidiophore, qui se distingue des autres cellules végétatives par un épaississement de la paroi secondaire pigmentée en brun à l’intérieur de sa paroi d’origine. Le pédoncule croît apicalement jusqu’à atteindre une longueur d’environ 100 µm lorsque l’apex se gonfle pour former la vésicule du conidiophore qui a un diamètre d’environ 10 µm. Un seul niveau de nombreux sterigmates primaires, appelés métules, bourgeonne ensuite de la vésicule et des sterigmates secondaires, les phialides, bourgeonnent des apex exposés des métules. Les phialides sont les cellules souches qui subissent ensuite des divisions asymétriques répétées pour former les longues chaînes de conidies entéroblastiques qui ont un diamètre d’environ 3 µm (figure 7).
L’analyse génétique classique, par isolement et analyse de mutants, a établi le schéma génétique de base de la conidiation d’Aspergillus. On a estimé qu’entre 300 et 1 000 loci génétiques étaient concernés par la conidiation en comparant les fréquences de mutation sur les loci affectant la conidiation avec celles d’autres fonctions (Martinelli &Clutterbuck, 1971). L’analyse des espèces d’ARNm a indiqué qu’environ 6 000 étaient exprimés dans le mycélium végétatif et que 1 200 autres étaient trouvés dans les cultures qui comprenaient des conidiophores et des conidies ; 200 de ces ARNm supplémentaires étant trouvés dans les conidies elles-mêmes. Seulement environ 2 % des mutants de A. nidulans dépourvus de conidies présentaient des défauts dans les étapes concernées par la croissance et le développement des conidiophores, et 85 % des mutants de conidiation étaient également défectueux dans la croissance hyphale végétative et dans l’obtention de la compétence.
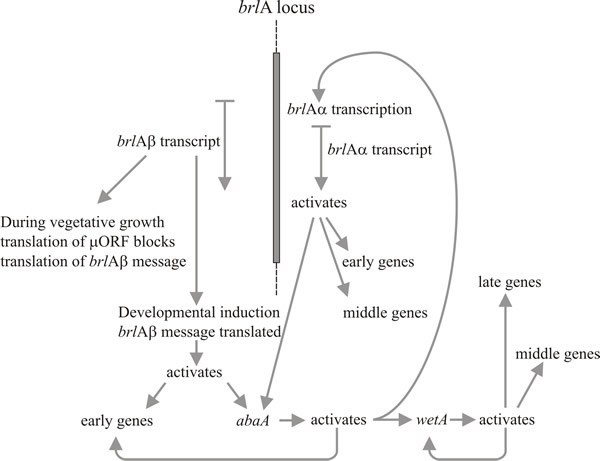
Deux gènes, en particulier, jouent un rôle clé dans la morphogenèse du conidiophore : il s’agit du gène ‘bristle’ (brlA) qui présente des défauts dans la formation de la vésicule et de la métula, et ‘abacus’ (abaA) dans lequel les conidies sont remplacées par des longueurs d’hyphes perlées, il est donc vraisemblablement défectueux dans le bourgeonnement conidial à partir du phialide et la septation finale. Un troisième gène, wetA, est défectueux dans une étape précoce de la maturation des spores. Les conidies des mutants wetA manquent de pigment et d’hydrophobie ; elles s’autolysent après quelques heures et n’expriment pas une série d’ARNm spécifiques aux spores. Le transcrit du gène wetA est absent chez les mutants brlA et abaA (c’est-à-dire que brlA et abaA sont épistatiques à wetA), et des études de doubles mutants montrent que ces trois gènes agissent dans l’ordre : brlA → abaA → wetA.
Une caractéristique frappante de l’analyse mutationnelle du développement des conidiophores chez A. nidulans est que les mutants de ces trois gènes seulement provoquent des défauts dans la morphogenèse des conidiophores et des spores, alors que jusqu’à 1 000 autres loci génétiques provoquent l’absence de conidiation lorsqu’ils sont mutés. Cela implique que brlA, abaA et wetA sont des régulateurs qui intègrent l’expression d’autres gènes nécessaires à la conidiation mais qui n’y sont pas eux-mêmes dédiés. De nombreux mutants de conidiation d’Aspergillus étaient également défectueux dans la reproduction sexuelle, donc une autre conclusion à tirer est qu’il y a une certaine économie d’utilisation des gènes morphogénétiques dans les différents processus de développement. On peut supposer que les différents modes de développement utilisent des gènes structurels qui ne sont pas uniquement liés au développement, mais qui fonctionnent dans de nombreuses voies, leur spécificité de développement leur étant conférée par les régulateurs auxquels ils répondent. Ceci est illustré par l’idée que la clé du développement des eucaryotes réside dans la capacité à utiliser relativement peu de gènes régulateurs pour intégrer les activités de beaucoup d’autres.
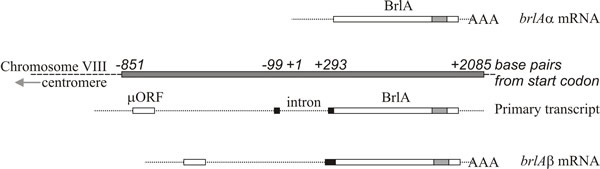
L’analyse moléculaire soutient l’interprétation selon laquelle brlA, abaA et wetA sont des régulateurs ; la séquence brlA code une protéine à doigt de zinc, qui est un activateur de transcription de liaison à l’ADN spécifique de la séquence des gènes cibles régulés par le développement (figure 8). Cependant, ce n’est pas tout, car le produit brlA a des affinités différentes pour différents gènes cibles. En effet, le locus brlA est constitué d’unités de transcription qui se chevauchent (Fig. 9), l’unité en aval étant désignée brlAα et l’unité en amont brlAβ ; entre elles, leurs produits résolvent deux problèmes classiques du développement, à savoir comment répondre à un signal et comment maintenir cette réponse lorsque le signal s’est dissipé.
Les deux unités de transcription de brlA partagent le même cadre de lecture sur la majeure partie de leur longueur, mais brlAβ possède 23 résidus d’acides aminés supplémentaires à l’extrémité amino-terminale de ce cadre de lecture, et sa transcription possède également un cadre de lecture séparé de 41 résidus d’acides aminés (appelé µORF) près de son extrémité 5′. Le produit µORF réprime la traduction du cadre de lecture en aval (BrlA) et même si le transcrit brlAβ peut être détecté dans les hyphes végétatifs, le peptide BrlA n’est pas produit. La répression causée par µORF n’est surmontée que lorsque le mycélium est compétent, ce qui est probablement signalé comme une limitation en azote (un signal environnemental commun pour l’initiation de la sporulation chez les Ascomycota), qui réduit les pools d’aminoacyl-tRNA et perturbe la régulation traductionnelle par µORF. Lorsque l’effet du µORF est bloqué, le peptide BrlA peut être traduit à partir du transcrit existant.
Le découvreur de ce processus a décrit l’activation de la voie de conidiation comme un » déclenchement traductionnel » (Timberlake, 1993), suggérant que le déclenchement traductionnel est un moyen de rendre la différenciation sensible au statut nutritionnel de l’hyphe. Ainsi, l’hyphe compétente est amorcée pour entreprendre le développement des conidiophores mais l’activation irréversible de la voie de conidiation est empêchée par une répression traductionnelle qui maintient la croissance végétative jusqu’à ce que les conditions de sporulation soient idéales.
L’activation de brlA est, par conséquent, considérée comme la première étape du développement des conidiophores, et son produit active à son tour un panel de gènes spécifiques à la conidiation parmi lesquels se trouve le régulateur suivant, abaA. Le produit abaA est également une protéine régulatrice transcriptionnelle se liant à l’ADN qui renforce l’expression des gènes structurels induits par brlA. Les gènes brlA et abaA sont des activateurs réciproques, car abaA active également brlA. Bien sûr, l’expression de brlA doit se produire avant celle d’abaA, mais l’activation consécutive d’abaA sur brlA renforce l’expression de cette dernière et rend effectivement la progression de la voie indépendante des événements extérieurs. Le produit abaA active également d’autres gènes structurels et le gène régulateur final, wetA, qui active les gènes structurels spécifiques des spores. Puisque brlA et abaA ne sont pas exprimés dans les conidies en cours de différenciation, wetA est probablement impliqué dans l’inactivation de leur expression dans les spores (et peut-être aussi dans le phialide ; lorsque le noyau de la spore actuelle atteint le stade de maturation qui nécessite des gènes régulés par wetA, les noyaux du phialide doivent être » retournés » à l’état d’initiation de la conidie pour commencer la formation de la spore suivante). L’expression de wetA est initialement activée dans le phialide par l’action séquentielle de brlA et abaA, et elle est ensuite autorégulée (le produit wetA active la transcription de wetA). L’autorégulation positive de wetA maintient ensuite son expression après que le conidium ait été séparé (physiquement et cytologiquement) du phialide.
Timberlake (1993) a appelé ce mécanisme la fixation par rétroaction : l’activation réciproque, l’activation par rétroaction et l’autorégulation des séquences régulatrices centrales renforcent l’expression de l’ensemble de la voie, la rendant indépendante des signaux environnementaux externes qui l’ont initiée et permettant à la spore de poursuivre sa maturation même après sa séparation du phialide. Le développement des conidiophores, comme de nombreux autres processus morphogénétiques, est naturellement divisé en étapes séquentielles. Ce réseau de régulation montre comment le déclenchement de la traduction peut relier une voie morphogénétique au développement de la compétence d’une part, et à l’initiation en réponse à un ou plusieurs indices environnementaux d’autre part. Après l’initiation, la fixation de la rétroaction entraîne une détermination développementale dans le sens embryologique classique de la poursuite de la morphogenèse même lorsqu’elle est retirée de l’environnement d’initiation.
Nous avons délibérément choisi dans cette section de baser notre description sur des recherches effectuées il y a environ 50 ans qui ont commencé par l’isolement d’un grand nombre de mutations avec des phénotypes de conidiation altérés et se sont poursuivies par des études « classiques » de ségrégations et de complémentations génétiques (Martinelli & Clutterbuck, 1971). En plus de montrer comment notre compréhension de la sporulation s’est accomplie, cela démontre la valeur de l’utilisation de ces techniques ‘démodées’ pour étudier de tels phénomènes.
Cependant, nous ne pouvons pas ignorer les recherches approfondies qui ont été complétées sur les mécanismes moléculaires qui sous-tendent la croissance et le développement d’Aspergillus. Ces études ont confirmé que l’événement clé de la sporulation est l’activation du facteur de transcription à doigt de zinc codé par brlA, et que les gènes abaA et wetA sont des régulateurs nécessaires de la conidiation. Le facteur de transcription codé par abaA est activé par brlA après la différenciation des métulae et pendant les étapes moyennes du développement du conidiophore ; et le gène wetA, activé par abaA, fonctionne dans la phase tardive de la conidiation en dirigeant la synthèse des composants cruciaux de la paroi cellulaire et en transformant le métabolisme du conidium en cours de maturation. Chez Aspergillus nidulans, ces trois gènes créent la voie de régulation centrale qui, avec d’autres gènes, contrôle l’expression des gènes spécifiques à la conidiation et la séquence d’activation des gènes impliqués dans l’acquisition de la compétence de développement, le développement du conidiophore et la maturation des spores (Lee et al., 2016).
Plusieurs aspects de ces voies de développement ont été conservés chez d’autres aspergillus. Les membres du genre Aspergillus sont parmi les champignons les plus couramment rencontrés, et tous se reproduisent asexuellement en formant de longues chaînes de conidies. Plusieurs espèces, dont Aspergillus oryzae et Aspergillus niger, sont utilisées dans l’industrie pour la production d’enzymes et la transformation des aliments, tandis qu’Aspergillus flavus est responsable de l’altération des aliments en produisant les plus puissants cancérigènes naturels connus, les aflatoxines. Une autre espèce préoccupante est le pathogène humain opportuniste Aspergillus fumigatus, qui produit un nombre massif de petites conidies hydrophobes comme principal moyen de dispersion et qui est devenu un pathogène fongique aérien très répandu dans les pays développés. Chez les patients immunodéprimés, A. fumigatus provoque une aspergillose invasive dont le taux de mortalité est élevé. La voie de signalisation du développement BrlA-AbaA-WetA a été conservée dans la conidiation de ces espèces d’Aspergillus (Yu, 2010 ; Tao & Yu, 2011 ; Krijgsheld et al., 2013). En outre, les études protéomiques, transcriptomiques et métabolomiques ont fourni une image détaillée des changements dynamiques qui se produisent dans plusieurs milliers de gènes, de transcrits, d’enzymes et de réactions métaboliques pendant la formation, la maturation, la dormance et la germination des conidies d’Aspergillus (van Leeuwen et al., 2013 ; Novodvorska et al., 2016 ; Teertstra et al., 2017).
Mise à jour en juillet 2019