Énergies d’ionisation des éléments des blocs s et p
Les énergies d’ionisation des éléments de la troisième ligne du tableau périodique présentent le même schéma que celles de \(Li\) et \(Be\) (Tableau \(\PageIndex{2}\) 🙂 Les énergies d’ionisation successives augmentent régulièrement lorsque les électrons sont retirés des orbitales de valence (3s ou 3p, dans ce cas), suivies d’une augmentation particulièrement importante de l’énergie d’ionisation lorsque les électrons sont retirés des niveaux de noyau remplis, comme indiqué par la ligne diagonale en gras dans le tableau \(\PageIndex{2}\). Ainsi, dans la troisième ligne du tableau périodique, l’augmentation la plus importante de l’énergie d’ionisation correspond à l’élimination du quatrième électron de \(Al\), du cinquième électron de Si, et ainsi de suite – c’est-à-dire l’élimination d’un électron d’un ion qui a la configuration de l’électron de valence du gaz rare précédent. Ce schéma explique pourquoi la chimie des éléments ne fait normalement intervenir que des électrons de valence. Trop d’énergie est nécessaire pour enlever ou partager les électrons internes.
| Elément | \(I_1\) | \(I_2\) | \(I_3\) | \(I_4\) | \(I_5\) | \(I_6\) | \(I_7\) |
|---|---|---|---|---|---|---|---|
| *Electron d’enveloppe intérieureintérieur | |||||||
| Na | 495.8 | 4562.4* | – | – | – | – | – |
| Mg | 737.7 | 1450,7 | 7732,7 | – | – | – | – |
| Al | 577,4,4 | 1816,7 | 2744.8 | 11 577,4,4 | – | – | – |
| Si | 786,5 | 1577,1 | 3231,6 | 4355,5 | 16 090.6 | – | – |
| P | 1011.8 | 1907.4.4 | 2914.1 | 4963.6 | 6274.0 | 21,267.4.3 | – |
| S | 999.6 | 2251.8 | 3357 | 4556.2 | 7004.3 | 8495.8 | 27,107.4.3 |
| Cl | 1251.2 | 2297.7 | 3822 | 5158.6 | 6540 | 9362 | 11,018.2 |
| Ar | 1520.6 | 2665.9 | 3931 | 5771 | 7238 | 8781.0 | 11,995.3 |
Exemple \(\PageIndex{1}\) : Plus haute énergie de quatrième ionisation
D’après leur emplacement dans le tableau périodique, prédisez lequel de ces éléments a la plus haute énergie de quatrième ionisation : B, C, ou N.
Donné : trois éléments
Demandé : élément avec la quatrième énergie d’ionisation la plus élevée
Stratégie:
- Listez la configuration électronique de chaque élément.
- Déterminez si les électrons sont retirés d’une coquille de valence remplie ou partiellement remplie. Prédire quel élément a la quatrième énergie d’ionisation la plus élevée, en reconnaissant que l’énergie la plus élevée correspond à l’enlèvement d’électrons d’un noyau électronique rempli.
Solution:
A Ces éléments se trouvent tous dans la deuxième rangée du tableau périodique et ont les configurations électroniques suivantes:
- B : 2s22p1
- C : 2s22p2
- N : 2s22p3
B La quatrième énergie d’ionisation d’un élément (\(I_4\)) est définie comme l’énergie nécessaire pour retirer le quatrième électron :
\
Parce que le carbone et l’azote ont respectivement quatre et cinq électrons de valence, leurs quatrièmes énergies d’ionisation correspondent au retrait d’un électron d’une coquille de valence partiellement remplie. La quatrième énergie d’ionisation du bore, cependant, correspond au retrait d’un électron de la sous-coquille 1s2 remplie. Cela devrait nécessiter beaucoup plus d’énergie. Les valeurs réelles sont les suivantes : B, 25 026 kJ/mol ; C, 6223 kJ/mol ; et N, 7475 kJ/mol.
Exercice \(\PageIndex{1}\) : La plus faible énergie de seconde ionisation
D’après leur emplacement dans le tableau périodique, prédisez lequel de ces éléments a la plus faible énergie de seconde ionisation : Sr, Rb ou Ar.
Réponse
(\ce{Sr}\)
La première colonne de données du tableau \(\PageIndex{2}\) montre que les premières énergies d’ionisation ont tendance à augmenter sur la troisième ligne du tableau périodique. Ceci est dû au fait que les électrons de valence ne s’écrantent pas très bien les uns les autres, ce qui permet à la charge nucléaire effective d’augmenter régulièrement sur la rangée. Les électrons de valence sont donc attirés plus fortement vers le noyau, ce qui entraîne une diminution de la taille des atomes et une augmentation des énergies d’ionisation. Ces effets représentent les deux faces d’une même médaille : des interactions électrostatiques plus fortes entre les électrons et le noyau augmentent encore l’énergie nécessaire pour retirer les électrons.
Cependant, la première énergie d’ionisation diminue à Al (3s23p1) et à S (3s23p4). Les configurations électroniques de ces « exceptions » permettent de comprendre pourquoi. Les électrons de la sous-coquille 3s2 de l’aluminium sont plus efficaces pour protéger l’électron 3p1 que pour se protéger mutuellement de la charge nucléaire, de sorte que les électrons s pénètrent plus près du noyau que l’électron p et que ce dernier est plus facilement éliminé. La diminution à S se produit parce que les deux électrons de la même orbitale p se repoussent mutuellement. Cela rend l’atome S légèrement moins stable que ce à quoi on pourrait s’attendre, comme c’est le cas pour tous les éléments du groupe 16.
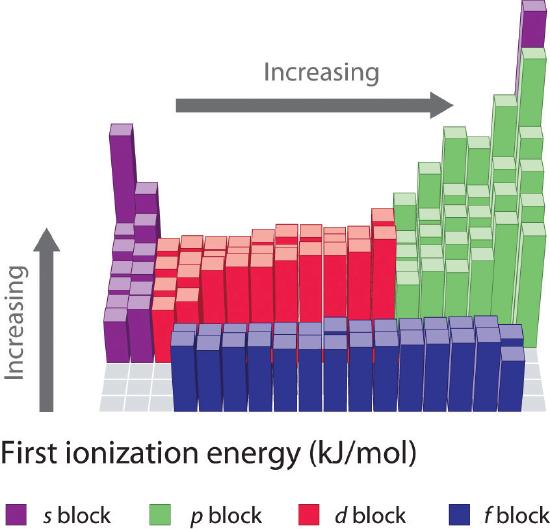
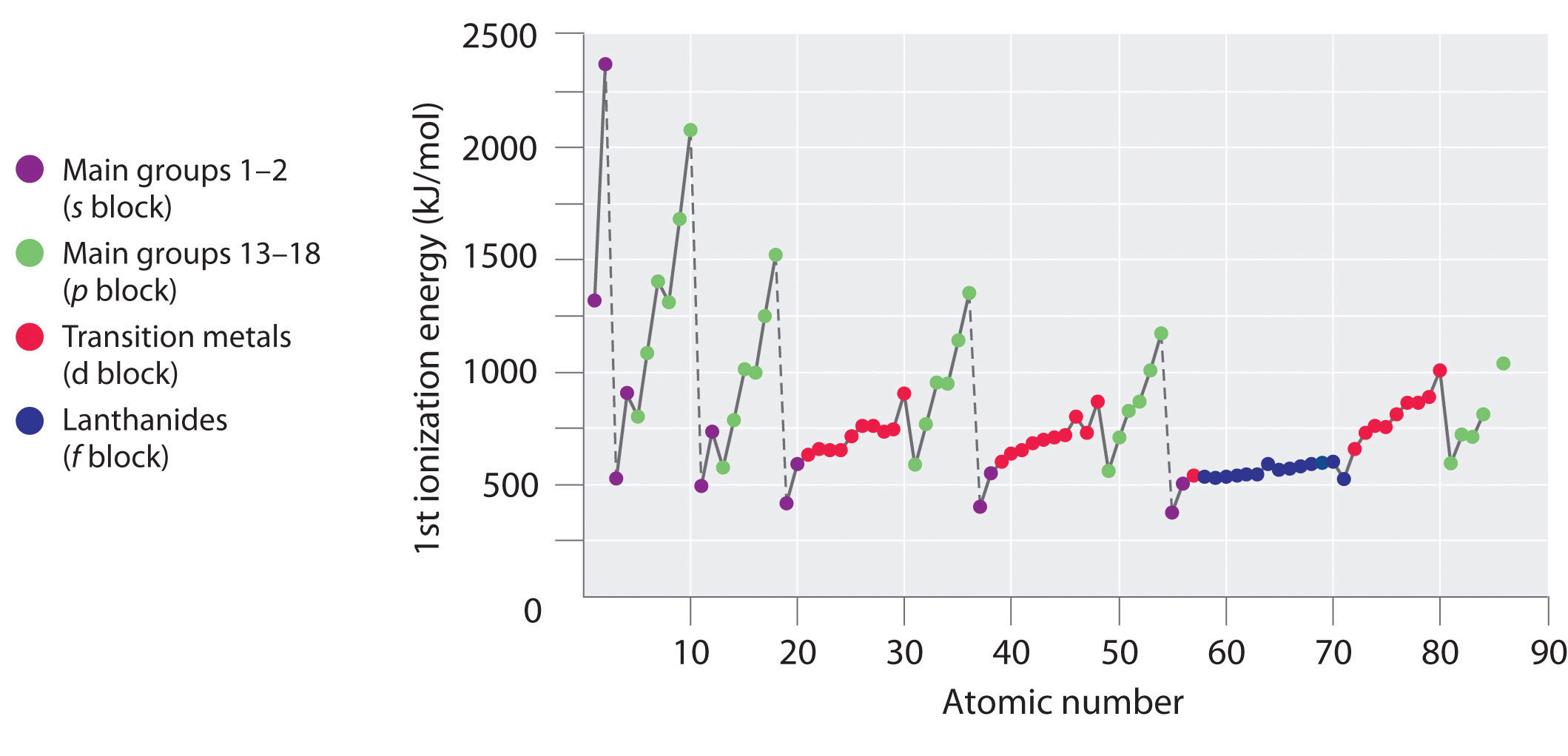
Les premières énergies d’ionisation des éléments des six premières rangées du tableau périodique sont tracées sur la figure \(\PageIndex{1}\) et sont présentées numériquement et graphiquement sur la figure \(\PageIndex{2}\). Ces figures illustrent trois tendances importantes :
- Les changements observés dans les deuxième (Li à Ne), quatrième (K à Kr), cinquième (Rb à Xe) et sixième (Cs à Rn) rangées des blocs s et p suivent un schéma similaire à celui décrit pour la troisième rangée du tableau périodique. Cependant, les métaux de transition sont inclus dans les quatrième, cinquième et sixième rangées, et les lanthanides sont inclus dans la sixième rangée. Les premières énergies d’ionisation des métaux de transition sont assez semblables les unes aux autres, tout comme celles des lanthanides. Les énergies d’ionisation augmentent de gauche à droite à travers chaque rangée, avec des divergences se produisant à ns2np1 (groupe 13), ns2np4 (groupe 16), et ns2(n – 1)d10 (groupe 12).
- Les premières énergies d’ionisation diminuent généralement vers le bas d’une colonne. Bien que le nombre quantique principal n augmente vers le bas d’une colonne, les coquilles internes remplies sont efficaces pour protéger les électrons de valence, il y a donc une augmentation relativement faible de la charge nucléaire effective. Par conséquent, les atomes deviennent plus gros à mesure qu’ils acquièrent des électrons. Les électrons de valence qui sont plus éloignés du noyau sont moins étroitement liés, ce qui les rend plus faciles à éliminer, ce qui entraîne une diminution des énergies d’ionisation. Un rayon plus grand correspond généralement à une énergie d’ionisation plus faible.
- En raison des deux premières tendances, les éléments qui forment le plus facilement des ions positifs (ont les énergies d’ionisation les plus faibles) se trouvent dans le coin inférieur gauche du tableau périodique, tandis que ceux qui sont les plus difficiles à ioniser se trouvent dans le coin supérieur droit du tableau périodique. Par conséquent, les énergies d’ionisation augmentent généralement en diagonale du coin inférieur gauche (Cs) au coin supérieur droit (He).

Généralement, \(I_1\) augmente en diagonale de la partie inférieure gauche du tableau périodique vers la partie supérieure droite.
Le gallium (Ga), qui est le premier élément suivant la première rangée de métaux de transition, a la configuration électronique suivante : 4s23d104p1. Sa première énergie d’ionisation est nettement inférieure à celle de l’élément immédiatement précédent, le zinc, car la sous-coquille 3d10 remplie du gallium se trouve à l’intérieur de la sous-coquille 4p, protégeant l’unique électron 4p du noyau. Les expériences ont révélé quelque chose d’encore plus intéressant : les deuxième et troisième électrons qui sont retirés lorsque le gallium est ionisé proviennent de l’orbitale 4s2, et non de la sous-coquille 3d10. La chimie du gallium est dominée par l’ion Ga3+ résultant, avec sa configuration électronique 3d10. Cette configuration électronique et d’autres similaires sont particulièrement stables et sont souvent rencontrées dans les éléments du bloc p plus lourds. On les appelle parfois des configurations de pseudo-gaz rares. En fait, pour les éléments qui présentent ces configurations, on ne connaît aucun composé chimique dans lequel les électrons sont retirés de la sous-coquille remplie de (n – 1)d10.