Particules subatomiques
Tous les éléments sont composés de particules de matière extrêmement petites appelées atomes. Nous pouvons définir un atome comme la particule la plus simple d’un élément qui possède les propriétés chimiques de cet élément. Les propriétés chimiques comprennent l’état physique de l’élément (gaz, liquide ou solide), les types de liaisons que l’élément peut former, la façon dont il réagit avec d’autres éléments, etc. Par conséquent, tous les atomes qui composent l’élément carbone ont les mêmes propriétés chimiques.
Les physiciens ont réussi à faire exploser les atomes en dizaines de particules subatomiques différentes, cependant, seules 3 d’entre elles sont stables. Ce sont les protons, les neutrons et les électrons. Les protons sont des particules chargées positivement, ont une masse et sont situés au centre, ou noyau, de l’atome. Les neutrons n’ont pas de charge, ont une masse et sont également situés dans le noyau de l’atome. Les neutrons se lient aux protons d’une manière qui contribue à stabiliser le noyau. Si les neutrons sont trop nombreux ou trop rares, le noyau atomique peut être instable et se désintégrer pour former d’autres éléments. On dit de ces atomes qu’ils sont radioactifs. Bien que la masse du neutron soit légèrement supérieure à celle du proton, nous pouvons leur attribuer à tous deux la masse relative de 1 (1 unité de masse atomique ou amu). Les neutrons et les protons constituent la quasi-totalité de la masse d’un atome. Le troisième type de particule stable est l’électron. Les électrons ont une charge négative mais sont extrêmement petits et ont une masse qui ne représente que 1/1850 de celle d’un proton ou d’un neutron. Ils sont si petits que, dans la pratique, ils ne contribuent pas à la masse de l’atome. Les électrons se déplacent autour du noyau à des vitesses extrêmement élevées, se déplaçant en fait à une vitesse proche de celle de la lumière. Bien que nous décrivions souvent les électrons comme résidant dans des orbites qui tournent autour du noyau, comme des planètes autour du soleil, la physique moderne nous apprend que ce modèle est incorrect. Ces « orbitales » sont en fait des zones de l’espace autour du noyau où les électrons se trouvent la plupart du temps. Cette zone est souvent appelée le « nuage » d’électrons. Certes, il s’agit toujours d’une zone spécifique, mais elle est un peu plus amorphe qu’une orbite sphérique. Toutefois, pour simplifier, nous les considérons souvent comme des orbites circulaires semblables à des satellites. L’image ci-dessous représente notre modèle actuel d’un atome d’azote.
Le noyau d’azote contient 7 protons (orange) et 7 neutrons (vert). Les zones ombragées autour du noyau représentent les orbitales des électrons (nuages). Les électrons (bleus) se trouvent quelque part dans ces orbitales. (Remarque : l’image n’est pas dessinée à l’échelle. Il a été suggéré que si le noyau avait la taille d’un ballon de basket-ball, les électrons seraient à environ six kilomètres ou 3¾ de kilomètres !)
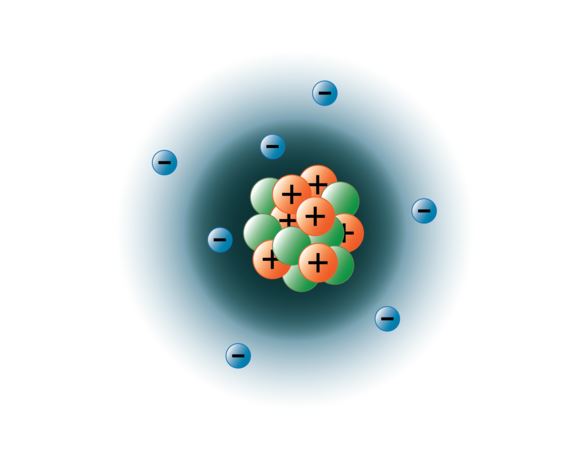
image créée par Hannah Crowder, étudiante de BYU-I, automne 2013
Numéro atomique
Regardez à nouveau le tableau périodique et remarquez le numéro en haut de chaque case. Ce numéro est le numéro atomique de l’élément et il est unique pour chaque élément différent. Par exemple, le numéro atomique de l’hydrogène est 1. Aucun autre élément n’a un numéro atomique de 1. Pour le carbone, le numéro atomique est 6 et, là encore, aucun autre élément n’a un numéro atomique de 6. La signification du numéro atomique est qu’il nous indique le nombre de protons dans le noyau de chaque élément. Par conséquent, tous les atomes d’hydrogène ont 1 proton et tous les atomes de carbone ont 6 protons. En outre, comme les atomes ont une charge neutre, le numéro atomique nous indique également le nombre d’électrons présents dans l’atome. Dans la notation chimique, le numéro atomique d’un élément est exprimé par un indice précédant le symbole de l’élément. Par exemple, le carbone serait exprimé par 6C.
Nombre de masse (masse atomique)
Le nombre de masse d’un atome, comme son nom l’indique, indique la masse totale de l’atome. Comme la masse d’un électron est extrêmement faible (négligeable), elle n’est pas utilisée dans le calcul du nombre de masse. Rappelons également que la masse de chaque proton et de chaque neutron est de 1 unité de masse atomique. Le nombre de masse est donc la somme des protons et des neutrons de l’atome. Puisque le nombre de masse est le nombre de protons plus le nombre de neutrons et que le nombre atomique est le nombre de protons, vous pouvez trouver le nombre de neutrons en soustrayant simplement le nombre atomique du nombre de masse. À titre d’exemple, supposons que nous ayons un élément dont le numéro atomique est de 8 et le numéro de masse de 17. À partir de ces informations, vous pouvez déduire que cet élément possède 8 protons, 8 électrons et 9 neutrons (17-8=9). Maintenant, laissez-moi vous donner un coup de pouce. Comme nous l’avons dit plus haut, tous les atomes d’un élément donné ont le même nombre de protons (numéro atomique), mais différents atomes d’un élément donné peuvent avoir un nombre différent de neutrons. On dit qu’il s’agit de différents isotopes de l’élément. Par exemple, il existe trois isotopes de l’hydrogène. L’isotope le plus courant, qui représente 99,98 % de tous les atomes d’hydrogène, a un numéro de masse de 1. Il est donc composé d’un proton, d’aucun neutron et d’un électron. Les autres isotopes moins abondants de l’hydrogène ont des numéros de masse de 2 et 3, respectivement. Ces isotopes diffèrent par le nombre de neutrons dans leur noyau, mais tous trois ont un proton et un électron. En réalité, il existe des isotopes naturels de chaque élément, chacun ayant un numéro de masse qui lui est propre. Dans la notation chimique, le numéro de masse d’un isotope donné est exprimé par un exposant précédant le symbole de l’élément. Les trois isotopes de l’hydrogène seraient exprimés par 1H, 2H et 3H. Puisque chaque élément est composé de plusieurs isotopes, une question se pose : « Quelle est la masse réelle d’un élément donné ? ». Là encore, si vous regardez le tableau périodique ci-dessus, vous remarquerez un chiffre au bas de chaque case. Il s’agit du poids atomique de l’élément. Par exemple, le poids atomique de l’hydrogène est de 1,00794 amu. Ce chiffre a été obtenu en calculant la masse moyenne des trois isotopes de l’hydrogène. Par exemple, supposons que nous ayons 10 garçons dans notre classe. Si nous voulions connaître le poids moyen de ces garçons, nous additionnerions leurs poids individuels et diviserions le total par 10. Cela nous donnerait leur poids moyen. C’est essentiellement de cette manière que les poids atomiques sont déterminés. Puisque 1H est l’isotope le plus abondant de l’hydrogène, il est logique que le poids atomique de l’hydrogène soit très proche de la masse atomique de 1H.
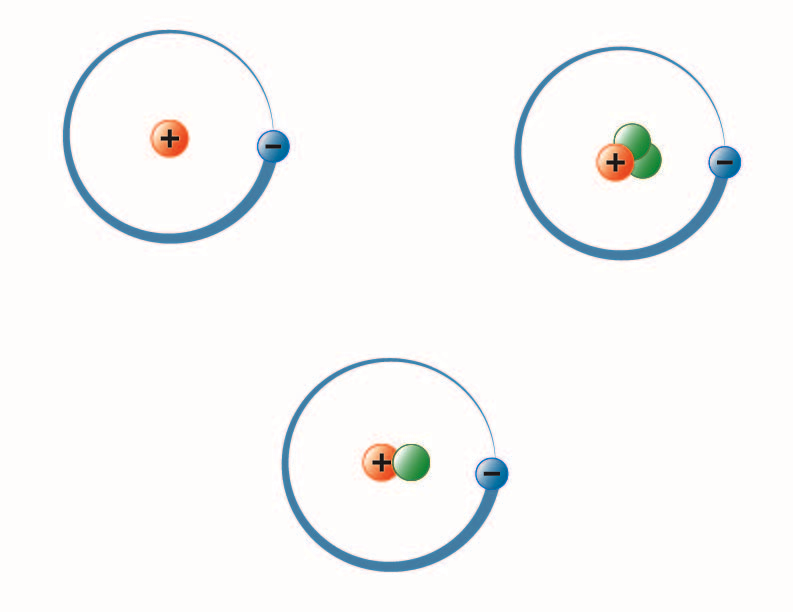
image créée par Hannah Crowder, étudiante de BYU-I, automne 2013
L’image ci-dessus représente les trois isotopes de l’hydrogène. Le plus commun (en haut à gauche) a un proton et aucun neutron dans le noyau. Le deutérium (en bas) a un proton et un neutron et le tritium (en haut à droite) a un proton et deux neutrons.
**Vous pouvez utiliser les boutons ci-dessous pour aller à la lecture suivante ou précédente dans ce module**

