Les cellules T-régulatrices (Tregs), anciennement connues sous le nom de cellules suppressives T, sont un sous-ensemble de cellules T ayant des rôles directs à la fois dans l’auto-immunité et les réponses aux agents pathogènes.
Les Tregs diminuent l’inflammation via la sécrétion de cytokines immunosuppressives (IL-10, TGF-b) et également par la suppression directe des cellules T effectrices inflammatoires (telles que les cellules Th1 et Th17).
Les Tregs contrôlent et préviennent probablement les maladies auto-immunes en contribuant au maintien de la tolérance aux auto-antigènes. Le bénéfice thérapeutique du transfert de Tregs est bien établi dans les modèles animaux et des efforts pour commencer des thérapies Tregs humaines sont en cours pour la transplantation et les patients atteints de diabète de type 1.
Compte tenu de l’importance de ce sous-ensemble unique de cellules T dans tant de réponses immunitaires, de nombreux chercheurs se sentent négligés s’ils immunophénotypage leurs populations de cellules d’intérêt sans inclure une mesure Treg dans le mélange. Mais la quantification des Tregs peut être compliquée.
Par exemple : quels sont les meilleurs marqueurs à utiliser ? Comment savoir avec certitude que vous mesurez de véritables cellules T suppressives ?
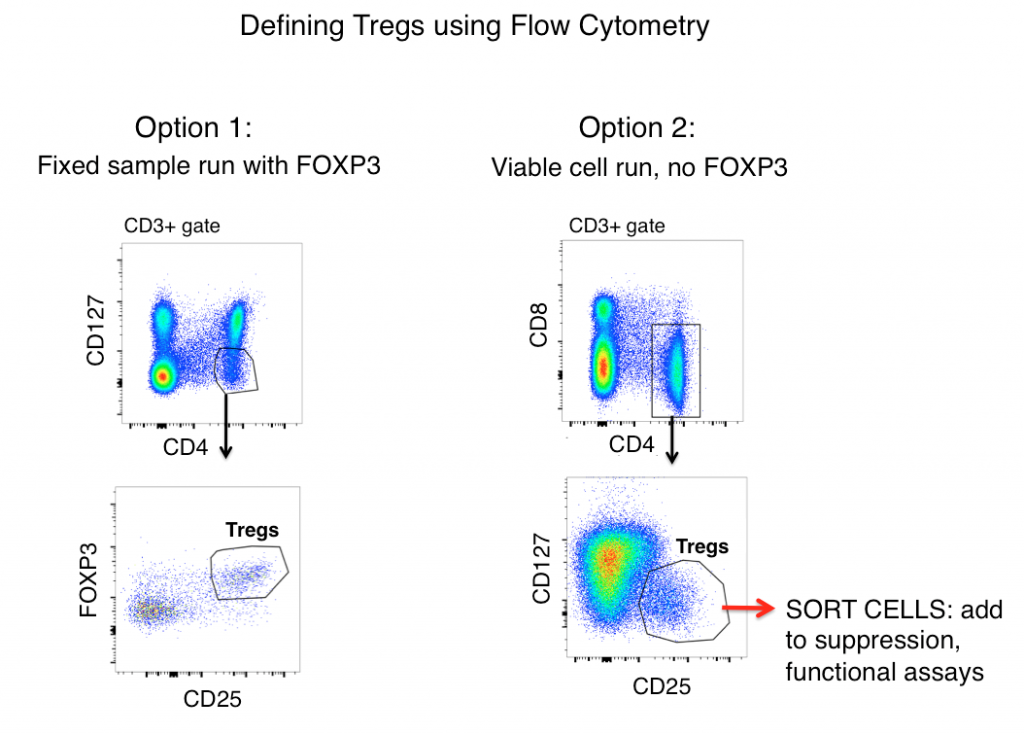
Stratégies de marquage pour définir les Tregs par cytométrie en flux
La stratégie de marquage standard des Tregs pour les échantillons de souris et d’humains (après avoir d’abord éliminé les doublets et le marquage sur cellules vivantes) comprend les antigènes CD3, CD4, CD25, FOXP3 et CD127.
Lorsque l’on regarde uniquement l’expression des antigènes, les Tregs sont souvent définis comme CD3+, CD4+, CD25hi, FOXP3+ et CD127lo (indiqués dans la figure ci-dessous comme option 1). En utilisant ces marqueurs, une population claire est souvent visible à partir d’échantillons tels que les splénocytes de souris et les PBMC humains.
Cependant, les cellules T activées régulent souvent à la hausse le CD25, et l’expression de FOXP3 a été trouvée sur des lignées de cellules T » effectrices » (non suppressives). Par conséquent, lorsqu’on s’appuie uniquement sur le phénotypage par cytométrie de flux pour définir les Tregs, les cellules T inflammatoires pourraient être un loup dans l’habit du mouton (Treg) et conduire à une interprétation incorrecte des données.
Une cellule peut ressembler à un canard, mais fait-elle coin-coin ? La mesure des fonctions effectrices de votre éventuelle population de Treg aidera grandement à élucider l’exactitude de votre stratégie de flow gating. Afin de déterminer si les cellules que vous définissez comme des Tregs leur ressemblent fonctionnellement, l’option 2 (voir ci-dessous) consiste à omettre FOXP3 de votre panel, à trier les cellules CD3+, CD4+, CD25hi, CD127lo, puis à déterminer les fonctions de votre population de « Tregs » par une analyse des cytokines et/ou des essais de suppression en co-culture avec des cellules T non Treg (CD3+ CD4+ CD25-, CD127hi). Typiquement, FOXP3 ne peut pas être inclus dans les panels où des cellules viables sont requises après le tri car une coloration intracellulaire est nécessaire.
Définir la variété croissante des sous-ensembles Treg
Il existe de nombreuses saveurs de Tregs, y compris les tTregs, les pTregs et les iTregs.
Par exemple, les tTregs (également connus sous le nom de nTregs) sont générés dans le thymus et ont un répertoire TcR qui est biaisé vers les auto-peptides. Une autre saveur, connue sous le nom de pTregs, est générée dans la périphérie, et les iTregs sont induits en culture via le TGF-b.
Il y a des faiseurs associés à ces divers sous-ensembles Treg et ils devraient être pris en compte pour l’inclusion dans un panel anti corps Treg si leur subsetting est intéressant. Par exemple, chez l’homme, le CD39 est considéré comme un marqueur fiable des Tregs. De plus, chez les souris et les humains, Helios a été trouvé pour distinguer de manière fiable les tTregs des sous-ensembles p, et iTreg.
Définir une cellule unique comme un Treg-est-ce possible ?
Une limitation majeure dans le domaine des Tregs est le manque d’un test de suppression de cellule unique.
Définir une cellule T individuelle comme membre d’une lignée de mémoire distincte, telle que Th1, Th2 ou Th17, peut être accompli via l’analyse d’analyte avec une résolution de cellule unique telle que la coloration de cytokine intracellulaire, car ces cellules sont principalement, sinon exclusivement, définies par ce que les cytokines qu’elles produisent.
Cependant, pour montrer qu’une cellule unique est un Treg, nous voulons idéalement pouvoir quantifier que cette cellule choisie peut supprimer la fonction des cellules T effectrices (ou d’autres sous-ensembles cellulaires) en coculture. Actuellement, la seule façon de tester la fonction suppressive des Tregs est dans une culture en vrac, où l’on peut conclure que certaines (mais pas toutes, peut-être même pas la plupart) des cellules désignées comme Tregs sont suppressives.
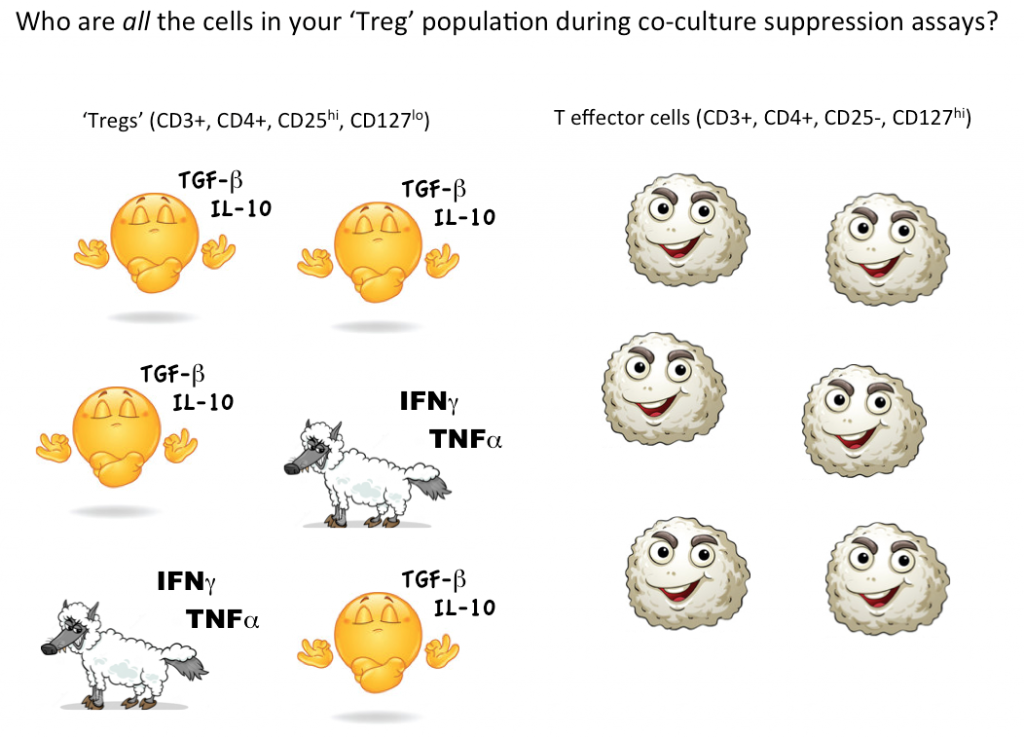
En pensant à nouveau aux loups potentiels » cellules T effectrices » en habits de mouton, nous ne savons tout simplement pas combien de cellules non suppressives, voire inflammatoires, se cachent dans notre stratégie de sélection des Tregs. L’utilisation de la cytométrie en flux pour d’abord sélectionner et trier les cellules viables avec des marqueurs cohérents avec les Tregs, puis tester fonctionnellement pour voir si, en tant que groupe, les cellules définies par votre stratégie de sélection agissent réellement comme des Tregs, est actuellement la meilleure façon de quantifier les Tregs dans votre échantillon.
En exécutant les bonnes stratégies de sélection pour définir les Tregs par cytométrie en flux et en tenant compte du nombre croissant de sous-ensembles de Tregs, vous pouvez faire ressortir vos populations de Tregs d’intérêt. La clé est de tester la fonction de ces populations après les avoir identifiées, car il est actuellement difficile, voire impossible, de définir une seule cellule comme étant un Treg. Cependant, des progrès sont réalisés quotidiennement et, à terme, étiqueter correctement les cellules Treg uniques sera possible.
Pour en savoir plus sur l’analyse des cellules T et d’autres types de cellules par cytométrie en flux, et pour avoir accès à tout notre matériel avancé, y compris 20 vidéos de formation, des présentations, des cahiers d’exercices et l’adhésion à un groupe privé, inscrivez-vous sur la liste d’attente de la classe de maîtrise de la cytométrie en flux.
 .
.