1 – Définition
La DAVR est une maladie du muscle cardiaque associée à des arythmies ventriculaires et à une mort subite. Elle se caractérise par des anomalies structurelles et fonctionnelles du ventricule droit causées par le remplacement du myocarde par du tissu graisseux et fibreux. Les sites d’implication des anomalies anatomiques se trouvent dans ce que l’on appelle le triangle de la dysplasie (les zones sous-tricuspidiennes du ventricule droit, l’apex et l’infundibulum)(4).
La dysplasie arythmogène du ventricule droit (DAVD) est une maladie héréditaire, typiquement transmise comme un trait autosomique dominant avec une pénétrance variable et une expression incomplète(1). Il existe une variante autosomique récessive associée à une kératose palmoplantaire et à des cheveux ondulés nommée maladie de Naxos.
2 – Prévalence
La prévalence dans la population générale est approximativement de 1:2500 à 1:5000
Néanmoins, elle dépend des circonstances géographiques, par exemple dans certaines régions d’Italie (Padoue, Venise) et de Grèce (île de Naxos), la prévalence est augmentée(2). Elle représente 5 à 10 % des morts subites cardiaques inexpliquées chez les individus de moins de 65 ans(3).
Il survient chez les jeunes adultes avec un rapport homme/femme de 2,7/1. Après la cardiopathie hypertrophique, c’est la première cause de mort subite cardiaque chez les jeunes.
3 – Diagnostic
Le diagnostic de la MAVR est souvent difficile car il n’existe pas de test unique. Le diagnostic est basé sur la présence de facteurs structurels, histologiques, électrocardiographiques et génétiques selon le rapport du groupe de travail de McKenna et al (5) de 1994 (tableau 1) et une modification du groupe de travail par Homid et al (6) (tableau 2) pour augmenter la sensibilité diagnostique des membres de la famille au premier degré pour la détection précoce de la maladie.
A) Histoire clinique
D’abord, nous allons commencer avec l’outil le plus facile, c’est-à-dire l’histoire clinique.
La présentation clinique varie de formes asymptomatiques à des palpitations, de la fatigue, des syncopes ou même des arrêts cardiaques généralement à l’effort. Ces symptômes sont dus à des battements ventriculaires ectopiques, à une tachycardie ventriculaire soutenue de configuration bloc de branche gauche ou à une insuffisance ventriculaire droite(4).
On peut identifier quatre étapes dans l’histoire naturelle de cette maladie(7):
a) la phase précoce ou silencieuse, c’est une phase subclinique avec des anomalies structurelles dissimulées
b) la phase instable avec un trouble électrique
c) la phase d’insuffisance ventriculaire droite
d) la phase finale avec une insuffisance biventriculaire progressive, mimant une cardiomyopathie dilatée
B) Test diagnostique
1.- Electrocardiogramme
Il existe plusieurs caractéristiques ECG dans les critères de diagnostic de l’ARVD :
a) inversions de l’onde T dans V1 à V3 (critère de diagnostic mineur, mais l’une des anomalies ECG les plus courantes présente chez 85% des patients (8)
b) durée du QRS = 110 ms dans V1 à V3
c) onde Epsilon (potentiels électriques après la fin du complexe QRS). C’est un critère diagnostique majeur que l’on retrouve dans jusqu’à 30% des cas de MAVR.
D’autres marqueurs ECG de MAVR ont été rapportés : Dispersion du QRS et du QT, bloc pariétal défini comme une durée du QRS dans les dérivations V1 à V3 qui dépasse la durée du QRS dans la dérivation V6 de > 25 ms, une remontée prolongée de l’onde S dans les dérivations V1 à V3 = 55 ms (elle a été vue comme la caractéristique ECG la plus prévalente dans 95 % des cas d’ARVD8
2.- Imagerie myocardique
2.1 Echocardiographie
C’est la technique d’imagerie non invasive la plus utilisée mais elle n’est pas toujours la technique d’imagerie optimale chez les patients obèses et chez les patients souffrant d’emphysème pulmonaire.
L’échocardiographie est l’approche diagnostique initiale chez les patients suspectés d’être atteints de DRAV. Les principaux résultats sont (9):
– dilatation et hypokinésie du ventricule droit
– dilatation isolée de la voie de sortie du ventricule droit
– augmentation de la réflectivité de la bande modératrice
– anévrismes end-diastoliques
– akinésie-dyskinésie du segment inférobasal et de l’apex du ventricule droit
– trabécules apicaux proéminents
2.2. Angiographie de contraste du ventricule droit
Cette technique est considérée comme le standard de référence pour le diagnostic de l’ARVD (10). Elle consiste en des zones akinétiques-dyskinétiques localisées dans le triangle anatomique de la dysplasie. Cependant, en raison d’une technique invasive, de l’exposition aux rayons X, de la variabilité interobservateur, cette méthode n’est pas largement utilisée (9).
2.3 La tomographie assistée par ordinateur
La tomographie assistée par ordinateur est capable de diagnostiquer les patients atteints de DRAV. Dery et al11, ont été les premiers à démontrer un ventricule droit hypokinétique dilaté chez un patient atteint de DRAV.
Les indices d’ARVD sur la tomodensitométrie à faisceau d’électrons sont7:
– la présence de graisse épicardique ou de dépôts graisseux intramyocardiques
– des trabéculations bien visibles avec une faible atténuation
– un ventricule droit hypokinétique dilaté
– un aspect festonné de la paroi ventriculaire droite
À l’heure actuelle, la tomodensitométrie n’est pas la modalité d’imagerie optionnelle pour le dépistage initial en raison de la charge de rayonnement élevée.
2.4 Imagerie par résonance magnétique cardiovasculaire
La résonance magnétique (RM) est un excellent outil pour visualiser le ventricule droit, elle permet une évaluation tridimensionnelle de l’anatomie ventriculaire, des volumes et, comparée à d’autres techniques, elle peut mieux reconnaître le remplacement du tissu graisseux et fibro-graisseux myocardique, bien que l’infiltration graisseuse du ventricule droit ne soit pas exclusive de l’ARVD, car elle se produit dans plus de 50% des cœurs normaux chez les personnes âgées. Cependant, la présence d’un remplacement graisseux transmural ou d’un amincissement diffus du myocarde du ventricule droit doit être considérée comme un critère majeur pour le diagnostic de l’ARVD.
La RM peut également être utilisée pour évaluer la fonction systolique et diastolique. Plusieurs études ont abordé la présence d’une dysfonction diastolique du ventricule droit comme un marqueur précoce de la maladie (12)
Les critères typiques qui peuvent être démontrés avec la RM sont :
– présence de zones à haute intensité de signal indiquant la substitution du myocarde par de la graisse (critère majeur)
– remplacement fibro-graisseux qui entraîne un amincissement diffus du myocarde du ventricule droit (critère majeur)
– anévrisme du ventricule droit et de la voie de sortie du ventricule droit (critère majeur)
– dilatation du ventricule droit et de la voie de sortie du ventricule droit (lorsqu’elle est sévère, critère majeur ; lorsqu’elle est légère, critère mineur)
– anomalies de la contraction régionale (critère mineur)
– dysfonction systolique globale (critère majeur) et dysfonction diastolique globale (critère mineur)
L’imagerie par résonance magnétique cardiovasculaire fournit des critères anatomiques, morphologiques, fonctionnels et de dynamique des flux importants pour le diagnostic du DRAV, bien que le diagnostic du DRAV doive être posé sur la base des critères du groupe de travail et non sur les seules anomalies structurelles.
2.5 Biopsie endomyocardique
Le diagnostic histologique est définitif, cependant la biopsie endomyocardique est controversée en raison de la nature segmentaire de la maladie et les échantillons sont généralement obtenus à partir du septum (13). Des complications peuvent survenir comme la tamponnade et la perforation.
4 – Prise en charge des patients atteints de DRAV
Avant tout traitement, il faut connaître les prédicteurs de mortalité et la stratification du risque. L’étude de Hulot et al (14) a montré qu’au moins 1 épisode de tachycardie ventriculaire du bloc de branche gauche, des signes cliniques d’insuffisance ventriculaire droite et de dysfonctionnement ventriculaire gauche étaient associés aux décès cardiovasculaires.
Le problème est que l’apparition de la mort subite n’est pas liée à la progression de la maladie et que la mort subite pourrait être la première manifestation de la maladie.
1.- Médicaments antiarythmiques
Les médicaments antiarythmiques sont le traitement initial et le plus couramment utilisé. Les bêta-bloquants sont recommandés pour réduire les arythmies stimulées par les adrénergiques.
Le médicament le plus efficace est le sotalol. Le sotalol a été plus efficace que les agents bêta-bloquants ou l’amiodarone chez les patients présentant une tachycardie ventriculaire (TV) inductible et non inductible administrée à des doses allant de 320 à 480 mg/jour (le sotalol a empêché la TV pendant la stimulation ventriculaire programmée chez 68% alors que l’amiodarone 26% et les classes Ia et Ib 5,6% et la classe Ic seulement chez 3% des patients). (15).
2.- Ablation par cathéter
L’ablation par radiofréquence (RF) est utilisée en cas de tachycardie ventriculaire réfractaire/intolérante aux médicaments ou incessante. L’objectif de l’ablation par radiofréquence est d’éliminer les voies de conduction. Elle n’est associée à un succès complet que dans 30 à 65 % des cas. En raison de la nature progressive et diffuse de la maladie, il est difficile d’abolir des foyers arythmogènes multiples16.
Le substrat patologique est enregistré pendant l’étude électrophysiologique sous la forme d’un signal endocardique fractionné de faible amplitude reflétant une diminution de la vitesse de conduction endocardique locale7.
3.- Traitement par cardioverteur-défibrillateur implantable
Les patients considérés à haut risque de mort cardiaque subite doivent recevoir un cardioverteur-défibrillateur implantable (DCI). Il s’agit de ceux qui 1) ont été réanimés après un arrêt cardiaque avec des antécédents de syncope, 2) présentent des arythmies menaçantes qui ne sont pas complètement supprimées par un traitement médicamenteux antiarythmique et 3) avec des antécédents familiaux d’arrêt cardiaque chez des parents du premier degré (prévention primaire).
Cependant, il peut y avoir des complications du traitement par DAI en raison du remplacement du myocarde du ventricule droit par de la graisse et du tissu fibrotique. Il s’agit notamment de la perforation causée par l’amincissement de la paroi du ventricule droit, de la difficulté à placer les sondes en raison d’amplitudes inadéquates de l’onde R ou de seuils de stimulation élevés, d’une détection ou d’une stimulation inadéquate pendant le suivi résultant de la progression de la maladie et de l’incapacité à mettre fin aux arythmies ventriculaires en raison de l’augmentation des seuils de défibrillation (18).
4.- Traitement de l’insuffisance cardiaque
Lorsque l’insuffisance ventriculaire droite ou biventriculaire apparaît, le traitement consiste en la thérapie actuelle de l’insuffisance cardiaque, y compris les diurétiques, les bêta-bloquants, les inhibiteurs de l’enzyme de conversion de l’angiotensine et les anticoagulants.
Le traitement curatif en cas d’insuffisance cardiaque congestive réfractaire et/ou d’arythmies est la transplantation cardiaque.
Figure 1. Enregistrement d’une onde epsilon post-excitation (flèches) dans les dérivations précordiales droites.
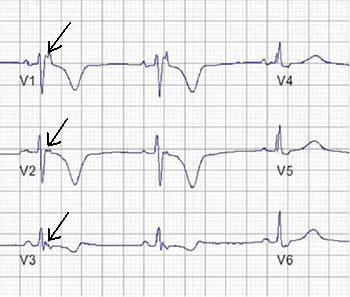
Figure 2. Enregistrement ECG à 12 dérivations d’une TV avec une morphologie de bloc de branche gauche
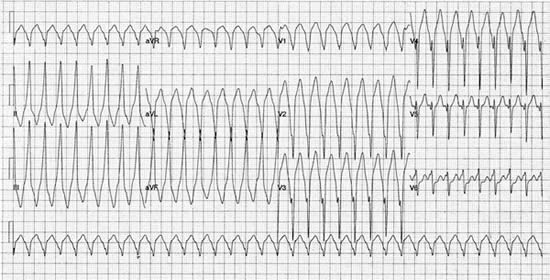
Tableau 1. Critères de diagnostic de la dysplasie du ventricule droitI Dysfonctionnement global et/ou régional et altérations structurelles
| Major | Dilatation sévère et réduction de la fraction d’éjection du ventricule droit sans atteinte du VG (ou seulement légère) |
| Anévrismes ventriculaires droits localisés (zones akinétiques ou dyskinétiques avec bombement diastolique) | |
| Dilatation segmentaire sévère du ventricule droit | |
| Mineure | Dilatation ventriculaire droite globale légère et/ou réduction de la fraction d’éjection avec ventricule gauche normal |
| Dilatation segmentaire légère du ventricule droit | |
| Hypokinésie ventriculaire droite régionale |
II Caractérisation tissulaire des parois
.
| Majeur | Remplacement fibreux du myocarde sur biopsie endomyocardique |
III Anomalies de repolarisation
| Mineur | Ondes T inversées dans les dérivations précordiales droites (V2 et V3) personnes âgées de plus de 12 ans ; en l’absence de bloc de branche droit |
IV Anomalies de dépolarisation/conduction
| Majeur | Ondes d’Epsilon ou allongement localisé (>110 ms) du complexe QRS dans les dérivations précordiales droites (V1-.V3) |
| Minor | Potentiels tardifs (moyenne du signal ECG) |
V Arythmies
| Minor | Tachycardie ventriculaire de type bloc de branche gauche (soutenue et non soutenue) (ECG, Holter, épreuve d’effort). |
| Fréquence des extrasystoles ventriculaires (plus de 1000/24h) |
VI Antécédents familiaux
| Majeur | Maladie familiale confirmée à l’autopsie ou en chirurgie |
| Mineure | Année familiale de mort subite prématurée (< 35 ans) due à une suspicion de dysplasie ventriculaire droite. |
| Histoire familiale (diagnostic clinique basé sur les critères actuels) |
Tableau 2. Modification proposée par le groupe de travail pour le diagnostic de la MAVR familiale
Mise en évidence de la MAVR chez un parent du premier degré plus l’un des éléments suivants :
| 1.- ECG | Inversion de l’onde T dans les dérivations précordiales droites (V2 et V3) |
| 2.- SAECG | Potentiels tardifs observés sur l’ECG à moyenne de signal (SAECG) |
| 3.- Arythmie | VT de type BBB sur l’ECG, le monitorage Holter ou lors d’un test d’effort. Extrasystoles >200 sur une période de 24 heures |
| 4.- Anomalie structurelle ou fonctionnelle du VR | Dilatation globale légère du VR et/ou réduction de la FE avec LV normale Dilatation segmentaire légère du VR Hypokinésie régionale du VR |
Le contenu de cet article reflète l’opinion personnelle de l’auteur/des auteurs et ne représente pas nécessairement la position officielle de la Société européenne de cardiologie
.