Dans ce post, nous présentons les carbamates comme un groupe protecteur utile pour les amines, en particulier dans le contexte de la fabrication de peptides.
Voici une image récapitulative rapide de ce que nous allons aborder dans ce post, avec plus de détails ci-dessous.
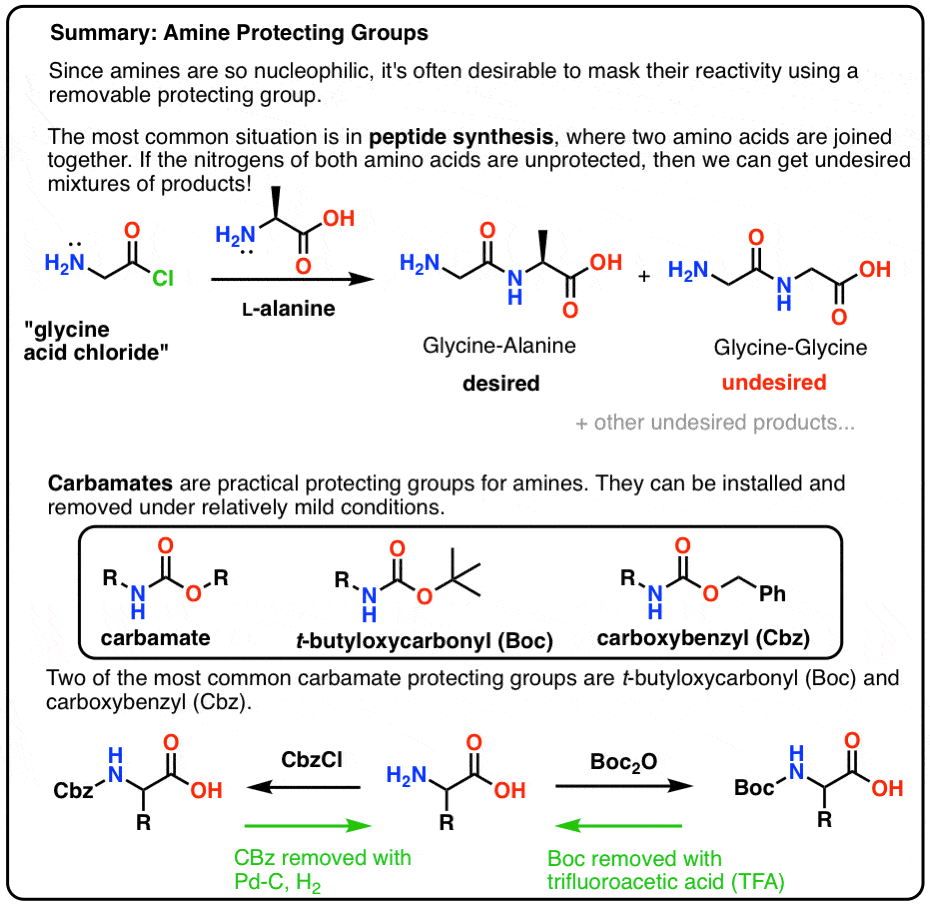
Table des matières
- Une introduction à la synthèse peptidique simple
- Mélangeons un lot de Gly-Ala
- Un très mauvais plan initial
- « Hark ! Qu’est-ce que c’est que cette merde ? »
- Un chapeau de protection pour le NH2
- Mate ! Utilisez un carbamate, mon pote !
- Boc et CBz sont les genoux des abeilles
- Installation et retrait du groupe protecteur « Boc »
- Installation et retrait du groupe protecteur carbamate CBz (ou « Z »)
- Synthèse simple de peptides à l’aide de groupes protecteurs carbamates
- Ça continue…
- Notes
- (Avancé) Références et lectures complémentaires
Une introduction à la synthèse peptidique simple
Dans un billet récent, nous avons parcouru 3 façons courantes de faire des amides :
- Ajout d’amines à des halogénures d’acyle / anhydrides
- Hydrolyse partielle de nitriles
- Couplage d’acides carboxyliques avec des amines en utilisant un agent déshydratant comme le DCC (N,N’-dicyclohexylcarbodiimide).
Ce qui manquait dans ce post, c’était la mention de la synthèse de l’arrière-grand-mère des liaisons amides les plus utiles connues de l’humanité, et je veux dire par là les peptides.
Une liaison peptidique est le nom que l’on donne à la liaison amide qui unit deux acides aminés.
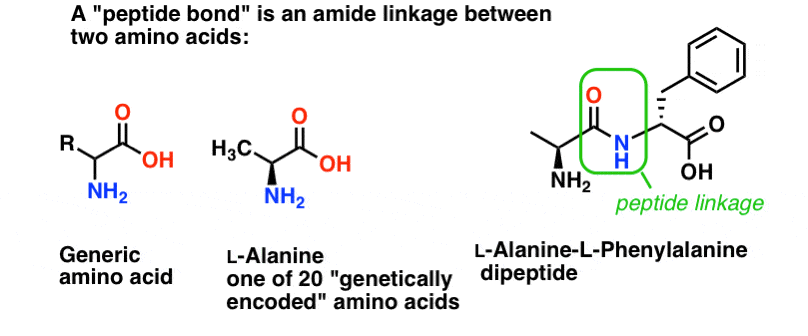
Et les acides aminés sont importants parce que… attendez. Vous savez déjà pourquoi les acides aminés sont importants, non ? Si vous ne le savez pas maintenant, revenez après avoir lu ceci.
Mélangeons un lot de Gly-Ala
Essayons d’appliquer certaines de nos nouvelles compétences en synthèse d’amide pour essayer de construire un dipeptide vraiment simple, la glycine-alanine. Si nous pouvons construire un dipeptide simple maintenant, nous pouvons utiliser ce que nous avons appris pour montrer comment des peptides encore plus complexes sont fabriqués dans un post ultérieur. Saviez-vous que le lauréat du prix Nobel Bruce Merrifield a synthétisé l’insuline en joignant un acide aminé à la fois ? Oui, vraiment.
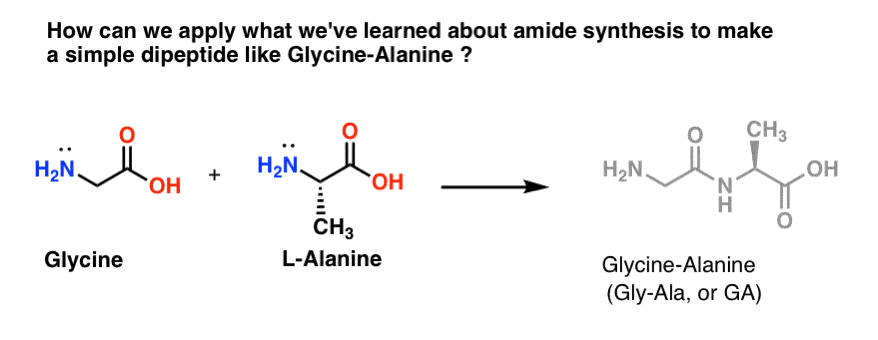
Parmi les trois méthodes que nous avons listées pour fabriquer des amides, seules deux sont potentiellement utiles pour former des liaisons peptidiques : 1) la méthode du chlorure d’acide, ou 2) la synthèse via un agent de couplage comme le DCC. .
3. Un très mauvais plan initial
Notre premier coup de poignard à la synthèse peptidique impliquera de foncer avec un plan d’attaque très naïf et d’espérer que tout se passe bien à la fin. Accrochez-vous les amis, car ça va devenir compliqué.
Nous allons commencer par proposer la méthode du chlorure d’acide pour la synthèse du Gly-Ala.
En partant du dipeptide Gly-Ala, notre plan nous ferait synthétiser la liaison peptidique par la réaction de l’alanine avec le chlorure d’acide dérivé de la glycine:
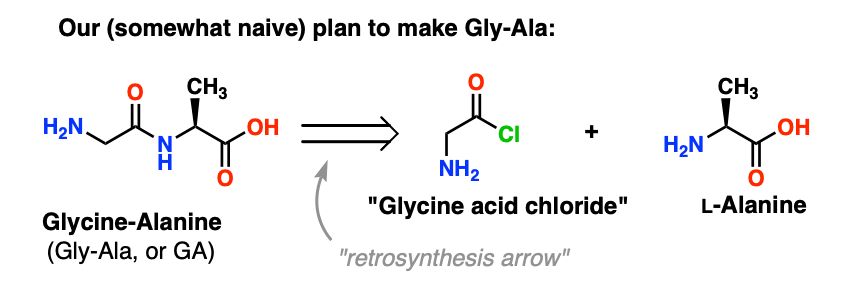
Il y a un léger problème avec ce plan. Il peut être un peu difficile à repérer au début.
Supposons que nous avons fabriqué le chlorure d’acide de la glycine* , et que nous avons le « chlorure d’acide de la glycine » et l’alanine ensemble dans le même flacon, ainsi qu’un peu de base en excès pour accélérer les choses.
Nous allons dessiner la réaction dans le sens direct:
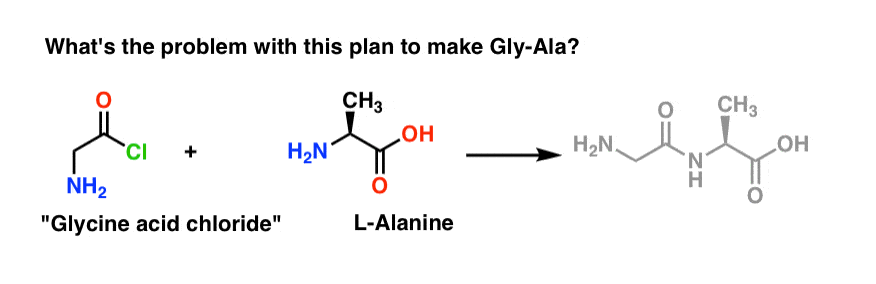
Qu’est-ce qui pourrait mal tourner ?
« Hark ! Quelle merde est-ce ? «
Notre plan est de faire une solution du chlorure d’acide de glycine (1 équivalent molaire), puis de le faire attendre patiemment dans le flacon jusqu’à ce que nous ajoutions un équivalent molaire d’alanine, après quoi il réagirait avec le groupe NH2 nucléophile de l’alanine.
Le problème avec notre plan est que nous n’avons pas affaire à une seule molécule de « chlorure d’acide de glycine » – nous avons affaire à quelque chose autour d’une mole (6,02 x 1023 molécules) de celui-ci. Et le chlorure d’acide de glycine a déjà un groupe NH2 nucléophile !
« Le chlorure d’acide de glycine » tel qu’il est dessiné, n’est pas une molécule stable, car il peut réagir avec lui-même.
Ce qui signifie qu’une solution de chlorure d’acide de glycine laissée à elle-même formerait un polymère de glycine, avec la structure Gly-Gly-Gly-Gly…
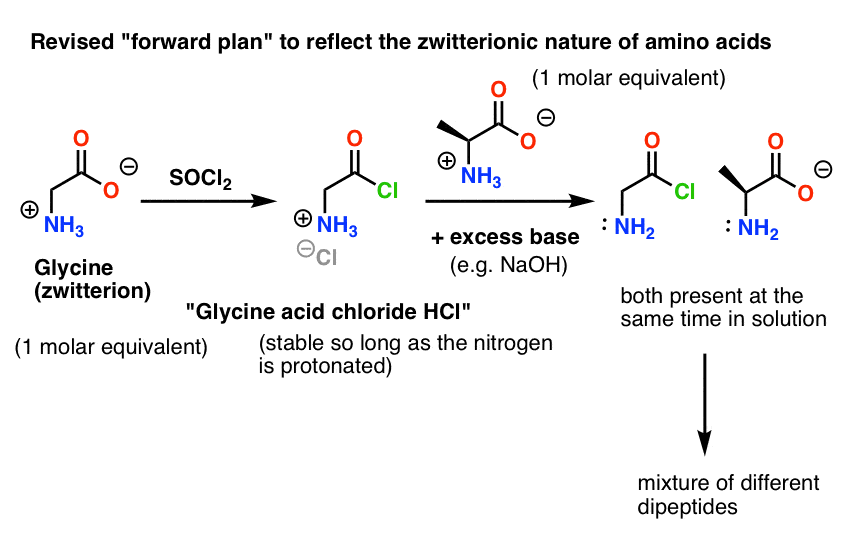
Même une solution de chlorure d’acide de glycine en présence d’alanine formerait non seulement le Gly-Ala désiré, mais aussi le Gly-Gly (avec un halogénure d’acyle attaché) qui peut aller faire plus de mal avec un autre nucléophile, que ce soit Gly ou Ala :
(et non, il n’y a pas grand chose pour distinguer le NH2 du « chlorure d’acide de glycine » du NH2 de l’alanine. Ils sont à peu près aussi réactifs.)
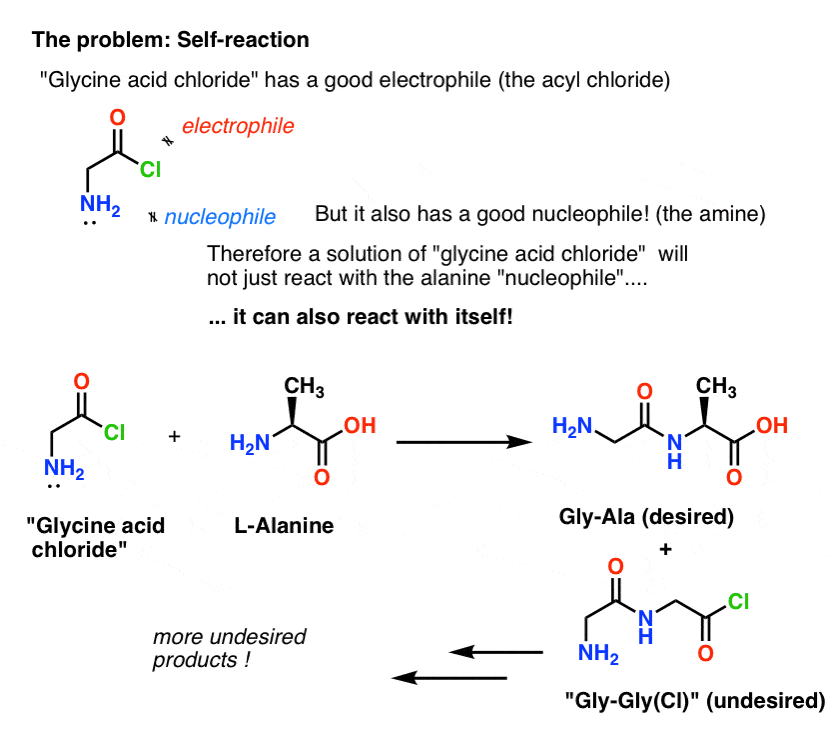
La leçon ici est que lorsque vous avez une solution d’une molécule contenant à la fois un nucléophile et un électrophile, elle peut s’autoréagir. Il existe un nom pour ce processus qui peut sembler familier : la polymérisation.
Alors, comment empêcher que cela se produise ?
Un chapeau protecteur pour NH2
La meilleure façon est de « coiffer » l’azote d’une manière ou d’une autre avec un groupe protecteur (PG) qui rend le groupe NH2 non nucléophile. Il doit également avoir les propriétés suivantes :
- facilement et sélectivement installé
- inerte aux conditions de réaction souhaitées (par exemple. SOCl2 pour faire le chlorure d’acide à partir de l’acide carboxylique)
- facilement et sélectivement retiré sans affecter le produit final
Nous avons déjà vu des stratégies de groupes protecteurs, en particulier avec des alcools et l’utilisation de réactifs de Grignard.
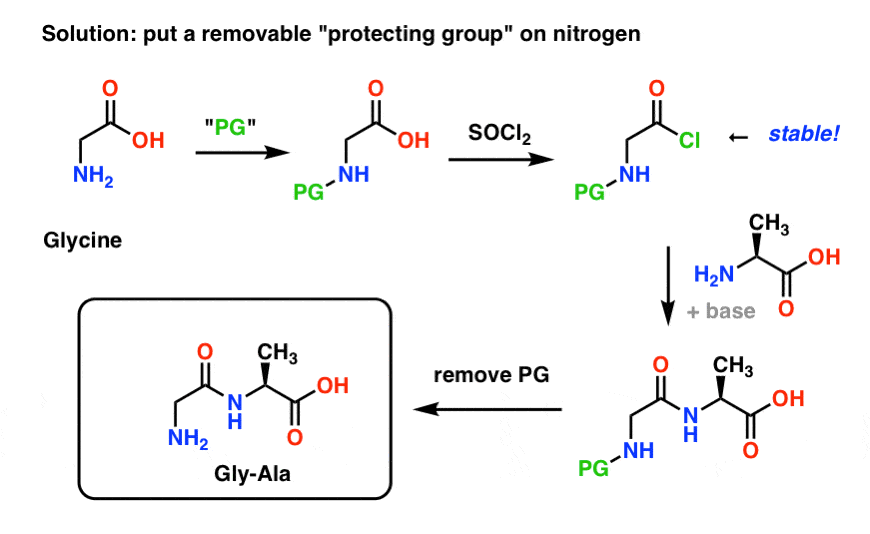
Voici à quoi pourrait ressembler une stratégie de groupes protecteurs pour notre synthèse de « Gly-Gly ». On installe un groupe protecteur (« PG ») sur la glycine, puis on fabrique le chlorure d’acide. Le PG doit être choisi de manière à rendre l’azote non nucléophile (c’est-à-dire qu’il ne réagira pas avec le chlorure d’acide).
Nous pouvons ensuite former notre liaison peptidique avec l’alanine non protégée, puis enlever le PG dans des conditions douces.
Une stratégie de groupe protecteur pour l’azote que nous avons déjà explorée est la synthèse de Gabriel, qui utilise le phtalimide (vous pouvez considérer un phtalimide comme un azote protégé). Cette méthode a en fait été utilisée pour synthétiser la Gly-Gly (« glycylglycine ») ! Un des problèmes, cependant, est que des conditions relativement dures (chaleur ample) sont nécessaires pour installer et enlever le groupe phtalimide, et ce n’est pas un environnement très sain pour la survie des acides aminés sensibles et chiraux, qui peuvent facilement se racémiser.
Un autre choix potentiel est de protéger l’azote comme un amide, mais les amides de clivage peuvent exiger des conditions dures aussi. En outre, puisque nous essayons de forger une liaison amide (peptide) ici de toute façon, nous pourrions avoir des problèmes de sélectivité avec son retrait – détruisant le village afin de le sauver.
Mate ! Utilisez un carbamate, mon pote !
Le choix le plus populaire de groupe protecteur pour l’azote de l’amine est le groupe fonctionnel carbamate. Un carbamate ressemble à l’enfant bâtard d’un ester et d’un amide, avec N et O flanquant un carbonyle.
L’azote d’un carbamate est relativement non-nucléophile, et de plus, les carbamates sont :
- facilement installés sur l’azote
- inertes à une grande variété de conditions réactionnelles
- facilement éliminés sans affecter les groupes amides existants
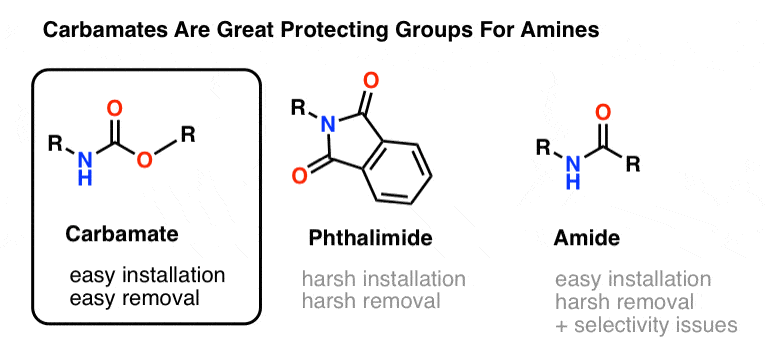
Ce qui les rend parfaits pour nos objectifs.
Boc et CBz sont les genoux des abeilles
Deux groupes protecteurs de carbamate populaires sont Boc (t-Butyloxycarbonyle) et CBz (carboxybenzyle).
Pour nos besoins, ces deux groupes protecteurs peuvent être considérés comme plus ou moins équivalents, car l’un ou l’autre peut être utilisé efficacement pour la synthèse peptidique.
La différence essentielle réside vraiment dans la façon dont ils sont éliminés (c’est-à-dire l’étape de « déprotection »). Le choix entre l’un ou l’autre devient crucial une fois que vous avez une molécule complexe avec de multiples groupes protecteurs ; cela entre dans la catégorie de la « stratégie synthétique avancée », qui est plus un sujet pour Org 3.
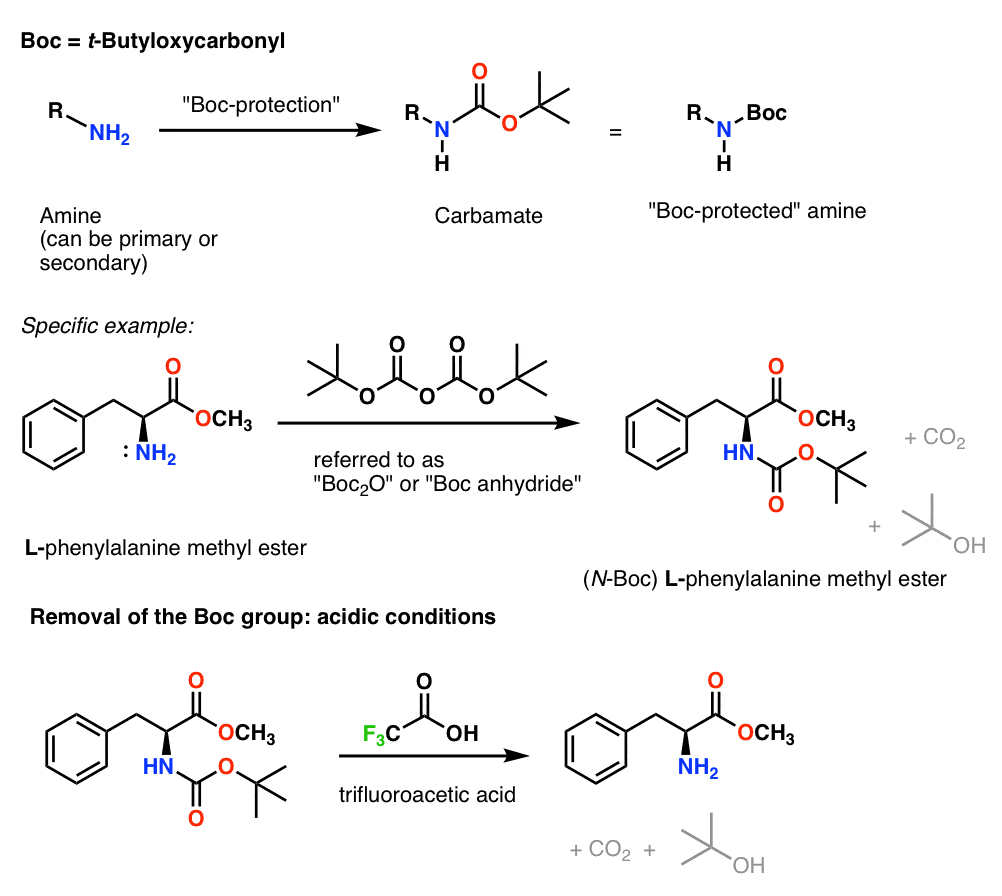
Installation et retrait du groupe protecteur « Boc »
Le groupe Boc est généralement installé avec « Boc2O » (parfois appelé « anhydride Boc »), et est retiré avec un acide. Le choix habituel est l’acide trifluoroacétique (TFA) « pur » (c’est-à-dire non dilué), qui éclate les groupes Boc très proprement, libérant du CO2 et de l’alcool t-butylique.
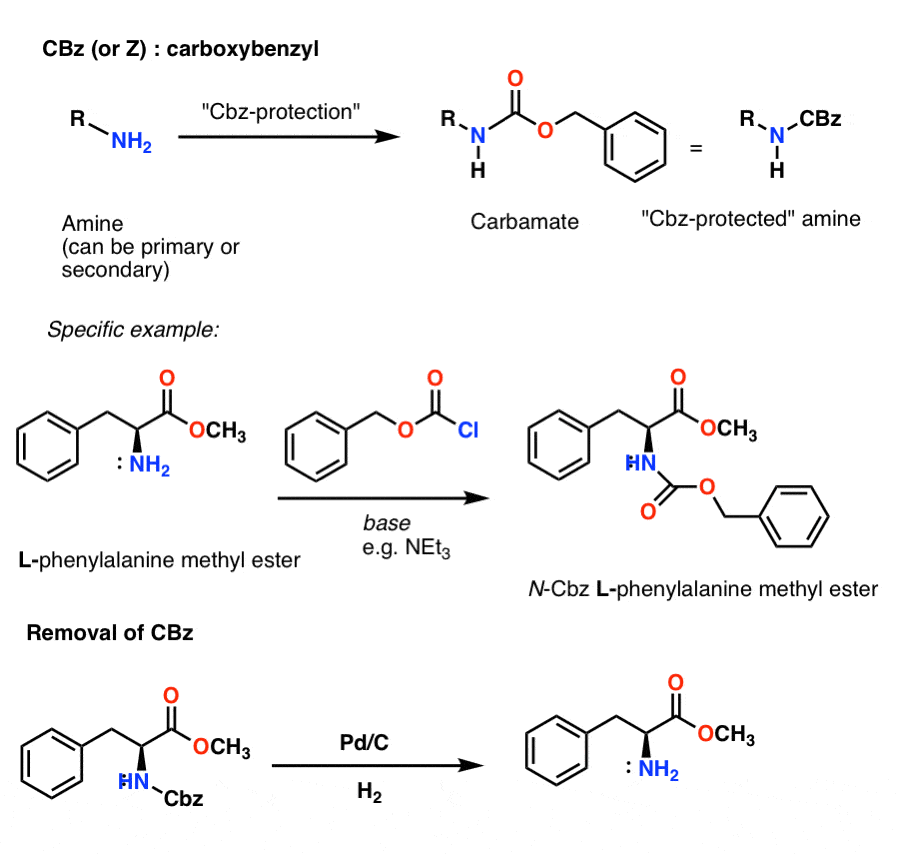
Installation et élimination du groupe protecteur carbamate CBz (ou « Z »)
Le groupe Cbz (parfois encore abrégé en « Z ») peut être installé avec CbzCl et une base douce, et est généralement éliminé par hydrogénation catalytique (Pd-C/H2). Cette opération est extrêmement douce et présente l’avantage de se produire à pH neutre, laissant seuls les groupes fonctionnels sensibles aux acides ou aux bases.
Une synthèse peptidique simple utilisant des groupes protecteurs carbamate
Revenons à la synthèse peptidique et appliquons cette stratégie de groupe protecteur pour fabriquer Gly-Ala.
Nous commençons par un acide aminé comme la L-alanine. En traitant l’alanine avec Boc2O, nous obtenons la L-alanine protégée par N-Boc. L’étape suivante consiste à former un chlorure d’acide en utilisant SOCl2. Une fois formé, nous ajoutons ensuite notre amine (par exemple la L-valine) en présence d’un excès de base, formant ainsi notre liaison amide clé. L’étape finale pour donner le dipeptide est de déprotéger l’amine protégée par Boc avec de l’acide trifluoroacétique (TFA), et voilà ! nous avons notre dipeptide.
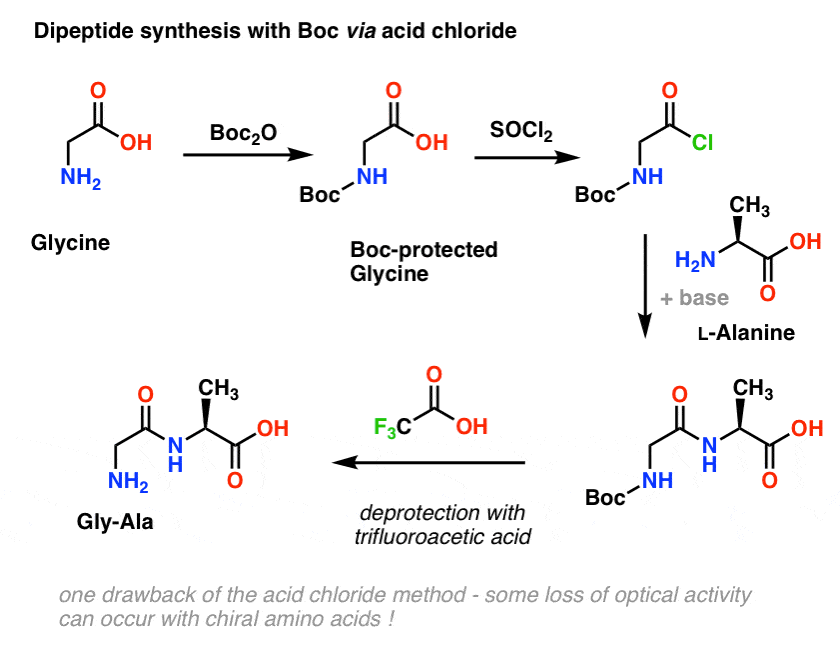
Bien que cette méthode puisse être bonne sur le papier, un problème de l’utilisation des chlorures d’acide en pratique est que les acides aminés chiraux perdent souvent leur pureté optique par cette méthode, un processus parfois appelé « racémisation », mais plus correctement appelé « épimérisation » (techniquement plus correct, car un hydrogène sur un centre chiral est inversé)
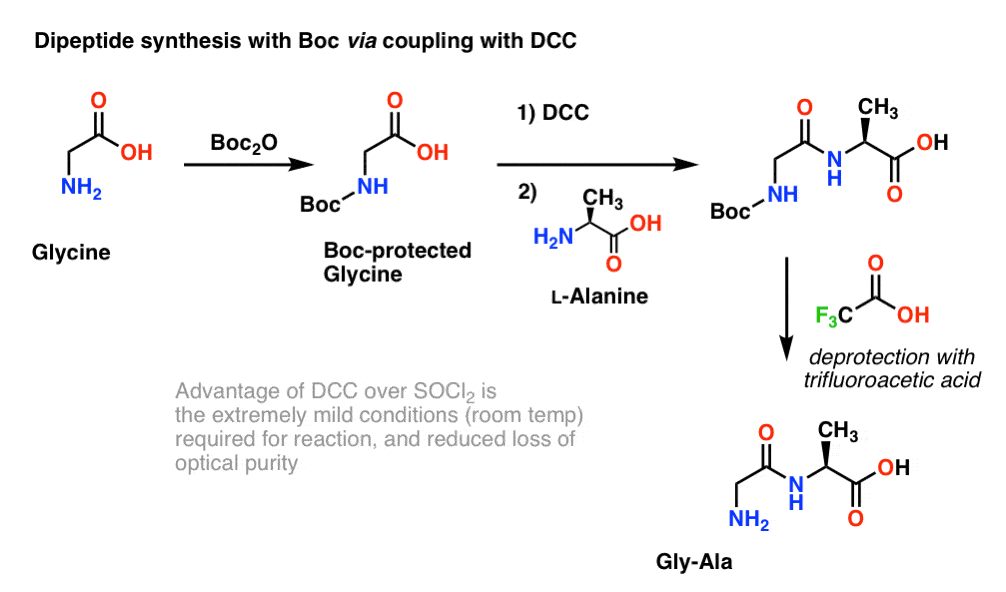
Puisque la chiralité des acides aminés est essentielle pour leur fonction biologique, un protocole légèrement plus doux est généralement utilisé qui emploie le DCC ou un réactif de couplage similaire.
Ici, nous traitons la glycine protégée par Boc avec du DCC pour activer l’acide carboxylique. Puis nous ajoutons notre acide aminé nucléophile (L-alanine) qui forme le dipeptide. Si nous voulons isoler le dipeptide Gly-Ala à ce stade, nous pouvons alors éliminer le groupe Boc avec du TFA.
(note sur ce schéma)
It Keeps Going…
Notez que si nous voulions faire un tri-peptide, nous pouvons juste continuer à effectuer des cycles d’ajout de DCC (pour activer l’acide carboxylique) suivi de l’ajout de nouveaux acides aminés, construisant le peptide une unité à la fois !
Il existe une méthode particulièrement efficace pour construire des peptides plus longs, dont Bruce Merrifield a été le pionnier (et qui a été appliquée à la synthèse de l’insuline, entre autres), appelée synthèse peptidique en phase solide, que nous couvrirons la prochaine fois que nous aborderons ce sujet.
Notes
Note 1. Similaire à la vieille blague sur l’économiste qui propose un plan pour quitter une île déserte:
« Supposons que nous avons un bateau ».
La glycine (comme tous les acides aminés) est elle-même un zwitterion. Le traitement de la glycine avec SOCl2 devrait donner le chlorure d’acide avec une amine protonée. Ceci devrait être relativement stable en solution tant qu’aucune base n’est ajoutée.
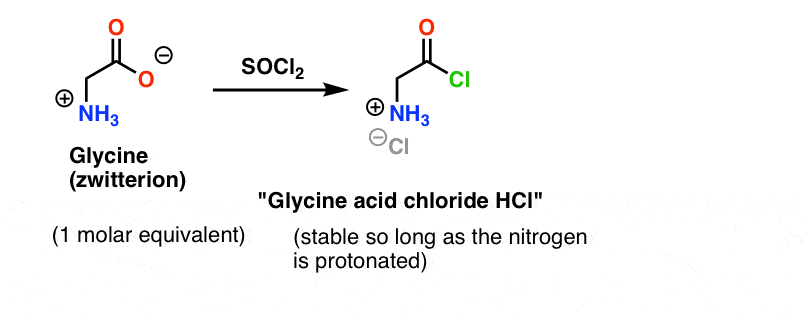
Voici le problème. Puisque notre acide aminé nucléophile (l’alanine) est également zwitterionique, aucune réaction ne peut se produire jusqu’à ce qu’un excès de base soit ajouté pour libérer une paire solitaire sur l’azote de l’alanine. Après l’ajout de la base, nous avons le « chlorure d’acide de glycine » et l’alanine ensemble en solution. Il n’y a pas de différence appréciable de nucléophilie entre les azotes de ces deux espèces, et chacune d’elles va entrer en compétition pour réagir avec le nucléophile chlorure d’acide, ce qui conduit à un mélange de Gly-Ala et de Gly-GlyCl, et le Gly-GlyCl peut ensuite réagir encore avec les divers nucléophiles préétablis en solution pour donner des peptides tri-, tétra- et supérieurs.
Note 2. John Sheehan, que nous avons rencontré plus tôt en tant qu’inventeur du DCC en route vers le premier à synthétiser la pénicilline, a également fait du Gly-Gly protégé par un phtalyl par une synthèse Gabriel:
Référence ici (JACS, 1949, 71, 1856)
Note 3. Un autre problème avec l’utilisation de groupes protecteurs amides est la formation d’azlactone, qui peut conduire à l’épimérisation des acides aminés chiraux. Voir aussi cet ensemble de problèmes.
Note 4. « Groupes protecteurs orthogonaux ». Dans la planification synthétique, il est souvent d’une importance cruciale d’avoir des groupes protecteurs qui sont amovibles dans des conditions distinctes. Cette propriété est souvent appelée « orthogonalité »
Par exemple, dans le dipeptide suivant, nous avons deux groupes protecteurs différents sur l’azote – un Boc et un CBz. En sélectionnant des groupes protecteurs « orthogonaux », chaque azote est adressable – nous pouvons choisir quel groupe protecteur enlever, et notre synthèse peut continuer à partir de là. Cela évite de se retrouver dans une situation où nous avons deux amines non protégées et devons compter sur le fait que l’une est plus réactive que l’autre. Ces approches fonctionnent très rarement !
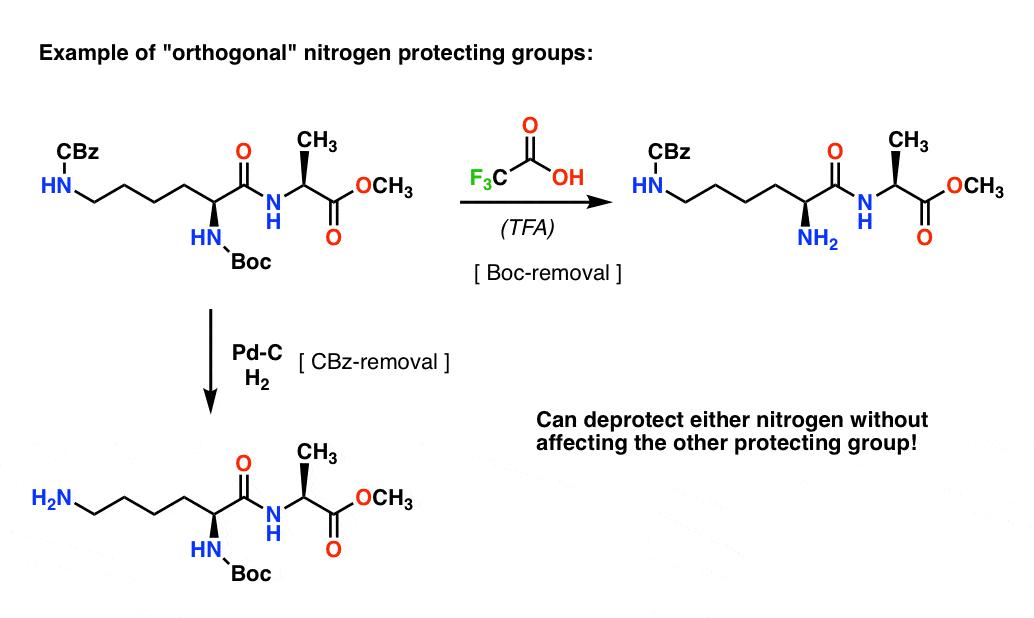
Une note – pour la simplicité ici l’alanine est représentée avec un acide carboxylique libre, mais une approche légèrement meilleure serait d’utiliser l’ester méthylique de l’alanine pour éviter tout auto-couplage entre l’amine libre de l’alanine et l’acide carboxylique libre.
Mate…
(Avancé) Références et lectures complémentaires
Les carbamates sont utiles comme groupes protecteurs pour les amines, et les plus couramment employés sont -Boc, -Cbz, et -Fmoc.
- Über ein allgemeines Verfahren der Peptid-Synthese
Max Bergmann et Leonidas Zervas
Ber. 1932, 65 (7), 1192-1201
DOI : 10.1002/cber.19320650722
Le groupe protecteur -Cbz (carboxybenzyle) a été utilisé pour la première fois par Max Bergmann et Leonidas Zervas en 1932 pour la synthèse de peptides, et est parfois abrégé « -Z » en l’honneur de Zervas. - Élimination des groupes protecteurs t-butyle et t-butoxycarbonyle avec l’acide trifluoracétique
Mécanismes, formation de biproduits et évaluation des capteurs
Behrend F. Lundt, Nils L. Johansen, Aage Vølund et Jan Markussen
J. Pept. Prot. Res. 1978, 12 (5), 258-268
DOI : 10.1111/j.1399-3011.1978.tb02896.x
En pratique, des piégeurs nucléophiles (par exemple des thiols) sont généralement ajoutés au cocktail acide (TFA) lors de la déprotection, car la déprotection du Boc donnera des espèces t-butyle électrophiles (par exemple le trifluoroacétate de t-butyle) qui peuvent réagir avec des résidus sensibles (par exemple Trp ou Cys). - Méthode de synthèse de longues chaînes peptidiques utilisant une synthèse de l’ocytocine comme exemple
Miklos Bodanszky et Vincent du Vigneaud
Journal of the American Chemical Society 1959, 81 (21), 5688-5691
DOI : 1021/ja01530a040
Dans la première moitié du 20ème siècle, la synthèse peptidique était réalisée en utilisant des techniques standard de chimie organique en phase solution. On parle maintenant de LPPS (synthèse peptidique en phase liquide). du Vigneaud a reçu le prix Nobel de chimie en 1955 pour avoir montré que la synthèse peptidique pouvait être réalisée, en utilisant le bon choix de groupes protecteurs et de stratégies de synthèse. - Formation temporaire du cycle AZLACTONE lors de la RACEMISATION de dérivés acyliques d’acides aminés avec de l’ANHYDRIDE ACÉTIQUE
Vincent du Vigneaud et Curtis E. Meyer
Biol. Chem. 1932, 99:143-151
http://www.jbc.org/content/99/1/143.citation
Un autre problème lié à l’utilisation de groupes protecteurs d’amides est la formation d’azlactone, qui peut conduire à l’épimérisation des acides aminés chiraux. - Une nouvelle voie de synthèse des peptides
John C. Sheehan et Victor S. Frank
Journal of the American Chemical Society 1949, 71 (5), 1856-1861
DOI : 10.1021/ja01173a095
John Sheehan, l’inventeur du DCC en route pour la première synthèse de la pénicilline, a également fabriqué du Gly-Gly protégé par un phtalyle par une synthèse de Gabriel. - Une nouvelle méthode de formation de liaisons peptidiques
John C. Sheehan et George P. Hess
Journal of the American Chemical Society 1955, 77 (4), 1067-1068
DOI : 1021/ja01609a099
Article original sur la synthèse des liaisons peptidiques/amides en utilisant le DCC. - Fonction 9-fluorénylméthoxycarbonyle, un nouveau groupe amino-protecteur sensible aux bases
Louis A. Carpino et Grace Y. Han
Journal of the American Chemical Society 1970, 92 (19), 5748-5749
DOI : 10.1021/ja00722a043 - Groupe protecteur 9-Fluorénylméthoxycarbonyl amino
Louis A. Carpino et Grace Y. Han
The Journal of Organic Chemistry 1972 37 (22), 3404-3409
DOI : 10.1021/jo00795a005
La découverte et le développement du groupe protecteur -Fmoc pour les amines ajoute une autre couche d’orthogonalité aux stratégies de protection/déprotection des amines. Le groupe -Fmoc est labile aux bases et, dans la synthèse des peptides, il est généralement éliminé avec 20 % de pipéridine dans du DMF. Cbz est éliminé par hydrogénation, -Boc éliminé avec un acide, et -Fmoc avec une base.