Homme de 30 ans présentant une vision centrale floue
Alex W. Cohen, MD, PhD et Jordan M. Graff, MD
Le 9 mars 2008
Mise à jour par Lindsay K. McConnell, MD
Le 8 mai 2017
Plainte principale : Vision centrale floue dans l’œil gauche.
Histoire de la maladie actuelle : Un homme blanc de 30 ans a remarqué une distorsion visuelle centrale et une perte de vision dans l’œil gauche (OS) au cours des dernières semaines. Son optométriste local l’a dirigé vers le département d’ophtalmologie et des sciences visuelles de l’Université de l’Iowa pour une évaluation plus approfondie.
Histoire oculaire antérieure : Aucun.
Histoire médicale : Le patient n’a pas signalé de maladies systémiques antérieures ou de maladies.
Médicaments : Aucun.
Histoire familiale : Aucune maladie oculaire familiale et autrement non contributive.
Histoire sociale : Marié, vit avec sa femme. Il travaille comme programmeur informatique. Le patient a vécu dans la vallée du fleuve Mississippi pendant toute sa vie.
Examen oculaire :
- Acuité visuelle, sans correction : Oeil droit (OD)–20/20 ; OS–20/40
- Motilité : Complète, deux yeux (OU)
- Pression intraoculaire : OD — 15 mmHg ; OS — 16 mmHg
- Pupilles : Réactivité égale à la lumière. Pas de défaut pupillaire afférent relatif (RAPD)
- Champs visuels de confrontation (CVF) : Complets, OU
- Examen du segment externe et antérieur : Normal, OU
- Examen du fond d’œil dilaté (EFD) :
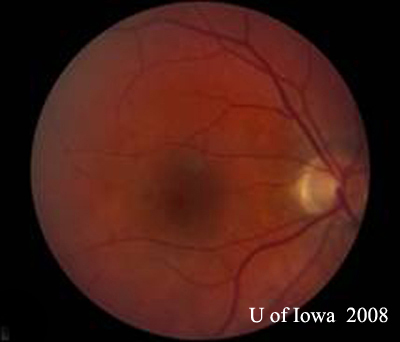
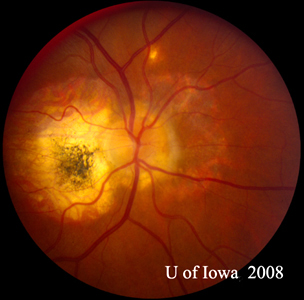
- OD : Vitré clair et nerf optique sain, sans pâleur ni œdème. Il existe une atrophie péripapillaire et une pigmentation sombre. Macula et vaisseaux normaux. En périphérie, il y a quelques cicatrices choriorétiniennes « poinçonnées ».
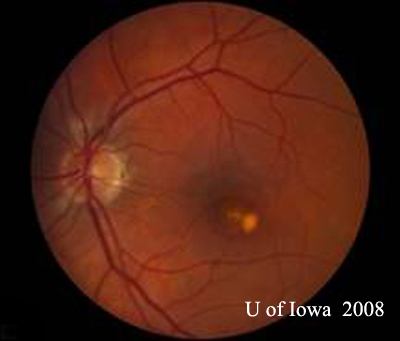
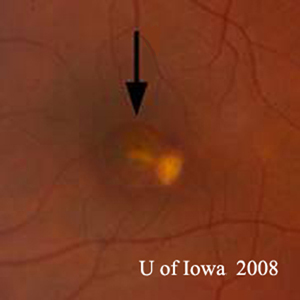
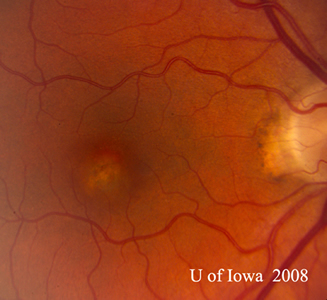
- OS : Vitré clair avec absolument aucune cellule ou signe d’inflammation. La tête du nerf optique est saine, sans pâleur ni œdème. Il y a une atrophie péripapillaire et une augmentation de la pigmentation. Dans la macula, il y a une lésion sous-rétinienne jaunâtre en relief (voir figures 1 et 2).
| A : photo du fond d’œil à 30 degrés, OD. Notez les changements atrophiques péripapillaires. | B : photo du fond d’œil à 30 degrés, OS. Des changements atrophiques et pigmentaires péripapillaires similaires sont évidents. Notez le « histospot » choriorétinien à l’intérieur de la macula et l’absence de toute inflammation vitréenne. |
 |
 |
|
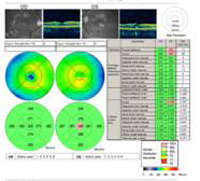
A : La tomographie par cohérence optique (OCT) des deux yeux montre une augmentation de l’épaisseur maculaire centrale (CMT) OS (295µm) par rapport à OD (205µm). A). |
B : Notez la présence de liquide sous-rétinien et la distorsion de la dépression fovéale, OS. |
 |
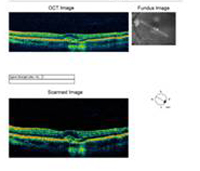 |
Course : Ce patient présente des antécédents et un aspect clinique fortement évocateurs du présumé syndrome d’histoplasmose oculaire (POHS). Bien que sa lésion maculaire épaisse et jaune ne soit pas parfaitement classique (voir la figure 5 et la discussion ci-dessous), tout porte à croire qu’une membrane néovasculaire choroïdienne (CNVM) s’est développée dans cette macula gauche au site d’une cicatrice choriorétinienne. Nous avons longuement discuté avec les patients des options de traitement, y compris des études cliniques établies pour le laser maculaire ou la thérapie photodynamique (PDT) de la lésion. De plus, le patient a été informé des premiers résultats de la littérature et de son expérience personnelle suggérant de bons résultats avec l’utilisation non autorisée du bevacizumab intravitréen (Avastin). Le patient a choisi l’injection intravitréenne, qui a été réalisée sans complication. Il a été revu quatre semaines après l’injection, date à laquelle sa vision s’était améliorée à 20/20 et la lésion rétinienne était sèche à la fois cliniquement et par OCT (figure 4).
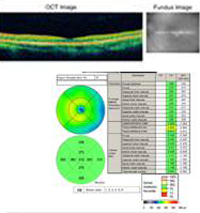
Discussion : Le syndrome d’histoplasmose oculaire présumé (POHS) est un diagnostic clinique posé sur la base d’une constellation d’observations oculaires qui ont été initialement décrites en 1960. Le syndrome est un trouble inflammatoire qui a été postulé comme résultant d’une infection systémique par le champignon dimorphe Histoplasma capsulatum. Il n’y a cependant pas eu d’études confirmant l’implication directe de ce champignon dans la pathogenèse de la maladie. Les données épidémiologiques suggèrent plutôt que la prévalence de la SHOP est fortement augmentée dans les régions où les organismes Histoplasma sont endémiques. Classiquement, les personnes vivant dans les vallées de l’Ohio et du Mississippi sont connues pour avoir un taux de 70 % de tests cutanés positifs pour l’exposition à H. capsulatum. En effet, la grande majorité des patients atteints de SHPO réagissent positivement à ce test cutané. Cependant, seuls 4,4 % environ des patients dont le test cutané est positif présentent des signes de SHPO. Par conséquent, la relation entre H. capsulatum et la SHPO reste présumée.
À noter que les patients atteints de SHOP sont souvent jeunes et par ailleurs en bonne santé et que les lésions rétiniennes peuvent produire une perte visuelle fonctionnelle importante dans cette population en âge de travailler.
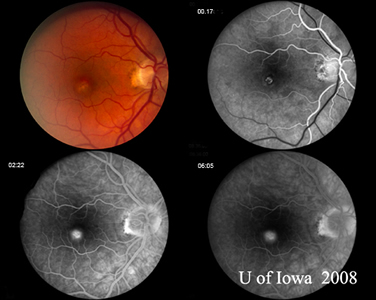
Le diagnostic de SHOP est posé sur la base de l’identification des résultats classiques du fond d’œil. Il s’agit de la présence d’une atrophie ou d’une pigmentation péripapillaire, de la présence de lésions atrophiques choriorétiniennes » poinçonnées » caractéristiques et de l’absence d’atteinte du vitré sus-jacent. On pense que les changements péripapillaires représentent une membrane néovasculaire choroïdienne (CNVM) régressée, et que les lésions « punched-out » représentent des zones d’ensemencement hématogène de H. capsulatum dans la rétine. Il convient de noter que de nombreuses cicatrices choriorétiniennes périphériques « perforées » peuvent également être associées à de petites CNVM qui ne sont pas signalées cliniquement et régressent spontanément. Des exemples classiques de ces lésions sont visibles sur la figure 5. Souvent, comme dans le cas présenté ici, le POHS se présente à l’attention de l’ophtalmologiste avec une CNVM symptomatique impliquant la macula ou la fovéa. Dans ce cas, la lésion maculaire était quelque peu inhabituelle avec une substance jaune épaisse, alors que le CNVM dans la POHS est souvent un filet en dentelle gris-vert provenant d’une cicatrice choriorétinienne (voir Figure 6) qui est défini tôt dans l’angiogramme et fuit tardivement.
| A : POHS chez un patient présentant une atrophie péripapillaire significative et un changement de pigmentation, démontrant l’apparition d’un CNVM péripapillaire régressé qui a été postulé comme la source de ces lésions. | B : cicatrices choriorétiniennes périphériques chez un patient atteint de POHS. |
 |
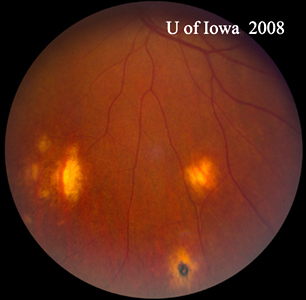 |
| A : CNVM maculaire gris-vert chez un patient atteint de SHOP | B : L’angiographie à la fluorescéine du patient de la figure 6A démontre un motif de fuite classique associé au CNVM chez le patient atteint de SHOP. |
 |
 |
La pathogénie du CNVM est inconnue ; cependant, plusieurs auteurs ont suggéré qu’après la propagation hématogène des organismes à la rétine, des zones d’inflammation focale se produisent, conduisant à une perturbation de la membrane de Bruch, et prédisposant ainsi à la formation du CNVM. On a également avancé l’hypothèse selon laquelle le SHOP serait le résultat d’un déclenchement auto-immun, stimulé par la présence de l’organisme infectieux. Dans tous les cas, les patients sont généralement identifiés alors qu’ils sont asymptomatiques (minorité) ou attirent l’attention d’un ophtalmologiste en se plaignant d’une baisse de la vision.
Le traitement de la SHOP a évolué au cours des dernières années, et bien qu’il n’existe pas de thérapie directe pour cibler l’organisme, plusieurs modalités ont été identifiées comme bénéfiques dans le traitement du CNVM qui l’accompagne. Historiquement, la photocoagulation au laser a permis d’inhiber les lésions extrafovéales, juxtafovéales et péripapillaires classiques et bien définies de la SHPO. Cependant, le scotome central qui en résultait était parfois inacceptable au regard des nouvelles options thérapeutiques. La thérapie photodynamique (TPD) à la vertéporfine a été approuvée par la FDA pour le traitement des CNVM liés à la SHPO fin 2001 et s’est avérée sûre et efficace pour traiter la maladie. Une fois que les agents anti-VEGF se sont avérés efficaces dans le traitement des CNVM liées à la DMLA, des rapports de cas ont été publiés au milieu des années 2000 montrant leur succès dans le traitement des membranes néovasculaires chez les patients atteints de SHPO. Après la publication de nombreux rapports de cas et de revues rétrospectives montrant l’efficacité du traitement avec des agents anti-VEGF, ils sont devenus la norme de soins utilisant les mêmes principes que ceux pour le traitement du CNVM lié à la DMLA.
Diagnostic : Syndrome présumé d’histoplasmose oculaire (POHS) avec CNVM
EPIDEMIOLOGIE
|
SIGNES
|
SYMPTÔMES
|
TREATMENT
|
Différents diagnostics pour cicatrice choriorétinienne maculaire avec fluide associé :
- Toxoplasmose (aurait une inflammation du vitré)
- Dégénérescence myopique
- Stries angulaires
- Age-.Dégénérescence maculaire liée à l’âge (DMLA)
- Chorioretinopathie séreuse centrale (CSCR)
- Choroïdopathie interne ponctuée (PIC)
- Choroïdite multifocale (MFC)
- CNVM idiopathique
- Prasad AG, Van Gelder RN. Syndrome présumé d’histoplasmose oculaire. Curr Opin Ophthalmol 2005;16(6):364-368. https://www.ncbi.nlm.nih.gov/pubmed/16264347
- Oliver A, Ciulla TA, Comer GM. Aperçus nouveaux et classiques sur le syndrome présumé d’histoplasmose oculaire et son traitement. Curr Opin Ophthalmol 2005;16(3):160-165. https://www.ncbi.nlm.nih.gov/pubmed/15870572
- Rosenfeld PJ, Saperstein DA, Bressler NM, Reaves TA, Sickenberg M, Rosa RH, Jr, Sternberg P, Jr, Aaberg TM, Sr, Aaberg TM, Jr, Verteporfin in Ocular Histoplasmosis Study G. Photodynamic therapy with verteporfin in ocular histoplasmosis : uncontrolled, open-label 2-year study. Ophthalmology 2004;111(9):1725-1733. https://www.ncbi.nlm.nih.gov/pubmed/15350329
- Adan A, Navarro M, Casaroli-Marano RP, Ortiz S, Molina JJ. Bevacizumab intravitréen comme traitement initial de la néovascularisation choroïdienne associée à un syndrome présumé d’histoplasmose oculaire. Graefes Arch Clin Exp Ophthalmol 2007;245(12):1873-1875. https://www.ncbi.nlm.nih.gov/pubmed/17786466
- Schadlu R, Blinder KJ, Shah GK, Holekamp NM, Thomas MA, Grand MG, Engelbrecht NE, Apte RS, Joseph DP, Prasad AG, Smith BT, Sheybani A. Bevacizumab intravitréen pour la néovascularisation choroïdienne dans l’histoplasmose oculaire. Am J Ophthalmol 2008;145(5):875-878. https://www.ncbi.nlm.nih.gov/pubmed/18321466
- Weingeist TA, Watzke RC. Atteinte oculaire par l’histoplasma capsulatum. Int Ophthalmol Clin 1983;23(2):33-47. https://www.ncbi.nlm.nih.gov/pubmed/6189798
- Cionni DA, Lewis SA, Petersen MR, Foster RE, Riemann CD, Sisk RA, Hutchins RK, Miller DM. Analyse des résultats du bevacizumab intravitréen dans le traitement de la néovascularisation choroïdienne secondaire à l’histoplasmose oculaire. Ophthalmology 2012;119(2):327-332. https://www.ncbi.nlm.nih.gov/pubmed/22133795
- Dégénérescence maculaire liée à l’âge et autres causes de néovascularisation choroïdienne. Cours de sciences fondamentales et cliniques (BCSC) Section 12 : rétine et vitré. San Francisco : Académie américaine d’ophtalmologie ; 2014-2015.
Format de citation suggéré
McConnell LK. Révision de ; EyeRounds.org. 5 juillet 2017 ; Disponible à partir de : http://www.EyeRounds.org/cases/83-Presumed-Ocular-Histoplasmosis-POHS.htm.
.