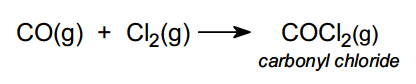
Utilisations des polycarbonates
Il existe de nombreux polycarbonates dont les propriétés varient en fonction de leur masse moléculaire et de leur structure. Lorsque la masse moléculaire augmente, le polymère devient plus rigide. De plus, les propriétés sont modifiées en le mélangeant avec d’autres polymères, par exemple avec de l’ABS et des polyesters comme le PET.
En raison de leurs propriétés remarquables (ils sont résistants aux flammes et à la chaleur, tenaces et transparents), les polymères sont très largement utilisés.
|
Parmi les utilisations des polycarbonates et de leurs mélanges figurent :
- médical (par exemple, pour les boîtiers de dialyse et les verres de lunettes)
- électro-électronique (par exemple, douilles, couvercles de lampes,
- boîtes à fusibles, boîtiers d’ordinateurs et de téléviseurs)
- construction (par exemple, toits de stades, enseignes, puits de lumière)
- stockage optique (CD, DVD, HD-DVD)
- voitures (éclairage intérieur et phares, toits ouvrants, vitres latérales, radiateurs, grilles, pare-chocs)
- emballages (par exemple, grandes bouteilles d’eau)
|
Production annuelle de polycarbonates
| Monde | 4.4 millions de tonnes1 |
| Asie | 2,0 millions de tonnes2 |
| Europe | 1.5 millions de tonnes2 |
| US | 0,9 million de tonnes2 |
1. Estimation 2016 Merchant et Research Consulting, 2014
2. Estimation 2016 de la référence 1 et PlasticsEurope, 2015
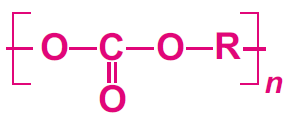
Fabrication de polycarbonates
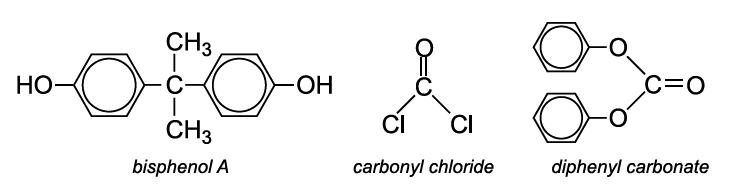
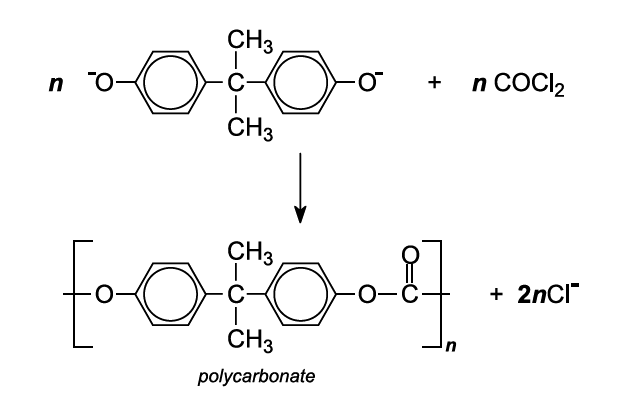
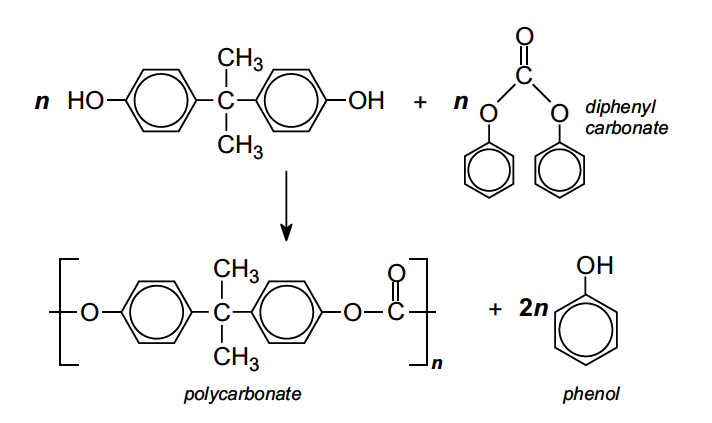
Le polycarbonate le plus utilisé est fabriqué par polymérisation par condensation entre le bisphénol A et soit le chlorure de carbonyle, soit le carbonate de diphényle.
Le bisphénol A est produit par la condensation du phénol avec la propanone.
Le chlorure de carbonyle est produit à partir du monoxyde de carbone et du chlore :
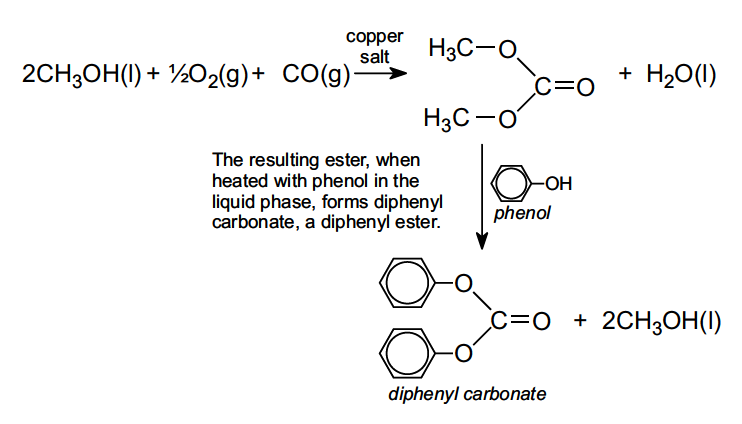
Le carbonate de diphényle est produit à partir du carbonate de diméthyle, qui est souvent fabriqué à partir de méthanol, d’oxygène et de monoxyde de carbone en phase liquide en présence d’un sel de cuivre tel que le chlorure de cuivre(II) :
Le polymère est généralement formé par la réaction du bisphénol A et du chlorure de carbonyle dans une solution basique.
On prépare une solution de bisphénol A dans l’hydroxyde de sodium (c’est-à-dire une solution du sel de sodium du phénol). On la mélange avec une solution de chlorure de carbonyle dans un solvant organique (dichlorométhane). La polymérisation a lieu à l’interface entre les couches aqueuse et organique à l’aide d’un catalyseur (une amine) :
Le polycarbonate est maintenu en solution dans la couche organique. Cette solution est ensuite écoulée de la couche aqueuse et est soit évaporée pour former des granules du polymère, soit on ajoute de l’éthanol pour précipiter le polymère solide.
Toutefois, une proportion croissante de polycarbonates est fabriquée via le carbonate de diphényle, afin d’éliminer l’utilisation du chlorure de carbonyle, un gaz extrêmement toxique.
Le bisphénol A et l’ester sont chauffés ensemble pour former une masse fondue de polymère:
Le phénol et les réactifs en excès sont éliminés par distillation sous pression réduite. Le polycarbonate fondu est ensuite pressé à travers de fines buses pour former de longs fils « spaghettis », qui sont refroidis et granulés.
Autres développements
Bien que le polycarbonate dérivé du bisphénol A soit facilement le polycarbonate le plus utilisé, des copolymères ont été développés dans lesquels des bisphénols substitués sont ajoutés et réagissent avec le carbonate de diphényle.
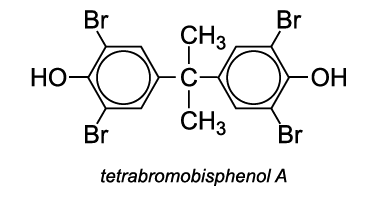
Par exemple, le tétrabromobisphénol A est ajouté, avant la polymérisation. Le polymère obtenu présente une résistance à la flamme améliorée.
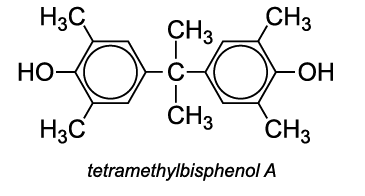
Un autre co-monomère utilisé est le tétraméthylbisphénol A, qui améliore la résistance du polycarbonate à la chaleur.
.