Dénomination générique : chlorhydrate de naftifine
Formation posologique : crème
Médicament revu par Drugs.com. Dernière mise à jour le 1er janvier 2021.
- Aperçu
- Effets secondaires
- Dosage
- Professionnel
- Grossesse
- Plus
Indications et utilisation de Naftifine crème
La crème de chlorhydrate de naftifine est indiquée pour le traitement de la tinea pedis interdigitale, du tinea cruris, et du tinea corporis causés par l’organisme Trichophyton rubrum.
Naftifine crème Posologie et mode d’administration
À usage topique uniquement. La crème de chlorhydrate de naftifine n’est pas destinée à un usage ophtalmique, oral ou intravaginal. Appliquer une fine couche de crème de chlorhydrate de naftifine une fois par jour sur les zones affectées plus une marge de ½ pouce de peau saine environnante pendant 2 semaines.
Formes posologiques et dosages
Chaque gramme contient 20 mg de chlorhydrate de naftifine (2%) dans une base blanche à blanc cassé.
Contre-indications
Aucune
Avertissements et précautions
Réactions indésirables locales
Interrompre le traitement si une irritation ou une sensibilité se développe avec l’utilisation de la crème de chlorhydrate de naftifine. Indiquer aux patients de contacter leur médecin si ces conditions se développent après l’utilisation de la crème de chlorhydrate de naftifine.
Réactions indésirables
Expérience des essais cliniques
Parce que les essais cliniques sont menés dans des conditions très variables, les taux de réactions indésirables observés dans les essais cliniques d’un médicament ne peuvent pas être directement comparés aux taux des essais cliniques d’un autre médicament et peuvent ne pas refléter les taux observés dans la pratique clinique.
Pendant les essais cliniques, 903 sujets ont été exposés aux formulations de crème de naftifine à 1 % et 2 %. Au total, 564 sujets atteints de tinea pedis interdigitale, de tinea cruris ou de tinea corporis ont été traités avec la crème de chlorhydrate de naftifine.
Dans deux essais randomisés, contrôlés par véhicule (400 sujets ont été traités avec la crème de chlorhydrate de naftifine). La population était âgée de 12 à 88 ans, principalement de sexe masculin (79%), 48% caucasienne, 36% noire ou afro-américaine, 40% hispanique ou latino et présentait soit un tinea pedis interdigital prédominant, soit un tinea cruris. La plupart des sujets ont reçu des doses une fois par jour, par voie topique, pendant 2 semaines, pour couvrir les zones cutanées affectées plus une marge de ½ pouce de peau saine environnante. Dans les deux essais contrôlés par véhicule, 17,5 % des sujets traités par la crème de chlorhydrate de naftifine ont présenté une réaction indésirable, contre 19,3 % des sujets traités par véhicule. La réaction indésirable la plus fréquente (supérieure ou égale à 1 %) est le prurit. La plupart des réactions indésirables étaient d’intensité légère. L’incidence des réactions indésirables dans la population traitée par la crème de chlorhydrate de naftifine n’était pas significativement différente de celle de la population traitée par le véhicule.
Dans une troisième étude randomisée, contrôlée par le véhicule, 116 sujets pédiatriques atteints de tinea corporis ont été traités par la crème de chlorhydrate de naftifine. La population était âgée de plus ou moins 2 à moins de 18 ans (âge moyen de 9 ans), majoritairement de sexe masculin (61%), 47% de Blancs, 51% de Noirs ou d’Afro-Américains, 92% d’Hispaniques ou de Latino-Américains, et infectée par le tinea corporis. La crème de chlorhydrate de naftifine a été appliquée par voie topique une fois par jour pendant 2 semaines sur toutes les zones de surface corporelle affectées par le tinea corporis, plus une marge de ½ pouce de peau saine entourant les lésions affectées. L’incidence des réactions indésirables dans la population traitée par la crème de chlorhydrate de naftifine n’était pas significativement différente de celle de la population traitée par le véhicule.
Dans deux essais pédiatriques ouverts de pharmacocinétique et de sécurité, 49 sujets pédiatriques âgés de 2 à moins de 18 ans atteints de tinea pedis interdigitale, de tinea cruris et de tinea corporis ont reçu la crème de chlorhydrate de naftifine. L’incidence des effets indésirables dans la population pédiatrique était similaire à celle observée dans la population adulte.
Expérience post-commercialisation
Les effets indésirables suivants ont été identifiés lors de l’utilisation post-approbation du chlorhydrate de naftifine : rougeur/irritation, inflammation, macération, gonflement, brûlure, ampoules, drainage séreux, croûtes, céphalées, vertiges, leucopénie, agranulocytose.
Comme ces réactions sont rapportées volontairement par une population de taille incertaine, il n’est pas toujours possible d’estimer de manière fiable leur fréquence ou d’établir une relation de causalité avec l’exposition au médicament.
Utilisation dans des populations spécifiques
Grossesse
Résumé des risques
Il n’existe pas de données disponibles avec la crème de chlorhydrate de naftifine chez la femme enceinte permettant de renseigner le risque de malformations congénitales majeures et de fausses couches associé au médicament. Dans les études de reproduction chez l’animal, aucun effet indésirable sur le développement embryofœtal n’a été observé à des doses orales administrées pendant la période d’organogenèse jusqu’à 18 fois la dose maximale recommandée chez l’homme (DMRH) chez les rates enceintes ou à des doses sous-cutanées administrées pendant la période d’organogenèse jusqu’à 2 fois la DMRH chez les rates enceintes ou 4 fois la DMRH chez les lapines enceintes .
Le risque de fond estimé de malformations congénitales majeures et de fausses couches pour la population indiquée est inconnu. Toutes les grossesses présentent un risque de fond d’anomalie congénitale, de perte ou d’autres résultats indésirables. Dans la population générale américaine, le risque de fond estimé de malformations congénitales majeures et de fausses couches dans les grossesses cliniquement reconnues est de 2 % à 4 % et de 15 % à 20 %, respectivement.
Données
Données animales
Des études systémiques de développement embryofœtal ont été menées chez le rat et le lapin. Pour la comparaison entre les doses animales et humaines basée sur la comparaison de la surface corporelle (mg/m2), la MRHD est fixée à 8 g de crème à 2% par jour (2,67 mg/kg/jour pour un individu de 60 kg).
Des doses orales de 30, 100 et 300 mg/kg/jour de chlorhydrate de naftifine ont été administrées pendant la période d’organogenèse à des rats femelles gravides. Aucun effet lié au traitement sur le développement embryonnaire n’a été noté à des doses allant jusqu’à 300 mg/kg/jour (18 fois la MRHD). Des doses sous-cutanées de 10 et 30 mg/kg/jour de chlorhydrate de naftifine ont été administrées pendant la période d’organogenèse à des rats femelles gravides. Aucun effet lié au traitement sur le développement embryonnaire n’a été noté à 30 mg/kg/jour (2 fois la MRHD). Des doses sous-cutanées de 3, 10 et 30 mg/kg/jour de chlorhydrate de naftifine ont été administrées pendant la période d’organogenèse à des lapines gravides. Aucun effet lié au traitement sur le développement embryonnaire n’a été noté à 30 mg/kg/jour (4 fois la MRHD).
Une étude de développement péri et post-natal a été menée chez le rat. Des doses orales de 30, 100 et 300 mg/kg/jour de chlorhydrate de naftifine ont été administrées à des rats femelles du jour 14 de la gestation au jour 21 de la lactation. Une réduction du gain de poids corporel des femelles pendant la gestation et de la progéniture pendant la lactation a été observée à 300 mg/kg/jour (18 fois la MRHD). Aucune toxicité pour le développement n’a été notée à 100 mg/kg/jour (6 fois la MRHD).
Lactation
Résumé des risques
Il n’existe aucune information disponible sur la présence de la crème de chlorhydrate de naftifine dans le lait maternel, sur les effets du médicament sur le nourrisson allaité ou sur les effets du médicament sur la production de lait. L’absence de données cliniques pendant l’allaitement empêche de déterminer clairement le risque de la crème de chlorhydrate de naftifine pour un nourrisson pendant l’allaitement ; par conséquent, le développement et les avantages pour la santé de l’allaitement doivent être pris en compte, ainsi que le besoin clinique de la mère pour la crème de chlorhydrate de naftifine et tout effet indésirable potentiel de la crème de chlorhydrate de naftifine ou de l’affection maternelle sous-jacente sur le nourrisson allaité.
Utilisation pédiatrique
La sécurité et l’efficacité de la crème de chlorhydrate de naftifine ont été établies chez les patients pédiatriques âgés de 12 ans et plus atteints de tinea pedis interdigitale et de tinea cruris et âgés de 2 ans et plus atteints de tinea corporis .
L’utilisation de la crème de chlorhydrate de naftifine dans ces groupes d’âge est soutenue par des preuves provenant d’études adéquates et bien contrôlées chez les adultes et les enfants, avec des données supplémentaires de sécurité et de pharmacocinétique provenant de deux essais ouverts menés chez 49 sujets pédiatriques exposés à la crème de chlorhydrate de naftifine .
La sécurité et l’efficacité de la crème de chlorhydrate de naftifine dans le traitement du tinea cruris et du tinea pedis interdigital chez les patients pédiatriques de moins de 12 ans n’ont pas été établies. La sécurité et l’efficacité de la crème de chlorhydrate de naftifine dans le traitement du tinea corporis chez les patients pédiatriques âgés de moins de 2 ans n’ont pas été établies.
Utilisation gériatrique
Les études cliniques de la crème de chlorhydrate de naftifine n’ont pas inclus un nombre suffisant de sujets âgés de 65 ans et plus pour déterminer s’ils répondent différemment des sujets plus jeunes.
Description de la crème de naftifine
La crème de chlorhydrate de naftifine, USP est une crème blanche à blanc cassé pour un usage topique uniquement. Chaque gramme contient 20 mg de chlorhydrate de naftifine, USP, (2 %), un composé antifongique synthétique d’allylamine.
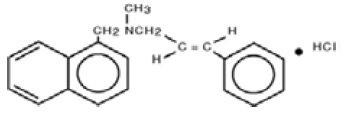
Chimiquement, le chlorhydrate de naftifine est le chlorhydrate de (E)-N-Cinnamyl-N-méthyl-1-napthalèneméthylamine.
La formule moléculaire est C21H21N-HCl avec un poids moléculaire de 323,86.
La formule développée du chlorhydrate de naftifine, USP est :
La crème de chlorhydrate de naftifine, USP contient les ingrédients inactifs suivants : alcool benzylique, alcool cétylique, cire d’esters cétyliques, myristate d’isopropyle, polysorbate 60, eau purifiée, hydroxyde de sodium, monostéarate de sorbitan et alcool stéarylique. De l’acide chlorhydrique peut être ajouté pour ajuster le pH.
Crème de naftifine – Pharmacologie clinique
Mécanisme d’action
La crème de chlorhydrate de naftifine est un médicament antifongique topique .
Pharmacodynamique
La pharmacodynamique de la crème de chlorhydrate de naftifine n’a pas été établie.
Pharmacocinétique
Les études de biodisponibilité in vitro et in vivo ont démontré que la naftifine pénètre dans la couche cornée en concentration suffisante pour inhiber la croissance des dermatophytes.
La pharmacocinétique de la crème de chlorhydrate de naftifine a été évaluée après une application topique uniquotidienne pendant 2 semaines sur 21 sujets adultes, hommes et femmes, atteints à la fois de tinea pedis et de tinea cruris. La quantité totale médiane de crème appliquée était de 6,4 g (plage de 5,3 g à 7,5 g) par jour. Les résultats ont montré que l’exposition systémique (c’est-à-dire la concentration maximale (Cmax) et l’aire sous la courbe du temps 0 à 24 heures (AUC0-24) à la naftifine a augmenté au cours de la période de traitement de 2 semaines chez les 21 sujets. La moyenne géométrique (coefficient de variation ou CV %) de l’ASC0-24 était de 117 (41,2) ng*hr/mL au jour 1, et de 204 (28,5) ng*hr/mL au jour 14. La moyenne géométrique (CV %) de la Cmax était de 7 ng/mL (55,6) au jour 1 et de 11 ng/mL (29,3) au jour 14. Le temps médian jusqu’à la Cmax (Tmax) était de 8 heures (intervalle de 4 à 24 heures) au jour 1 et de 6 heures (intervalle de 0 à 16 heures) au jour 14. L’accumulation après 14 jours d’application topique était inférieure à deux fois. Les concentrations de fond ont généralement augmenté tout au long de la période d’étude de 14 jours. La naftifine a continué à être détectée dans le plasma chez 13/21 (62 %) sujets au jour 28, les concentrations plasmatiques moyennes (écart-type ou ET) étaient de 1,6 ± 0,5 ng/mL (plage inférieure à la limite de quantification (LQ) à 3 ng/mL). Dans le même essai pharmacocinétique mené chez des patients atteints de tinea pedis et de tinea cruris, la fraction médiane de la dose excrétée dans les urines pendant la période de traitement était de 0,0016 % au jour 1 contre 0,0020 % au jour 14.
Dans un second essai ayant inclus 22 sujets, la pharmacocinétique de la crème de chlorhydrate de naftifine a été évaluée chez 20 sujets pédiatriques âgés de 13 à moins de 18 ans atteints à la fois de tinea pedis et de tinea cruris. Les sujets ont été traités avec une dose médiane de 8,1 g (intervalle de 6,6 g à 10,1 g) appliquée sur les zones affectées une fois par jour pendant 2 semaines. Les résultats ont montré que l’exposition systémique augmentait au cours de la période de traitement. La moyenne géométrique (CV %) de l’ASC0-24 était de 138 (50,2) ng*hr/mL au jour 1, et de 192 (74,9) ng*hr/mL au jour 14. La moyenne géométrique (CV %) de la Cmax était de 9,21 ng/mL (48,4) au jour 1 et de 12,7 ng/mL (67,2) au jour 14. La fraction médiane de la dose excrétée dans les urines pendant la période de traitement était de 0,0030 % au jour 1 et de 0,0033 % au jour 14.
Un troisième essai a évalué la pharmacocinétique de la crème de chlorhydrate de naftifine chez 27 sujets pédiatriques âgés de 2 à moins de 12 ans présentant une tinea corporis au moins modérée. Les sujets ont été divisés en groupes plus jeunes (2 à moins de 6 ans, 17 sujets) et plus âgés (6 à moins de 12 ans, 10 sujets). Des doses médianes de 1,3 g (plage de 1 g à 3,1 g) et de 2,3 g (plage de 2,2 g à 4,2 g) ont été appliquées une fois par jour pendant 2 semaines dans les groupes plus jeunes et plus âgés, respectivement, sur la zone affectée plus une marge de ½ pouce. Des évaluations pharmacocinétiques plasmatiques et urinaires ont été réalisées au jour 1 dans le groupe plus âgé uniquement et au jour 14 dans les deux groupes. Tous les sujets ont présenté des taux mesurables de naftifine dans le plasma après application topique de la crème de chlorhydrate de naftifine. Après l’administration d’une dose unique au jour 1 chez les sujets âgés de 6 à moins de 12 ans, les valeurs moyennes géométriques (CV%) de la Cmax et de l’ASC0-24 étaient respectivement de 3,60 (76,6) ng/ml et de 49,8 (64,4) ng*h/ml. Au jour 14 dans ce groupe, les valeurs de la Cmax et de l’ASC0-24 étaient respectivement de 3,31 (51,2) ng/mL et de 52,4 (49,2) ng*h/mL. Chez les sujets âgés de 2 à moins de 6 ans au jour 14, la Cmax et l’ASC0-24 étaient respectivement de 3,98 (186) ng/mL et de 54,8 (150) ng*h/mL. Dans le groupe plus âgé de sujets de 6 à 12 ans, les expositions systémiques (Cmax et ASC0-24) aux jours 1 et 14 étaient comparables. La fraction médiane de la dose excrétée dans les urines pendant 24 heures après l’application du médicament au jour 1 et au jour 14 était de 0,0029 % et 0,0014 %, respectivement.
Microbiologie
Bien que le mécanisme d’action exact contre les champignons ne soit pas connu, le chlorhydrate de naftifine semble interférer avec la biosynthèse des stérols en inhibant l’enzyme squalène2, 3-époxydase.Cette inhibition de l’activité enzymatique entraîne une diminution des quantités de stérols,notamment d’ergostérol, et une accumulation correspondante de squalène dans les cellules.
Mécanisme de résistance
A ce jour, un mécanisme de résistance à la naftifine n’a pas été identifié.
La naftifine s’est révélée active contre la plupart des isolats des champignons suivants, à la fois in vitro et dans des infections cliniques, comme décrit dans la section INDICATIONS ET USAGE :
Trichophyton rubrum
Toxicologie non clinique
Carcinogenèse, mutagenèse, altération de la fertilité
Dans une étude de cancérogénicité cutanée de 2 ans, la crème de chlorhydrate de naftifine a été administrée à des rats Sprague-Dawley à des doses topiques de 1%, 2% et 3% (10, 20 et 30 mg/kg/jour de chlorhydrate de naftifine). Aucune tumeur liée au médicament n’a été notée dans cette étude jusqu’à la dose la plus élevée évaluée dans cette étude de 30 mg/kg/jour (12 fois la MRHD sur la base de la comparaison de l’ASC).
Le chlorhydrate de naftifine n’a révélé aucun signe de potentiel mutagène ou clastogène sur la base des résultats de deux tests de génotoxicité in vitro (test d’Ames et test d’aberration chromosomique sur cellules d’ovaire de hamster chinois) et d’un test de génotoxicité in vivo (test du micronoyau sur moelle osseuse de souris).
L’administration orale de chlorhydrate de naftifine à des rats, tout au long de l’accouplement, de la gestation, de la parturition et de la lactation, n’a démontré aucun effet sur la croissance, la fertilité ou la reproduction, à des doses allant jusqu’à 100 mg/kg/jour (6 fois la MRHD).
Etudes cliniques
Tinea Cruris
L’innocuité et l’efficacité de la crème de chlorhydrate de naftifine ont été étudiées dans le cadre d’un essai multicentrique randomisé, en double aveugle, contrôlé par véhicule, chez 146 sujets présentant un tinea cruris symptomatique et positif à la culture de dermatophytes. Les sujets ont été randomisés pour recevoir la crème de chlorhydrate de naftifine ou le véhicule. Les sujets ont appliqué la crème de chlorhydrate de naftifine ou le véhicule sur la zone affectée plus une marge de ½ pouce de peau saine entourant la zone affectée, une fois par jour pendant 2 semaines. Les signes et les symptômes de tinea cruris (présence ou absence d’érythème, de prurit et de desquamation) ont été évalués, et un examen KOH et une culture de dermatophytes ont été effectués au critère primaire d’efficacité à la semaine 4.
L’âge moyen de la population de l’essai était de 47 ans et 87% étaient des hommes et 43% étaient blancs. Au départ, il a été confirmé que les sujets présentaient des signes et symptômes de tinea cruris, un examen KOH positif et une présence confirmée de dermatophytes sur la base des résultats de culture d’un laboratoire central de mycologie. L’analyse de la population en intention de traiter consistait à comparer les proportions de sujets présentant une guérison complète lors de la visite de la semaine 4 (voir tableau 1). La guérison complète a été définie à la fois comme une guérison clinique (absence d’érythème, de prurit et de desquamation) et une guérison mycologique (culture KOH et dermatophyte négative).
Le pourcentage de sujets présentant une guérison clinique et le pourcentage de sujets présentant une guérison mycologique à la semaine 4 sont présentés individuellement dans le tableau 1 ci-dessous.
|
Point final |
Crème de chlorhydrate de naftifine, 2% |
Véhicule |
|
N=75 |
N=71 |
|
|
Curée complète |
19 (25%) |
2 (3%) |
|
Traitement efficaceb |
45 (60%) |
7 (10%) |
|
Cure mycologiquec |
54 (72%) |
11 (16%) |
|
a. La guérison complète est un critère composite de la guérison mycologique et de la guérison clinique. La guérison clinique est définie comme l’absence d’érythème, de prurit et de desquamation (grade de 0). |
||
|
b. Un traitement efficace est une préparation KOH négative et une culture de dermatophytes négative, des grades d’érythème, de desquamation et de prurit de 0 ou 1 (absent ou presque absent). |
||
|
c. La guérison mycologique est définie comme une culture négative de KOH et de dermatophyte. |
||
Tinea pédis interdigital
L’efficacité de la crème de chlorhydrate de naftifine a été étudiée dans un essai multicentrique randomisé, en double aveugle, contrôlé par véhicule, chez 217 sujets présentant un tinea pédis interdigital symptomatique et positif à la culture de dermatophyte. Les sujets ont été randomisés pour recevoir la crème de chlorhydrate de naftifine ou le véhicule. Les sujets ont appliqué la crème de chlorhydrate de naftifine ou le véhicule sur la zone affectée du pied plus une marge de ½ pouce de peau saine entourant la zone affectée, une fois par jour pendant 2 semaines. Les signes et les symptômes de la tinea pedis interdigitale (présence ou absence d’érythème, de prurit et de desquamation) ont été évalués et un examen KOH et une culture de dermatophytes ont été réalisés lors du critère primaire d’efficacité à la semaine 6.
L’âge moyen de la population de l’essai était de 42 ans et 71% étaient des hommes et 57% étaient blancs. Au début de l’étude, les sujets devaient présenter des signes et des symptômes de tinea pedis interdigitaux, un examen KOH positif et une culture de dermatophytes confirmée. Le critère principal d’efficacité était la proportion de sujets présentant une guérison complète lors de la visite de la semaine 6 (voir tableau 2). La guérison complète a été définie comme étant à la fois une guérison clinique (absence d’érythème, de prurit et de desquamation) et une guérison mycologique (examen KOH et culture de dermatophytes négatifs).
Les résultats d’efficacité à la semaine 6, quatre semaines après la fin du traitement, sont présentés dans le tableau 2 ci-dessous. La crème de chlorhydrate de naftifine a démontré une guérison complète chez les sujets atteints de tinea pedis interdigitaux, mais la guérison complète chez les sujets atteints uniquement de tinea pedis de type mocassin n’a pas été démontrée.
|
Endpoint |
Crème de chlorhydrate de naftifine, 2% |
Véhicule |
|
N=147 |
N=70 |
|
|
Curée complète |
26 (18%) |
5 (7%) |
|
Traitement efficaceb |
83 (57%) |
14 (20%) |
|
Cure mycologique |
99 (67%) |
15 (21%) |
|
a. La guérison complète est un critère composite de guérison mycologique et de guérison clinique. |
||
|
b. Un traitement efficace est une préparation KOH négative et une culture de dermatophytes négative, des grades d’érythème, de desquamation et de prurit de 0 ou 1 (absent ou quasi absent). |
||
|
c. La guérison mycologique est définie comme une culture négative de KOH et de dermatophyte. |
||
Tinea corporis
L’innocuité et l’efficacité de la crème de chlorhydrate de naftifine ont été étudiées dans le cadre d’un essai multicentrique randomisé, en double aveugle, contrôlé par véhicule, chez 184 sujets présentant un tinea corporis symptomatique et positif à la culture de dermatophyte. Les sujets ont été randomisés pour recevoir la crème de chlorhydrate de naftifine ou le véhicule. Les sujets ont appliqué l’agent à l’étude sur toutes les surfaces corporelles affectées par le tinea corporis plus une marge de ½ pouce de peau saine entourant les lésions affectées pendant deux semaines. Les signes et les symptômes du tinea corporis (présence ou absence d’érythème, d’induration et de prurit) ont été évalués et un examen KOH et une culture de dermatophytes ont été réalisés pour l’évaluation du critère d’efficacité primaire au jour 21.
La population de l’essai était pédiatrique (âge supérieur ou égal à 2 ans et inférieur à 18 ans) avec un âge médian de 9 ans (crème de chlorhydrate de naftifine) ou 8 ans (véhicule) ; 61 % des sujets étaient de sexe masculin et 45 % étaient blancs. Au départ, les sujets devaient présenter des signes et des symptômes de tinea corporis, un examen KOH positif et une culture de dermatophytes confirmée. Le critère principal d’efficacité était la proportion de sujets présentant une guérison complète au jour 21. La guérison complète a été définie comme étant à la fois une guérison clinique (absence d’érythème, d’induration et de prurit sur toutes les lésions présentes au départ) et une guérison mycologique (examen KOH et culture de dermatophytes négatifs).
Les résultats d’efficacité au jour 21, une semaine après la fin du traitement, sont présentés dans le tableau 3 ci-dessous.
|
Crème de chlorhydrate de naftifine, 2% |
Véhicule |
|
|
Endpoint |
N=91 |
N=93 |
|
Cure complète |
42 (46%) |
26 (28%) |
|
Traitement efficaceb |
53 (58%) |
32 (34%) |
|
Cure mycologique |
57 (63%) |
36 (39%) |
|
a. La guérison complète est un critère composite de guérison mycologique et de guérison clinique. |
||
|
b. Un traitement efficace est une préparation KOH négative et une culture de dermatophytes négative, un érythème, une induration et un prurit de grade 0 ou 1 (absent ou léger). |
||
|
c. La guérison mycologique est définie comme une culture négative de KOH et de dermatophytes. |
||
COMMENT FOURNIR/STOCKAGE ET MANIPULATION
La crème de chlorhydrate de naftifine, USP 2%, est une crème blanche à blanc cassé fournie dans le format suivant :
Tubes de 45 grammes – NDC 70700-161-18
Tubes de 60 grammes – NDC 70700-161-17
Stocker la crème de chlorhydrate de naftifine à 25°C (77°F) ; excursions autorisées entre 15° et 30°C (59° et 86°F) .
Informations à l’intention des patients
- Informer les patients que la crème de chlorhydrate de naftifine est destinée à un usage topique uniquement. La crème de chlorhydrate de naftifine n’est pas destinée à un usage oral, intravaginal ou ophtalmique.
- Si une irritation ou une sensibilité apparaît lors de l’utilisation de la crème de chlorhydrate de naftifine, le traitement doit être interrompu et un traitement approprié doit être instauré. Les patients doivent être invités à contacter leur médecin si ces conditions se développent après l’utilisation de la crème de chlorhydrate de naftifine.
Distribué par :
Xiromed, LLC,
Florham Park, NJ 07932
Rev. 09/2020
PI-161-00
ETIQUETTE DE L’EMBALLAGE SECTION PRINCIPALE DE L’AFFICHAGE – Tube de 45g

NDC 70700-161-18
Naftifine Crème, 2%
Xiromed, LLC
Pour usage topique uniquement
Pas pour usage ophtalmique, orale ou intravaginale
45 g
Rx Only
PACKAGE LABEL PRINCIPAL DISPLAY PANEL SECTION – 60g Tube

NDC 70700-161-17
Naftifine Cream, 2%
Xiromed, LLC
Pour usage topique uniquement
Pas pour usage ophtalmique, oral ou intravaginal
60 g
Rx Only
| NAFTIFINE HYDROCHLORIDE naftifine hydrochloride cream |
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
Étiqueteur – Xiromed, LLC (080228637)
Titulaire – Xiromed Pharma España, S.L. (468835741)
Plus d’informations sur naftifine topique
- Effets secondaires
- Pendant la grossesse ou l’allaitement
- Information sur la posologie
- Prix & Coupons
- En Español
- 7 avis
- Classe de médicaments : Antifongiques topiques
Ressources pour les consommateurs
- Information pour les patients
- Naftifine Topique (Lecture avancée)
Ressources pour les professionnels
- Information pour les prescripteurs
- Naftifine. (Conseils professionnels aux patients)
- Naftifine Gel (FDA)
Autres marques Naftin
Guides de traitement associés
- Tinea Pedis
- Tinea Corporis
- Tinea Cruris
Avis médical
.