Figure 1. Voie de signalisation des récepteurs Toll-like
Qu’est-ce que les récepteurs Toll-like ?
Les récepteurs de type Toll (TLR) sont une classe de protéines qui jouent un rôle clé dans l’immunité innée. Ce sont des récepteurs transmembranaires à domaine unique qui appartiennent aux récepteurs de reconnaissance de motifs (PRR) qui sont généralement exprimés dans les cellules sentinelles telles que les macrophages les cellules dendritiques et de nombreuses autres cellules non immunitaires telles que les fibroblastes et les cellules épithéliales. Ils reconnaissent des molécules à structure conservée provenant de microbes, appelées motifs moléculaires associés aux agents pathogènes (PAMP), ou des molécules dérivées de cellules endommagées, appelées motifs moléculaires associés aux dommages (DAMP). Les PAMPs comprennent divers composants de la paroi cellulaire bactérienne tels que le lipopolysaccharide (LPS), le peptidoglycane (PGN) et les lipopeptides, ainsi que la flagelline, l’ADN bactérien et l’ARN double brin viral. Les DAMP comprennent des protéines intracellulaires telles que les protéines de choc thermique ainsi que des fragments de protéines de la matrice extracellulaire. Les PRR activent des voies de signalisation en aval qui conduisent à l’induction de réponses immunitaires innées par la production de cytokines inflammatoires, d’interféron de type I (IFN) et d’autres médiateurs. Ces processus déclenchent non seulement des réponses défensives immédiates de l’hôte telles que l’inflammation, mais amorcent et orchestrent également des réponses immunitaires adaptatives spécifiques de l’antigène. Ces réponses sont essentielles pour la clairance des microbes infectants ainsi que cruciales pour l’instruction conséquente des réponses immunitaires adaptatives spécifiques aux antigènes.
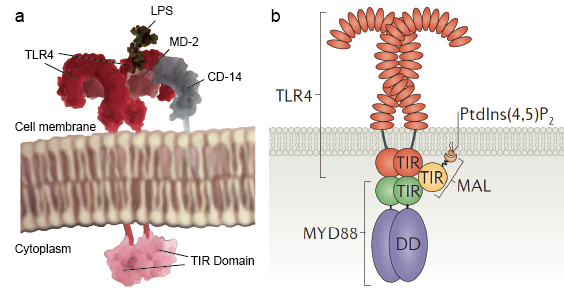
Figure 2. Le diagramme schématique de la structure moléculaire des TLR.
Famille des récepteurs de type TLR
La famille des TLR comprend 10 membres (TLR1-TLR10) chez l’homme et 12 (TLR1-TLR9, TLR11-TLR13) chez la souris. Les TLR se localisent à la surface des cellules ou dans des compartiments intracellulaires tels que le RE, l’endosome et le lysosome. Les TLR de surface cellulaire comprennent TLR1, TLR2, TLR4, TLR5, TLR6 et TLR10, tandis que les TLR intracellulaires sont localisés dans l’endosome et comprennent TLR3, TLR7, TLR8, TLR9, TLR11, TLR12 et TLR13 (Figure 1). Les TLR de la surface cellulaire reconnaissent principalement les composants de la membrane microbienne tels que les lipides, les lipoprotéines et les protéines. Les TLR intracellulaires reconnaissent les acides nucléiques dérivés des bactéries et des virus, et reconnaissent également les acides auto-nucléiques dans des conditions pathologiques telles que l’auto-immunité.
La fonction des récepteurs de type Toll repose généralement sur un processus de dimérisation de deux molécules TLR, mais pas toujours. Par exemple, TLR-1 et TLR-2 se lient l’un à l’autre pour former un dimère lorsqu’ils reconnaissent des molécules PAMPs comprenant principalement des lipoprotéines, des peptidoglycanes, des acides lipotéchoïques (LTA, Gram-), du zymosan, du mannane et de la tGPI-mucine. TLR-2 peut également former un gradateur avec TLR-6 lorsqu’ils reconnaissent les mêmes PAMPs listés ci-dessus. TLR-4 peut reconnaître le lipopolysaccharide (LPS, Gram+) et former un homodimère avec une autre molécule TLR-4. TLR-5 peut reconnaître la flagelline bactérienne, mais ils ne forment pas de dimère. TLR-11 est fonctionnel chez la souris et reconnaît principalement les bactéries uropathogènes. TLR-3, 7, 8, 9, 13 sont exprimés à la surface des endosomes dans le cytoplasme. TLR3 reconnaît l’ARN double brin (ARNdb) viral, les petits ARN interférents et les auto-ARN dérivés de cellules endommagées. TLR-7 est principalement exprimé dans les CD plasmacytoïdes (CDP) et reconnaît l’ARN simple brin (ss) des virus. Il reconnaît également l’ARN de la bactérie streptococcus B dans les CD conventionnelles (CDC). TLR8 répond à l’ARN viral et bactérien. TLR-9 reconnaît l’ADN bactérien et viral qui est riche en motifs CpG-ADN non méthylés. TLR13 reconnaît l’ARNr 23S bactérien et des composants inconnus du virus de la stomatite vésiculaire.
Bien qu’il existe de nombreux types de molécules TLR qui reconnaissent un large éventail de ligands, tous ces TLR partagent un cadre structurel commun dans leurs domaines extracellulaires de liaison au ligand. Ces domaines adoptent tous des structures en forme de fer à cheval construites à partir de motifs répétés riches en leucine. Typiquement, lors de la liaison au ligand, deux domaines extracellulaires forment un dimère en forme de »m » prenant en sandwich la molécule de ligand amenant les domaines transmembranaires et cytoplasmiques à proximité et déclenchant une cascade de signalisation en aval (Figure 2).
Voie de signalisation des récepteurs de type Toll
1. Cascade de signalisation des récepteurs Toll-like
Les récepteurs Toll-like permettent aux cellules sentinelles telles que les macrophages de détecter les microbes par le biais de PAMPs tels que le LPS. Le LPS est un composant de la paroi cellulaire bactérienne. Le mécanisme de reconnaissance des lipopolysaccharides par les récepteurs Toll-like est complexe et nécessite plusieurs protéines accessoires. Une protéine sérique, la protéine de liaison au LPS, lie les monomères de LPS et les transfère à une protéine appelée CD14. La CD14 peut être soluble ou se lier à la surface cellulaire par l’intermédiaire d’une ancre glycosylphosphatidylinositol. CD14 délivre et charge les LPS au domaine extracellulaire des récepteurs de type Toll. Les TLR sont capables de détecter les LPS à l’aide d’une protéine auxiliaire appelée MD-2. Ensuite, l’homodimérisation des TLR est induite lorsque les LPS se lient au complexe TLR-CD14-MD2. Le changement de conformation des domaines extracellulaires initie la dimérisation du domaine cytoplasmique du récepteur Toll de l’IL-1 (TIR). Le changement de conformation du TIR fournit un nouvel échafaudage qui permet le recrutement de protéines adaptatrices pour former un complexe de signalisation post-récepteur. Le TIR contient une protéine adaptatrice, la protéine de réponse primaire de différenciation myéloïde 88 (MyD88).
MyD88 fonctionne comme un adaptateur reliant les TLRs/IL-1Rs avec des molécules de signalisation en aval qui ont des DDs. Il reconnaît le changement de conformation du domaine TIR des TLR, se lie au nouveau complexe de récepteurs et transfère la signalisation par l’interaction du domaine de mort amino (N)-terminal (DD) avec les kinases associées à IL-1R (IRAK). Il en résulte une cascade complexe de signalisation qui avertit la cellule de l’invasion d’un pathogène. Il existe 4 IRAKs (IRAK 1, 2, 4, M). Ils contiennent un DD N-terminal et un domaine central sérine/thréonine-kinase. IRAK1 et IRAK4 ont une activité kinase intrinsèque, tandis que IRAK2 et IRAK-M n’ont aucune activité kinase détectable. IRAK4 est activé par MyD88 et il continue à activer IRAK1. IRAK1 active ensuite TRAF6 en aval. TRAF6 est un membre de la famille des facteurs associés au récepteur du facteur de nécrose tumorale (TNFR) (TRAF) qui médient les voies de signalisation des cytokines. Lors d’une stimulation, TRAF6 est recruté dans le complexe récepteur et activé par IRAK-1 qui se lie au domaine TRAF de TRAF6. Ensuite, le complexe IRAK-1/TRAF6 se dissocie du récepteur et s’associe à la kinase 1 activée par le TGF-beta (TAK1) et aux protéines de liaison à TAK1, TAB1 et TAB2. Le complexe TRAF6, TAK1, TAB1 et TAB2 se déplace dans le cytoplasme, où il forme un grand complexe avec d’autres protéines, telles que les ligases E2 Ubc13 et Uev1A. Il a été démontré que le complexe Ubc13 et Uev1A catalyse la synthèse d’une chaîne de polyubiquitine liée à la Lys 63 de TRAF6 et induit ainsi l’activation de TAK1 et finalement de NF-kB par TRAF6. Ces voies de signalisation décrites ci-dessus sont appelées voies dépendantes de MyD88 car le signal part de la molécule MyD88. Il existe également une autre voie appelée voie indépendante de MyD88, dans laquelle le signal ne part pas de MyD88. Au lieu de cela, le signal part de la protéine TRIF. TRIF interagit avec TRAF6 et TRAF3.TRAF6 recrute la kinase RIP-1, qui à son tour interagit avec le complexe TAK1 et l’active, ce qui entraîne l’activation de NF-kB et de MAPK et l’induction de cytokines inflammatoires. En revanche, TRAF3 recrute les kinases liées à IKKTBK1 et IKKi ainsi que NEMO pour la phosphorylation et l’activation d’IRF3. IRF3 forme un dimère et transloque dans le noyau à partir du cytoplasme, induit l’expression de l’IFN de type I.
2. Signalisation en aval
Les TLR signalent en fait principalement par le recrutement de molécules adaptatrices spécifiques, conduisant à l’activation des facteurs de transcription NF-kB et IRFs, qui dictent le résultat des réponses immunitaires innées. Cette voie de signalisation en aval consiste donc à activer le facteur de transcription IRFs, la voie de signalisation NF-kB et la voie MAKP. Vous pouvez trouver des informations plus détaillées sur la voie NF-kB et MAKP à partir de:
La voie de signalisation NF-kB, la voie de signalisation P38 et la voie de signalisation MAKP.
3. Régulation de la voie
De cause, il y a une certaine régulation négative par un certain nombre de molécules à travers divers mécanismes pour prévenir ou mettre fin aux réponses immunitaires excessives qui conduisent à des conséquences néfastes associées à l’auto-immunité et aux maladies inflammatoires. L’activation de la voie dépendante de MyD88 est supprimée par ST2825, SOCS1 et Cbl-b, et l’activation de la voie dépendante de TRIF est supprimée par SARM et TAG. Ces molécules s’associent à MyD88 ou TRIF pour les empêcher de se lier aux TLR ou aux molécules en aval. L’activation de TRAF3 est régulée négativement par SOCS3 et DUBA. TRAF6 est ciblé par un certain nombre de molécules inhibitrices telles que A20, USP4, CYLD, TANK, TRIM38 et SHP. L’activation de TAK1 est inhibée par TRIM30a et A20.
4. Relation avec les maladies
Comme le TLR est impliqué dans la détection du LPS et qu’il pourrait avoir un rôle dans la septicémie, le ciblage des TLR est important pour le traitement de plusieurs maladies. En plus d’interférer avec les réponses TLR pour traiter les infections par des agents pathogènes, une application clinique évidente des connaissances acquises grâce aux études sur les TLR était d’utiliser les ligands TLR comme adjuvants de vaccins. De plus, l’inhibition des TLR a également été tentée en clinique, le but étant de limiter l’inflammation excessive qui est vraisemblablement conduite par l’activation excessive d’un TLR particulier.
| Takeda, Kiyoshi, et Shizuo Akira. « Voies de signalisation TLR ». Séminaires en immunologie. Vol. 16. No. 1. Academic Press, 2004. | |
| Akira, Shizuo, et Kiyoshi Takeda. « Signalisation des récepteurs de type Toll ». Nature reviews immunology 4.7 (2004) : 499-511. | |
| Lim, Kian-Huat, et Louis M. Staudt. « Signalisation des récepteurs de type Toll ». Cold Spring Harbor perspectives in biology 5.1 (2013) : a011247. | |
| etTaro Kawai, Takumi Kawasaki. « Les voies de signalisation des récepteurs de type Toll ». Pattern Recognition Receptors and Cancer 8916 (2015) : 7. | |
| Gay, Nicholas J., et al. « Assembly and localization of Toll-like receptor signalling complexes. » Nature reviews Immunology 14.8 (2014) : 546-558. | |
| O’Neill, Luke AJ, Douglas Golenbock, et Andrew G. Bowie. « L’histoire des récepteurs Toll-like redéfinissant l’immunité innée ». Nature Reviews Immunology 13.6 (2013) : 453-460. | |
| Botos, Istvan, David M. Segal, et David R. Davies. « La biologie structurale des récepteurs de type Toll ». Structure 19.4 (2011) : 447-459. |
.