US Pharm. 2009;34(11):26-39.
L’incertitude est grande lorsqu’il s’agit de choisir l’antidépresseur approprié pour les patients ayant reçu un diagnostic de trouble dépressif majeur (TDM), non seulement parce que les études n’ont rapporté aucune différence d’efficacité entre les agents, mais aussi parce que seulement 11 % à 30 % des patients atteindront une rémission avec le traitement initial, même après un an.1,2 Cela a par conséquent conduit les cliniciens à pratiquer par essais et erreurs pour traiter la dépression3. En outre, la dernière révision majeure du Manuel diagnostique et statistique des troubles mentaux (DSM-IV-TR) remonte à 2000.4 En 2005, une veille des lignes directrices a été publiée pour examiner les problèmes de sécurité importants qui étaient apparus à propos de certains agents, comme la néfazodone, ainsi que pour examiner deux nouveaux antidépresseurs approuvés cette année-là, l’escitalopram et la duloxétine.5 La révision et la mise à jour du DSM-IV-TR (manuscrit du DSM-V) ne sont pas prévues avant mai 2012. Par conséquent, il est nécessaire de disposer d’une revue actualisée pour aider les cliniciens à décider des agents appropriés pour traiter les patients individuels.
L’étude Sequenced Treatment Alternatives to Relieve Depression (STAR*D) de 2007 a tenté de développer et d’évaluer des stratégies de traitement réalisables afin d’améliorer les résultats cliniques pour les patients souffrant de dépression résistante au traitement qui ont été identifiés avec un épisode dépressif majeur actuel.6 Plus précisément, STAR*D visait à déterminer lequel de plusieurs traitements est la « prochaine étape » la plus efficace pour les patients qui n’atteignent pas la rémission avec un traitement initial ou ultérieur ou qui ne peuvent pas tolérer le traitement. Les résultats globaux de cette étude ont démontré que les différences pharmacologiques entre les psychotropes ne se traduisaient pas par des différences cliniques substantielles, bien que la tolérabilité diffère.6
Le but de cet article est d’examiner les preuves de traitement disponibles dans la littérature afin de fournir une référence rapide qui aidera les cliniciens à décider de l’agent approprié, en tenant compte des effets indésirables, des interactions médicamenteuses et de la sécurité des médicaments, ainsi que des caractéristiques du patient.
Qu’est-ce que la dépression ?
La dépression peut être un trouble mental chronique ou récurrent qui se manifeste par plusieurs symptômes tels qu’une humeur dépressive, une perte d’intérêt ou de plaisir, un sentiment de culpabilité, des troubles du sommeil ou de l’appétit, une faible énergie et des difficultés à penser.7 La dépression peut entraîner une altération substantielle de la capacité d’un individu à s’occuper de ses responsabilités quotidiennes. La dépression peut également conduire au suicide, une tragédie qui représente la perte d’environ 850 000 vies dans le monde chaque année.7
Prévalence et populations à risque
On estime que 121 millions de personnes dans le monde sont touchées par la dépression7. En 2000, la dépression était le quatrième facteur contribuant à la charge mondiale de morbidité parmi toutes les maladies, et d’ici 2020, on prévoit qu’elle passera au deuxième facteur contribuant à la charge mondiale de morbidité, juste après les maladies cardiaques.7
Les populations les plus à risque de développer une dépression sont les femmes, les personnes âgées de 24 à 45 ans et celles dont des parents du premier degré souffrent de dépression. Les femmes présentent un risque accru de dépression jusqu’à la cinquantaine, et leur risque à vie est deux fois plus élevé que celui des hommes. Les personnes âgées de 24 à 45 ans présentent le taux le plus élevé de dépression. Enfin, les parents au premier degré des patients déprimés sont 1,5 à 3 fois plus susceptibles de souffrir de dépression que les autres.4,8
Pathophysiologie et justification de la pharmacothérapie
Des causes biologiques et psychosociales ont été émises comme hypothèses pour tenter de décrire la physiopathologie de la dépression. Les agents pharmacologiques cibleront les causes biologiques liées à la dysrégulation des neurotransmetteurs. Ce dérèglement est souvent décrit comme une déficience des niveaux de neurotransmetteurs cérébraux. Les niveaux de noradrénaline, de sérotonine et de dopamine peuvent être diminués chez les patients souffrant de dépression, ce qui permet d’associer une quantité réduite de neurotransmetteurs à ce trouble.8 La logique de la pharmacothérapie a été de stimuler ces déficiences en bloquant la recapture ou en empêchant le métabolisme enzymatique des neurotransmetteurs par le biais des antidépresseurs. Globalement, ces mécanismes visent à augmenter le taux de neurotransmetteurs soit en forçant le neurone à tirer plus souvent et à produire plus de neurotransmetteurs, soit en empêchant la dégradation du neurotransmetteur lui-même.
Agents pharmacologiques
Plusieurs classes d’agents sont actuellement disponibles pour traiter la dépression. Il s’agit notamment des inhibiteurs sélectifs de la recapture de la sérotonine (ISRS), des antidépresseurs tricycliques (ATC), des inhibiteurs de la monoamine oxydase (IMAO) et des inhibiteurs de la recapture de la sérotonine-noradrénaline (IRSN).
Les antidépresseurs ont été associés à un risque accru de pensées suicidaires et de suicidalité chez les enfants, les adolescents et les jeunes adultes dans des études à court terme contrôlées par placebo sur le TDM. Quiconque envisage l’utilisation d’un antidépresseur chez un enfant, un adolescent ou un jeune adulte doit trouver un équilibre entre ce risque et le besoin clinique. Les études à court terme n’ont pas montré d’augmentation du risque de suicidalité avec les antidépresseurs par rapport au placebo chez les adultes de plus de 24 ans, et il y avait une réduction du risque avec les antidépresseurs par rapport au placebo chez les adultes de 65 ans et plus. La dépression et d’autres troubles psychiatriques sont eux-mêmes associés à un risque accru de suicide. Les patients de tous âges qui commencent un traitement antidépresseur doivent faire l’objet d’une surveillance appropriée et être observés de près en cas d’aggravation clinique, de suicidalité ou de changements inhabituels de comportement.9
Inhibiteurs sélectifs de la recapture de la sérotonine4,10 : Les ISRS sont considérés comme des agents de première ligne lorsqu’il s’agit de traiter les patients souffrant de dépression. Ces médicaments comprennent le citalopram, l’escitalopram, la fluoxétine, la fluvoxamine, la paroxétine et la sertraline (TABLEAU 1). Les principaux effets indésirables de cette classe sont les nausées, les vomissements et la diarrhée, qui sont des effets proportionnels à la dose et ont tendance à se dissiper après les premières semaines de traitement. Chez certains patients, les ISRS peuvent provoquer une agitation et des troubles du sommeil, qui se dissipent également avec le temps. Les dysfonctionnements sexuels sont un effet secondaire présent avec tous les antidépresseurs, mais semblent être plus fréquents avec les ISRS.
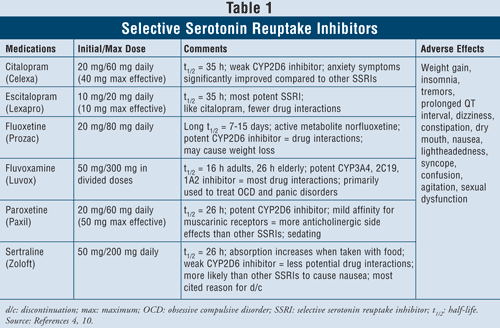
Le syndrome sérotoninergique (c’est-à-dire douleurs abdominales, diarrhée, sueurs, modification de l’état mental, insuffisance rénale, choc cardiovasculaire et éventuellement décès) est un effet indésirable rare des ISRS. Le syndrome sérotoninergique peut survenir lors d’une augmentation de la dose d’ISRS ou de la prise d’ISRS avec des plantes médicinales comme le millepertuis ou avec des drogues illicites. Enfin, l’association des ISRS avec des IMAO peut également entraîner des interactions médicamenteuses mortelles avec le développement du syndrome sérotoninergique. Lorsque les cliniciens ressentent le besoin de passer d’une classe d’agents à l’autre, il est suggéré qu’au moins cinq demi-vies s’écoulent entre l’arrêt de l’ISRS et le début de l’IMAO.4 De tous les agents de la classe, la fluvoxa mine présente le taux le plus élevé d’interactions médicamenteuses, car elle inhibe plusieurs enzymes hépatiques comme les CYP450 1A2, 2C19, 2C9, 2D6 et 3A4. La fluoxétine suit de près le taux d’interactions médicamenteuses de la fluvoxamine avec l’inhibition des CYP 2C9, 2D6 et 3A4. Enfin, le citalopram et l’escitalopram présentent le moins d’interactions médicamenteuses, car ils inhibent les enzymes 2D6 dans une moindre mesure.
Lorsque l’on considère les caractéristiques et la sécurité des patients, les ISRS sont sûrs à utiliser dans la plupart des groupes de patients, y compris ceux qui ont une maladie cardiaque préexistante, de l’asthme, de la démence et de l’hypertension. Les personnes âgées, qui sont particulièrement sujettes à l’hypotension orthostatique ainsi qu’à la perte de poids, peuvent bénéficier le plus de l’utilisation des ISRS puisque ces agents produisent une prise de poids et n’ont pas d’activité anticholinergique.
Antidépresseurs tricycliques4,10 : Les ATC bloquent le recaptage de la noradrénaline et de la sérotonine, mais ils ont également une affinité pour les récepteurs alpha1, H1 et muscariniques, provoquant ainsi des effets indésirables anticholinergiques. Il existe deux sous-classes d’agents dans cette classe, les TCA à amine tertiaire et secondaire (TABLEAU 2). Les TCA à amine secondaire (désipramine, maprotiline, nortriptyline) ont moins d’affinité pour les récepteurs alpha1, H1 et muscariniques, provoquant ainsi moins d’effets indésirables anticholinergiques que les TCA à amine tertiaire (par exemple, amitriptyline, amoxapine, clomipramine, doxépine, imipramine).
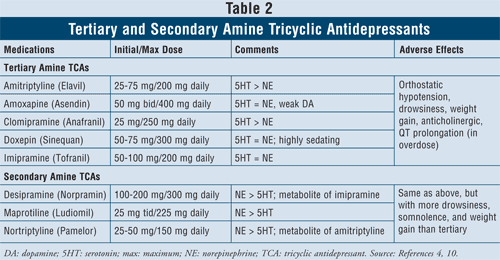
Les principaux effets indésirables de cette classe d’agents sont l’hypotension orthostatique, l’allongement de l’intervalle QT, la somnolence, la bouche sèche, la vision trouble, la constipation et la prise de poids. En général, les TCA à amine tertiaire ont plus d’activité sérotoninergique par rapport aux TCA à amine secondaire, qui ont plus d’activité noradrénergique, provoquant ainsi moins de somnolence, de somnolence et de prise de poids.
On sait que les TCA inhibent à la fois les enzymes CYP 2C19 et 2D6.11 Ils sont également métabolisés dans une moindre mesure par les enzymes CYP 1A2 et 3A4.12 Pour cette raison, bien que les interactions médicamenteuses avec ces agents puissent ne pas être la principale préoccupation, il est conseillé de faire preuve de prudence lors de l’association des TCA avec les ISRS, car le niveau plasmatique médicamenteux des TCA a le potentiel d’être multiplié par quatre, ce qui pourrait entraîner des effets toxiques.13,14
Lorsque l’on considère les caractéristiques et la sécurité des patients, les TCA sont contre-indiqués dans certaines conditions cardiaques spécifiques telles que les patients ayant des antécédents d’arythmies, de dysfonctionnement du nœud sinusal ou de défauts de conduction. La prudence est de mise chez les personnes âgées, car elles sont plus sensibles au blocage cholinergique ainsi qu’à l’hypotension orthostatique. En outre, les personnes souffrant également de démence seront particulièrement sensibles aux effets toxiques du blocage muscarinique sur la mémoire et les capacités d’attention et s’en sortiront généralement mieux si elles reçoivent des antidépresseurs ayant le plus faible degré d’effets anticholinergiques. Enfin, il faut faire preuve de prudence lorsqu’on envisage de commencer un TCA chez des patients ayant des pensées suicidaires, en raison des risques élevés de létalité en cas de surdosage. La dose létale n’est que huit fois supérieure à la dose thérapeutique, donc si les TCA sont ingérés en surdose, ils peuvent bloquer le nœud sinusal du cœur.
Inhibiteurs de la monoamine oxydase4,10 : Les IMAO disponibles sont l’isocarboxazide, la phénelzine, la sélégiline et la tranylcypromine (TABLEAU 3). À part la sélégiline, qui est un inhibiteur sélectif de la MAO B, tous les autres agents inhibent les enzymes MAO A et B responsables du métabolisme de la sérotonine, de la norépinéphrine et de la dopamine dans le cerveau. En raison des effets indésirables graves et des restrictions alimentaires requises, les IMAO sont généralement réservés aux patients qui ont échoué aux autres antidépresseurs.
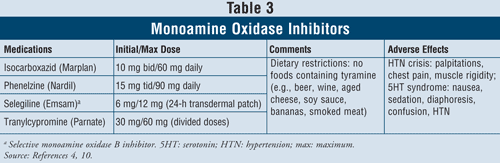
Une crise hypertensive peut survenir lorsque les patients prenant des IMAO ingèrent des aliments contenant de la tyramine, tels que la bière, le vin, le fromage vieilli et la viande fumée. Cette réaction se présente comme une apparition aiguë de céphalées sévères, de nausées, de raideur de la nuque, de palpitations cardiaques, de douleurs thoraciques et de confusion. Les IMAO peuvent également causer le syndrome sérotoninergique. Comme nous l’avons mentionné précédemment, ce syndrome survient le plus souvent lorsque les IMAO sont pris en concomitance avec d’autres agents sérotoninergiques comme les ISRS ou si la venlafaxine, un IRSN, est administrée peu après un IMAO. Lorsque les patients passent d’un ISRS à demi-vie courte à un IMAO, il est important de respecter une période d’élimination de 2 semaines entre l’arrêt de l’ISRS et le début de l’IMAO. Si la fluoxétine est l’ISRS, qui a une longue demi-vie, la période de washout devrait être de 5 semaines.4 D’autres effets indésirables peuvent survenir avec les IMAO tels que l’hypotension orthostatique, la prise de poids, la dysfonction sexuelle et l’insomnie.
En raison du taux élevé d’interactions médicamenteuses avec ces agents, la prudence est de mise lorsqu’ils sont prescrits à des patients asthmatiques utilisant des bronchodilatateurs sympathomimétiques. Chez les patients hypertendus, les IMAO peuvent induire une hypotension orthostatique, notamment en cas de traitement diurétique concomitant.
Inhibiteurs de la recapture de la sérotonine et de la norépinéphrine4,10 : Les IRSN tels que la desvenlafaxine, la duloxétine et la venlafaxine peuvent également être utilisés en première intention (TABLEAU 4). Ces médicaments sont plus sûrs que les TCA, et leurs effets indésirables sont similaires à ceux des ISRS, notamment les nausées, les vomissements et les dysfonctionnements sexuels, ainsi que l’élévation de la pression artérielle.
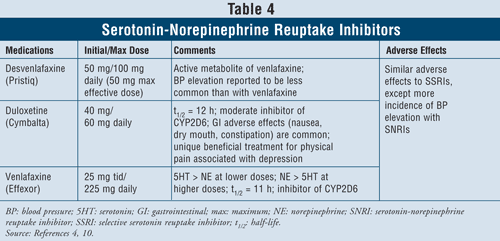
Il a été démontré que la venlafaxine entraîne une augmentation de la pression artérielle dans 3 % à 13 % des cas, tandis que la desvenlafaxine n’a été signalée que dans 1 % à 2 % des cas.10 Ainsi, il est recommandé d’éviter d’utiliser la venlafaxine chez les patients souffrant d’hypertension non contrôlée, car l’agent peut exacerber cette condition. La duloxétine a une activité noradrénergique plus importante que les deux agents susmentionnés, ce qui la rend utile pour les symptômes physiques tels que les douleurs musculaires, les maux de tête, les problèmes d’estomac et les douleurs généralisées, qui surviennent souvent chez les patients gravement déprimés. En raison de son efficacité sur les symptômes de la douleur, la duloxétine a également été approuvée pour d’autres indications telles que la fibromyalgie et la douleur neuropathique périphérique diabétique.15 Enfin, les trois agents ont une activité plus importante de la sérotonine que de la norépinéphrine à faible dose et plus importante de la norépinéphrine que de la sérotonine à dose plus élevée, ayant ainsi des effets indésirables dose-dépendants.
Autres antidépresseurs4,10 : Il existe plusieurs autres antidépresseurs dont le mécanisme d’action diffère des classes de médicaments décrites précédemment.
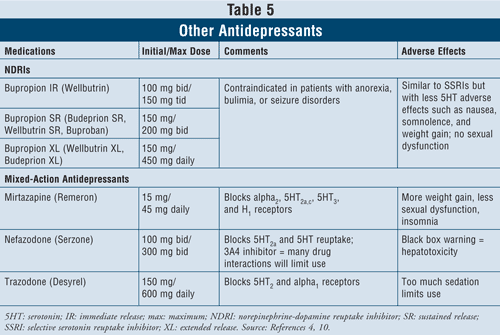
Les inhibiteurs de la recapture de la noradrénaline et de la dopamine (IRND) tels que le bupropion à libération immédiate (IR) de marque Wellbutrin (également disponible sous des formes posologiques à action prolongée telles que Wellbutrin XL, Wellbutrin SR, Budeprion SR, Budeprion XL et Buproban) peuvent être utilisés en première intention pour traiter la dépression (TABLEAU 5). Leurs effets indésirables sont semblables à ceux des ISRS, avec des effets sérotoninergiques minimes comme les nausées et la prise de poids et peu ou pas de dysfonctionnement sexuel. Il a été démontré que le bupropion exerce des effets bénéfiques sur les symptômes de la maladie de Parkinson chez certains patients, mais il peut également induire certains symptômes psychotiques, peut-être en raison de son action agoniste sur le système dopaminergique.16
Enfin, trois autres antidépresseurs à action mixte sont disponibles : la mirtazapine, la néfazodone et la trazodone (TABLEAU 5). Ces trois agents bloquent des récepteurs sérotoninergiques différents et ont donc des effets distincts. La mirtazapine entraîne un gain de poids plus important en augmentant l’appétit. La néfazodone a des utilisations limitées en raison de son hépatotoxicité et de l’inhibition de l’enzyme CYP3A4, ce qui entraîne des interactions médicamenteuses. La trazodone bloque en grande partie les récepteurs sérotoninergiques, avec une faible liaison aux récepteurs muscariniques. Des effets indésirables tels que sédation, maux de tête, troubles de la mémoire, sécheresse de la bouche et constipation peuvent survenir. La prudence est également de mise lors de l’utilisation de la trazodone chez les hommes en raison du risque de priapisme.
Conclusion
En général, les médicaments antidépresseurs se sont révélés aussi efficaces les uns que les autres ; Par conséquent, le choix des médicaments doit être basé sur les effets indésirables, les interactions médicamenteuses, la sécurité et les préférences du patient. Plusieurs algorithmes sont disponibles pour guider le clinicien pendant le traitement du patient, en particulier l’algorithme récemment mis à jour du Texas Department of State Health Services pour le traitement du TDM (mis à jour en juillet 2008).17 Si les patients présentent une réponse partielle, les cliniciens peuvent choisir d’augmenter la dose, de passer à un autre agent ou d’administrer une combinaison d’antidépresseurs. Au contraire, si les patients ne répondent pas ou ne peuvent pas tolérer le médicament, le passage à un agent alternatif est également approprié, en tenant compte du fait que les effets thérapeutiques se produisent généralement entre 4 et 6 semaines, même si des effets indésirables peuvent apparaître après 1 semaine de traitement.4,17 De plus, si les effets indésirables apparaissent au début du traitement, ils se dissipent généralement après 2 à 3 semaines.4,17 Néanmoins, l’antidépresseur qui assurera le plus probablement l’amélioration et la sécurité d’un patient peut être déterminé, au moins partiellement, par essais et erreurs. Étant donné la difficulté de prédire quel médicament sera à la fois efficace et toléré par un patient donné, il est prudent et utile de se familiariser avec un large éventail d’antidépresseurs.
1. Song F, Freemantle N, Sheldon TA, et al. Inhibiteurs sélectifs de la recapture de la sérotonine : méta-analyse de l’efficacité et de l’acceptabilité. BMJ. 1993;306:683-687.
2. Geddes JR, Freemantle N, Mason J, et al. SSRIs versus other antidepressants for depressive disorder. Cochrane Database Syst Rev. 2000 ;(2):CD001851.
3. Rush AJ, Wisniewski SR, Warden D, et al. Selecting among second-step antidepressant medication monotherapies : predictive value of clinical, demographic, or first-step treatment features. Arch Gen Psychiatry. 2008;65:870-881.
4. American Psychiatric Association. Manuel diagnostique et statistique des troubles mentaux, quatrième édition, révision du texte (DSM-IV-TR). Washington, DC : American Psychiatric Association ; 2000.
5. Groupe de travail sur le trouble dépressif majeur. Guideline Watch : Lignes directrices de pratique pour le traitement des patients atteints de trouble dépressif majeur. 2e éd. Washington, DC : American Psychiatric Association ; 2005.
6. Cain RA. Naviguer l’étude Sequenced Treatment Alternatives to Relieve Depression (STAR*D) : résultats pratiques et implications pour le traitement de la dépression dans les soins primaires. Prim Care Clin Office Pract. 2007;34:505-519.
7. Depression. Organisation mondiale de la santé. www.who.int/mental_health/management/depression/definition/en. Consulté le 5 octobre 2009.
8. Dipiro JT, Talbert RL, Yee GC, et al. Pharmacotherapy : A Pathophysiologic Approach. 6th ed. New York, NY : McGraw-Hill ; 2005.
9. Révisions de l’étiquetage des produits. Suicidalité et médicaments antidépresseurs. FDA. www.fda.gov/downloads/Drugs/DrugSafety/InformationbyDrugClass/UCM173233.pdf. Consulté le 5 octobre 2009.
10. Informations sur les médicaments. Micromedex Healthcare Series. Greenwood Village, CO : Thomson Micromedex. www.micromedex.com. Consulté le 5 octobre 2009.
11. Shin J-G, Park J-Y, Kim M-J, et al. Inhibitory effects of tricyclic antidepressants on human cytochrome P450 enzymes in vitro : mechanism of drug interaction between TCAs and phenytoin. Drug Metab Dispos. 2002;30:1102-1107.
12. Brown CH. Aperçu des interactions médicamenteuses avec les ISRS. US Pharm. 2008;33(1):HS3-HS19.
13. Spina E, Scordo MG, D’Arrigo C. Metabolic drug interactions with new psychotropic agents. Fundam Clin Pharmacol. 2003;17:517-538.
14. Bergstrom RF, Peyton AL, Lemberger L. Quantification and mechanism of the fluoxetine and tricyclic antidepressant interaction. Clin Pharmacol Ther. 1992;51:239-248.
15. Cymbalta (chlorhydrate de duloxétine) notice de conditionnement. Indianapolis, IN : Eli Lilly and Company ; février 2009. http://pi.lilly.com/us/cymbalta-pi.pdf. Consulté le 5 octobre 2009.
16. Goetz CG, Tanner CM, Klawans HL. Le bupropion dans la maladie de Parkinson. Neurologie. 1984;34:1092-1094.
17. Suehs B, Argo TR, Bendele SD, et al. Manuel de procédure du Texas Medication Algorithm Project. Algorithmes pour le trouble dépressif majeur. Texas Department of State Health Services ; juillet 2008. www.dshs.state.tx.us/mhprograms/pdf/TIMA_MDD_Manual_080608.pdf. Consulté le 5 octobre 2009.
Pour commenter cet article, contactez [email protected].