En este post introducimos los carbamatos como un grupo protector útil para las aminas, particularmente en el contexto de la fabricación de péptidos.
Aquí tienes una imagen resumen rápida de lo que trataremos en este post, con más detalles a continuación.
Tabla de contenidos
- Introducción a la síntesis simple de péptidos
- Mezclemos un lote de Gly-Ala
- Un plan inicial muy malo
- «¡Hark! ¿Qué mierda es esto?»
- Un sombrero protector para el NH2
- ¡Mate! ¡Usa un carbamato, amigo!
- Boc y CBz son las rodillas de las abejas
- Instalación y eliminación del grupo protector «Boc»
- Instalación y eliminación del grupo protector carbamato CBz (o «Z»)
- Una síntesis peptídica sencilla utilizando grupos protectores carbamato
- Sigue…
- Notas
- (Avanzadas) Referencias y Lecturas Adicionales
Una Introducción a la Síntesis de Péptidos Simples
En un post reciente repasamos 3 formas comunes de hacer amidas:
- Añadir aminas a haluros de acilo / anhídridos
- Hidrólisis parcial de nitrilos
- Acoplamiento de ácidos carboxílicos con aminas utilizando un agente deshidratante como la DCC (N,N’-dicyclohexylcarbodiimide).
Lo que faltaba en ese post era cualquier mención de sintetizar el gran abuelo de la mayoría de los enlaces amídicos útiles conocidos por la humanidad, y con eso me refiero a los péptidos.
Un enlace peptídico es el nombre que damos al enlace amida que une dos aminoácidos.
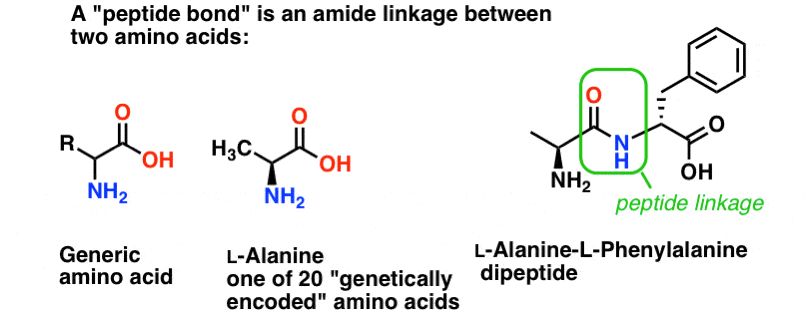
Y los aminoácidos son importantes porque… espera. Ya sabes por qué los aminoácidos son importantes, ¿verdad? Si no lo sabes ahora mismo, vuelve después de leer esto.
Mezclemos un lote de Gly-Ala
Intentemos aplicar algunas de nuestras recién descubiertas habilidades de síntesis de amidas para intentar construir un dipéptido realmente simple, glicina-alanina. Si podemos construir un dipéptido simple ahora, podemos utilizar lo que hemos aprendido para mostrar cómo se hacen péptidos aún más complejos en un post posterior. ¿Sabías que el premio Nobel Bruce Merrifield sintetizó la insulina uniendo un aminoácido cada vez? Sí, de verdad.
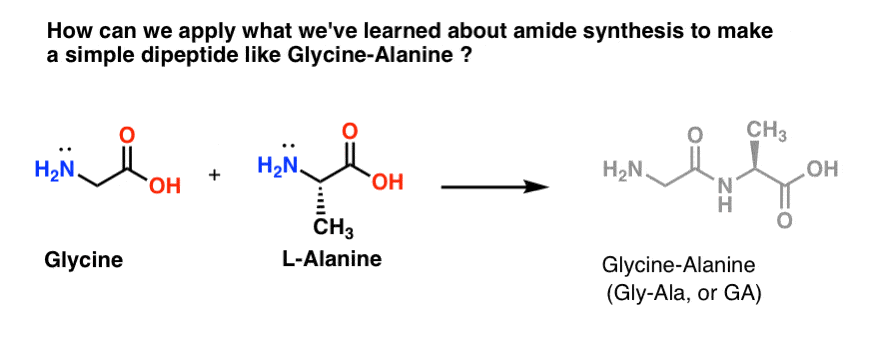
De los tres métodos que enumeramos para hacer amidas, sólo dos son potencialmente útiles para formar enlaces peptídicos: 1) el método del cloruro ácido, o 2) la síntesis mediante un agente de acoplamiento como el DCC. .
3. Un plan inicial muy malo
Nuestro primer intento de síntesis de péptidos implicará avanzar con un plan de ataque muy ingenuo y esperar que todo funcione al final. Agárrense amigos, ya que esto se va a complicar.
Empezaremos proponiendo el método del cloruro ácido para la síntesis de Gly-Ala.
Mirando hacia atrás desde el dipéptido Gly-Ala, nuestro plan nos haría sintetizar el enlace peptídico a través de la reacción de la alanina con el cloruro ácido derivado de la glicina:
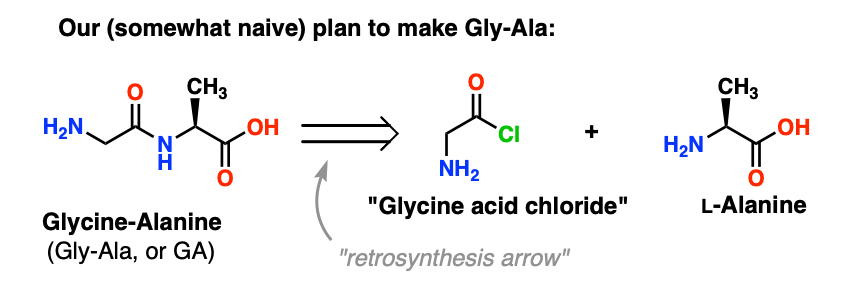
Hay un pequeño problema con este plan. Puede ser un poco difícil de detectar al principio.
Supongamos que hemos hecho el cloruro ácido de la glicina* , y que tenemos el «cloruro ácido de la glicina» y la alanina juntos en el mismo matraz, junto con algún exceso de base para acelerar las cosas.
Dibujamos la reacción en el sentido de la marcha:
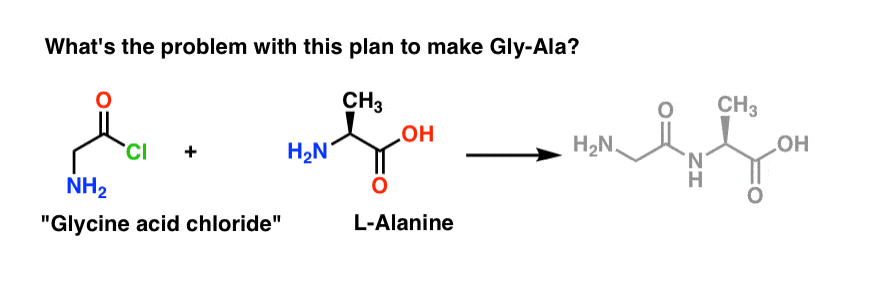
¿Qué podría salir mal?
«¡Hark! ¿Qué mierda es esto? »
Nuestro plan es hacer una solución del cloruro ácido de glicina (1 equivalente molar), y luego hacer que espere pacientemente en el matraz hasta que añadamos un equivalente molar de alanina, con lo que reaccionaría con el grupo NH2 nucleófilo de la alanina.
El problema con nuestro plan es que no estamos tratando con una sola molécula de «cloruro ácido de glicina» – estamos tratando con algo alrededor de un mol (6,02 x 1023 moléculas) de la misma. Y el cloruro de ácido de glicina ya tiene un grupo nucleófilo NH2!
«Cloruro de ácido de glicina» como dibujado, no es una molécula estable, porque puede reaccionar con sí mismo.
Esto significa que una solución de cloruro de ácido de glicina dejada a sus propios dispositivos formaría un polímero de glicina, con la estructura Gly-Gly-Gly-Gly…
Incluso una solución de cloruro de ácido de glicina en la presencia de alanina no sólo formaría el deseado Gly-Ala, pero también Gly-Gly (con un haluro de acilo unido) que puede ir a realizar más travesuras con otro nucleófilo, si es Gly o Ala:
(y no, no hay mucho para distinguir el NH2 de «cloruro de ácido de glicina» del NH2 de alanina. Son casi igual de reactivos.)
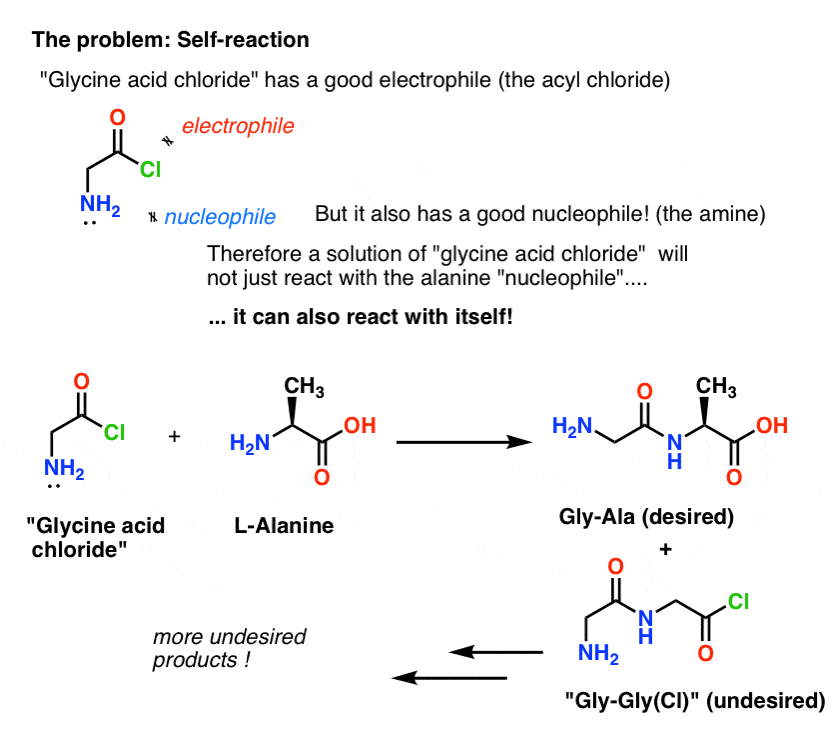
La lección aquí es que cuando tienes una solución de una molécula que contiene tanto un nucleófilo como un electrófilo, puede autorreaccionar. Hay un nombre para este proceso que puede sonar familiar: polimerización.
Entonces, ¿cómo evitamos que esto ocurra?
Un sombrero protector para el NH2
La mejor manera es «tapar» el nitrógeno de alguna manera con un grupo protector (PG) que haga que el grupo NH2 no sea nucleófilo. También debe tener las siguientes propiedades:
- se instala fácil y selectivamente
- inerte a las condiciones de reacción deseadas (por ejemplo SOCl2 para hacer el cloruro de ácido a partir del ácido carboxílico)
- fácil y selectivamente eliminado sin afectar al producto final
Hemos visto estrategias de grupos protectores antes, particularmente con alcoholes y el uso de reactivos de Grignard.
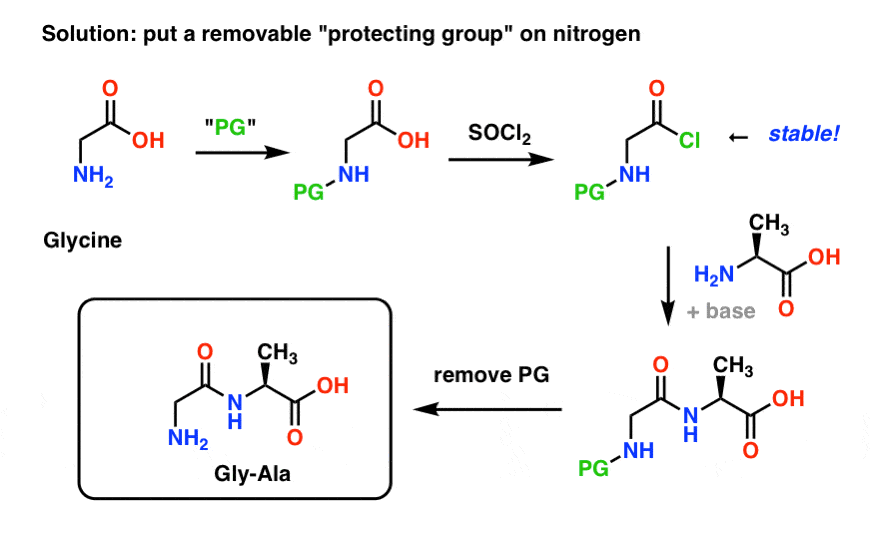
Aquí se ve cómo podría ser una estrategia de grupo protector para nuestra síntesis de «Gly-Gly». Instalamos un grupo protector («PG») en la glicina, luego hacemos el cloruro de ácido. El PG debe elegirse de forma que el nitrógeno no sea nucleófilo (es decir, que no reaccione con el cloruro ácido).
Entonces podemos formar nuestro enlace peptídico con la alanina desprotegida y luego eliminar el PG en condiciones suaves.
Una estrategia de grupo protector para el nitrógeno que ya hemos explorado es la síntesis de Gabriel, que utiliza ftalimida (se puede pensar en una ftalimida como un nitrógeno protegido). Esto se ha utilizado para sintetizar Gly-Gly («glycylglycine»). Uno de los problemas, sin embargo, es que se requieren condiciones relativamente duras (mucho calor) tanto para instalar como para eliminar el grupo ftalimida, y este no es un entorno muy saludable para la supervivencia de aminoácidos sensibles y quirales, que pueden racemizar fácilmente.
Otra opción potencial es proteger el nitrógeno como una amida, pero las amidas de escisión pueden requerir condiciones duras también. Además, ya que estamos tratando de forjar un enlace amida (péptido) aquí de todos modos, podríamos tener problemas de selectividad con su eliminación – destruyendo el pueblo con el fin de salvarlo.
¡Mate! ¡Usa un carbamato, amigo!
La elección más popular de grupo protector para el nitrógeno de la amina es el grupo funcional carbamato. Un carbamato parece el hijo bastardo de un éster y una amida, con N y O flanqueando un carbonilo.
El nitrógeno de un carbamato es relativamente no nucleófilo, y además, los carbamatos son:
- fácilmente instalados en el nitrógeno
- inerte a una amplia variedad de condiciones de reacción
- fácilmente eliminados sin afectar a los grupos amida existentes
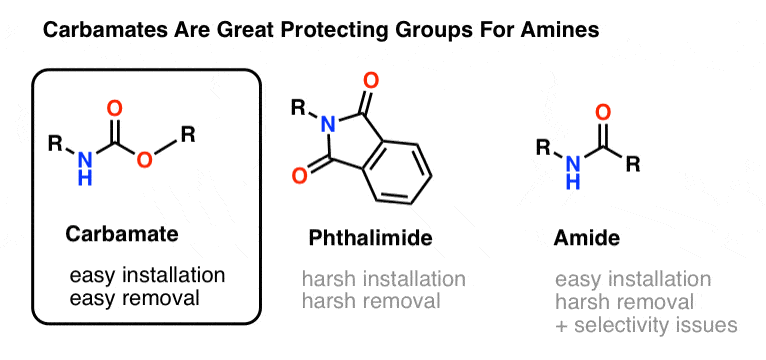
Esto los hace perfectos para nuestros propósitos.
Boc y CBz son las rodillas de las abejas
Dos grupos protectores de carbamato populares son Boc (t-Butiloxicarbonilo) y CBz (carboxibencil).
Para nuestros propósitos, estos dos grupos protectores pueden considerarse más o menos equivalentes, ya que cualquiera de ellos puede utilizarse eficazmente para la síntesis de péptidos.
La diferencia clave está realmente en cómo se eliminan (es decir, el paso de «desprotección»). Elegir entre uno u otro se vuelve crucial una vez que se tiene una molécula compleja con múltiples grupos protectores; eso entra en la categoría de «estrategia sintética avanzada», que es más un tema para Org 3.
Instalación y eliminación del grupo protector «Boc»
El grupo Boc se suele instalar con «Boc2O» (a veces denominado «anhídrido de Boc»), y se elimina con ácido. La elección habitual es el ácido trifluoroacético (TFA) «puro» (es decir, sin diluir), que arranca los grupos Boc muy limpiamente, liberando CO2 y alcohol t-butílico.
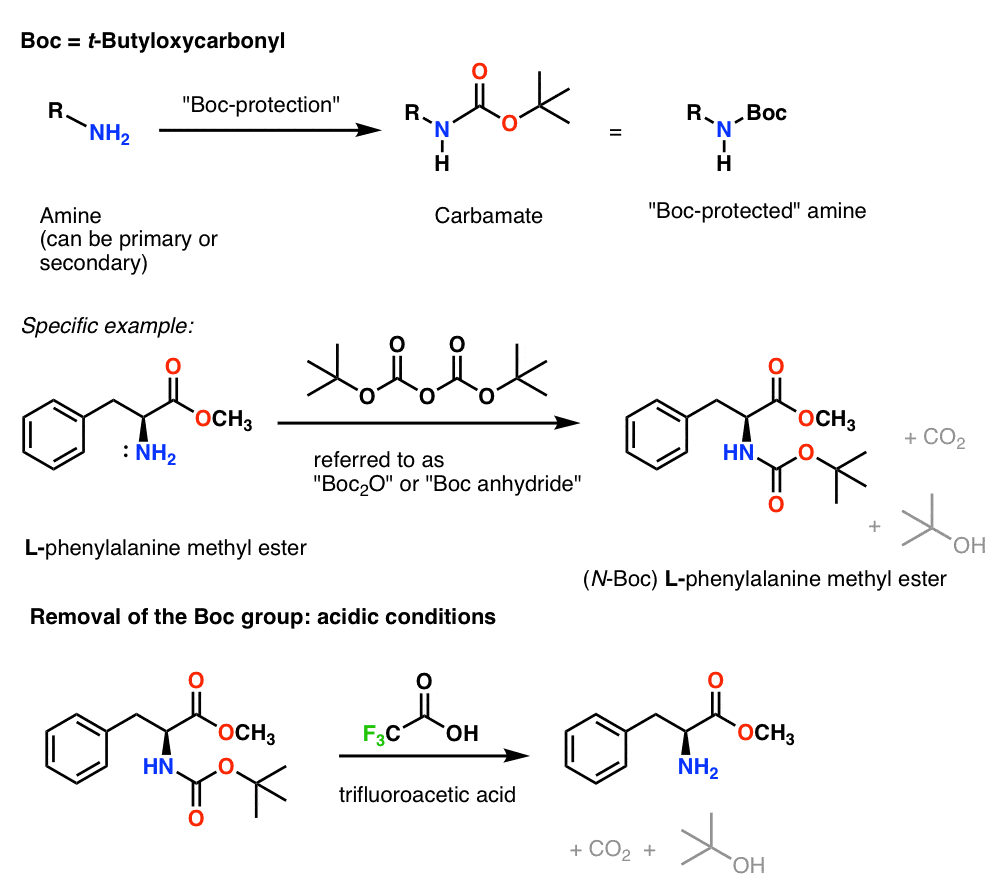
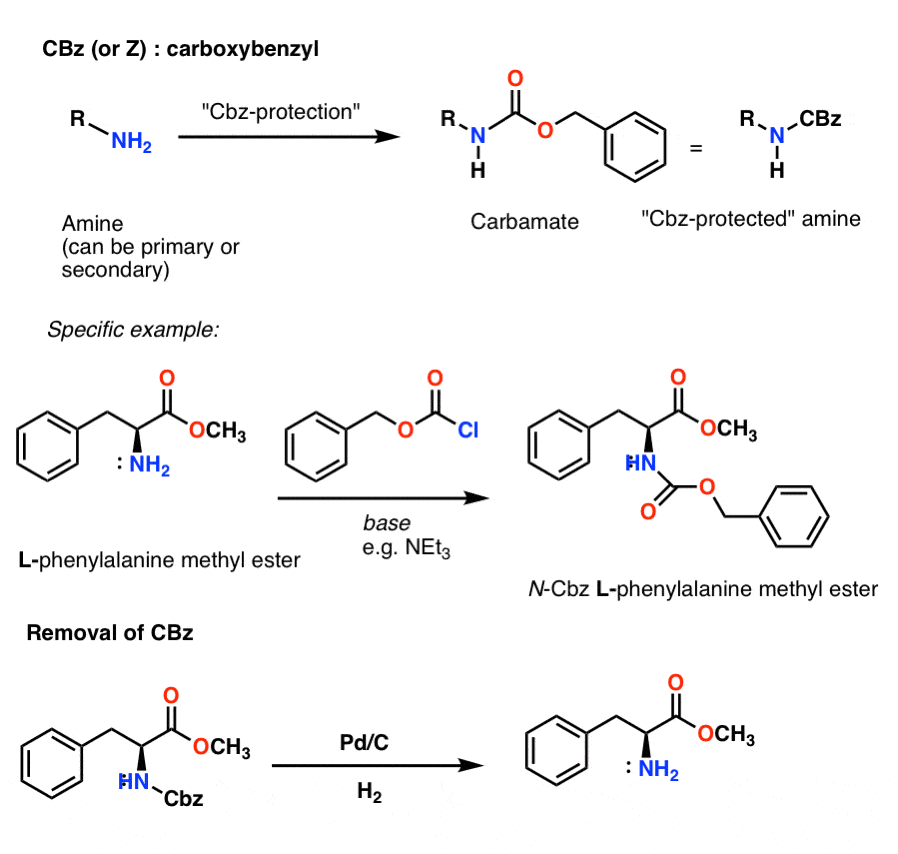
Instalación y eliminación del grupo protector carbamato CBz (o «Z»)
El grupo Cbz (a veces abreviado como «Z») puede instalarse con CbzCl y una base suave, y normalmente se elimina mediante hidrogenación catalítica (Pd-C/H2). Esto es extremadamente suave y tiene la ventaja de ocurrir a pH neutro, dejando los grupos funcionales sensibles al ácido o a la base solos.
Una síntesis peptídica sencilla utilizando grupos protectores de carbamato
Volvamos a la síntesis peptídica y apliquemos esta estrategia de grupos protectores para hacer Gly-Ala.
Comenzamos con un aminoácido como la L-alanina. Tratando la alanina con Boc2O, obtenemos L-alanina protegida por N-Boc. El siguiente paso es formar un cloruro de ácido utilizando SOCl2. Una vez formado, añadimos nuestra amina (por ejemplo, L-valina) en presencia de un exceso de base, formando nuestro enlace amida clave. El paso final para dar el dipéptido es desproteger la amina protegida por Boc con ácido trifluoroacético (TFA), y ¡voilá! tenemos nuestro dipéptido.
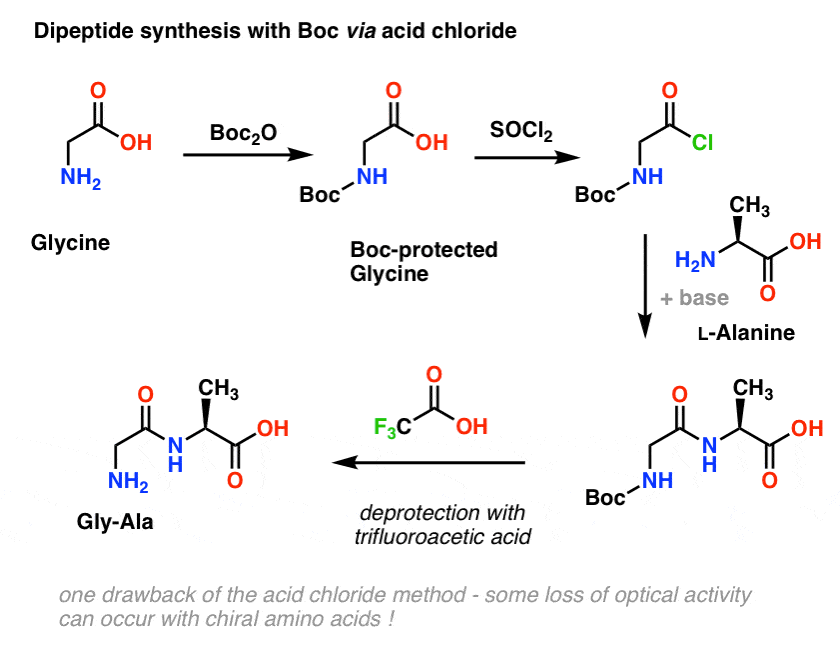
Aunque este método puede ser bueno sobre el papel, un problema del uso de cloruros de ácido en la práctica es que los aminoácidos quirales a menudo pierden su pureza óptica a través de este método, un proceso que a veces se conoce como «racemización», pero más correctamente llamado «epimerización» (técnicamente más correcto, porque un hidrógeno en un centro quiral se invierte)
Dado que la quiralidad de los aminoácidos es esencial para su función biológica, generalmente se utiliza un protocolo ligeramente más suave que emplea DCC o un reactivo de acoplamiento similar.
Aquí, tratamos la glicina protegida por Boc con DCC para activar el ácido carboxílico. Luego añadimos nuestro aminoácido nucleófilo (L-alanina) que forma el dipéptido. Si queremos aislar el dipéptido Gly-Ala en este punto, podemos entonces eliminar el grupo Boc con TFA.
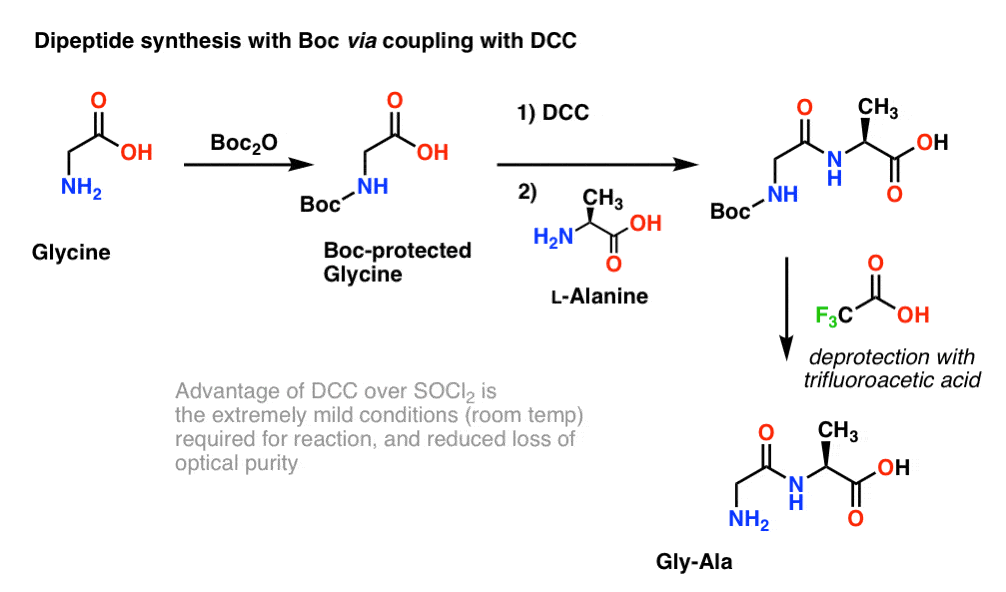
(nota sobre este esquema)
Sigue adelante…
Nótese que si quisiéramos hacer un tripéptido, podemos seguir realizando ciclos de adición de DCC (para activar el ácido carboxílico) seguidos de adición de nuevos aminoácidos, ¡construyendo el péptido una unidad cada vez!
Hay un método particularmente eficaz para la construcción de péptidos más largos iniciado por Bruce Merrifield (y aplicado en la síntesis de la insulina, entre otros) llamado síntesis de péptidos en fase sólida, que vamos a cubrir la próxima vez que estamos en este tema.
Notas
Nota 1. Similar al viejo chiste del economista que propone un plan para salir de una isla desierta:
«Supongamos que tenemos un barco».
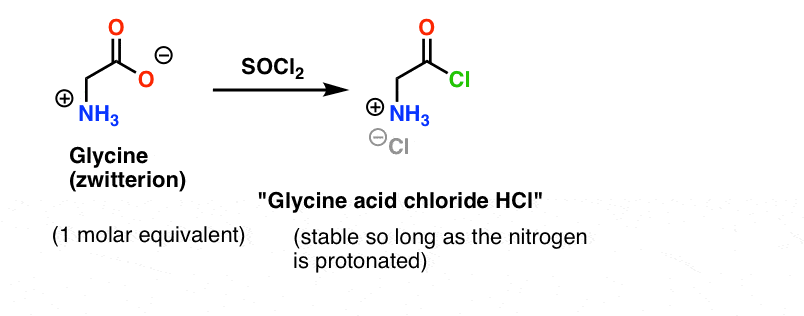
La glicina (como todos los aminoácidos) es en sí misma un zwitterion. El tratamiento de la glicina con SOCl2 debería producir el cloruro de ácido con una amina protonada. Esto debería ser relativamente estable en solución mientras no se añada ninguna base.
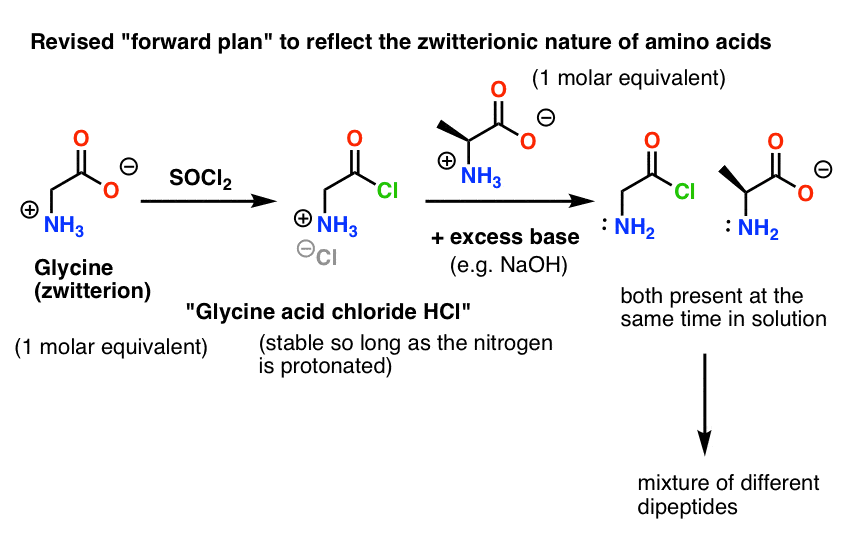
Aquí está el problema. Como nuestro aminoácido nucleófilo (alanina) también es zwitteriónico, no puede producirse ninguna reacción hasta que se añada un exceso de base para liberar un par solitario en el nitrógeno de la alanina. Después de añadir la base, tenemos el «cloruro de ácido de glicina» y la alanina juntos en solución. No hay ninguna diferencia apreciable en la nucleofilia entre los nitrógenos de estas dos especies, y cada uno de ellos competirá para reaccionar con el nucleófilo del cloruro ácido, dando lugar a una mezcla de Gly-Ala y Gly-GlyCl, y el Gly-GlyCl puede entonces reaccionar más con los diversos nucleófilos preestablecidos en la solución para dar péptidos tri-, tetra- y superiores.
Nota 2. John Sheehan, a quien conocimos antes como el inventor del DCC en camino a ser el primero en sintetizar la penicilina, también hizo Gly-Gly protegida con ftalilo a través de una síntesis de Gabriel:
Referencia aquí (JACS, 1949, 71, 1856)
Nota 3. Otro problema con el uso de grupos protectores amida es la formación de azlactona, que puede conducir a la epimerización de los aminoácidos quirales. Véase también este conjunto de problemas.
Nota 4. «Grupos protectores ortogonales». En la planificación sintética es a menudo de crucial importancia tener grupos protectores que sean removibles bajo condiciones claramente diferentes. Esta propiedad se conoce a menudo como «ortogonalidad»
Por ejemplo, en el siguiente dipéptido tenemos dos grupos protectores diferentes en el nitrógeno – uno Boc y otro CBz. Al seleccionar grupos protectores «ortogonales», cada nitrógeno es direccionable – podemos elegir qué grupo protector eliminar, y nuestra síntesis puede proceder desde allí. Esto evita que nos encontremos en una situación en la que tengamos dos aminas sin protección y tengamos que confiar en que una sea más reactiva que la otra. Estos enfoques rara vez funcionan!
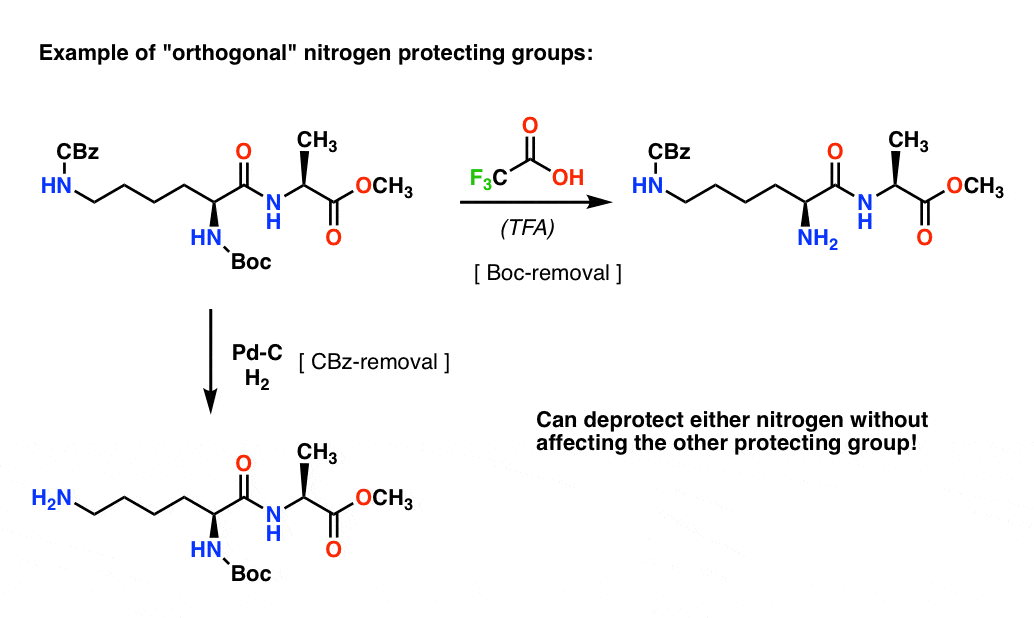
Una nota – para simplificar aquí la alanina se representa con un ácido carboxílico libre, pero un enfoque ligeramente mejor sería utilizar el éster metílico de la alanina para evitar cualquier auto-acoplamiento entre la amina libre de la alanina y el ácido carboxílico libre.
Mate…
(Avanzado) Referencias y Lecturas Adicionales
Los carbamatos son útiles como grupos protectores para las aminas, y los más comúnmente empleados son -Boc, -Cbz, y -Fmoc.
- Über ein allgemeines Verfahren der Peptid-Synthese
Max Bergmann and Leonidas Zervas
Ber. 1932, 65 (7), 1192-1201
DOI: 10.1002/cber.19320650722
El grupo protector -Cbz (carboxibencil) fue utilizado por primera vez por Max Bergmann y Leonidas Zervas en 1932 para la síntesis de péptidos, y a veces se abrevia «-Z» en honor a Zervas. - REMOCIÓN DE LOS GRUPOS PROTECTORES DEL t-BUTIL Y EL t-BUTOXICARBONILO CON ÁCIDO TRIFLUOROACÉTICO
Mecanismos, formación de biproductos y evaluación de los secuestradores
Behrend F. Lundt, Nils L. Johansen, Aage Vølund y Jan Markussen
J. Pept. Prot. Res. 1978, 12 (5), 258-268
DOI: 10.1111/j.1399-3011.1978.tb02896.x
En la práctica, se suelen añadir secuestradores nucleófilos (por ejemplo, tioles) al cóctel de ácidos (TFA) cuando se desprotege, ya que la desprotección de Boc dará especies t-butílicas electrofílicas (por ejemplo, trifluoroacetato de t-butilo) que pueden reaccionar con residuos sensibles (por ejemplo, Trp o Cys). - Un método de síntesis de cadenas peptídicas largas utilizando una síntesis de oxitocina como ejemplo
Miklos Bodanszky y Vincent du Vigneaud
Journal of the American Chemical Society 1959, 81 (21), 5688-5691
DOI: 1021/ja01530a040
En la primera mitad del siglo XX, la síntesis de péptidos se realizaba utilizando técnicas estándar de química orgánica en fase de solución. Esto se conoce ahora como LPPS (síntesis de péptidos en fase líquida). du Vigneaud recibió el Premio Nobel de Química en 1955 por su trabajo al demostrar que se podía lograr la síntesis de péptidos, utilizando la elección correcta de grupos protectores y estrategias sintéticas. - LA FORMACIÓN TEMPORAL DEL ANILLO DE AZLACTONA EN LA RACEMIZACIÓN DE DERIVADOS ACÍLICOS DE AMINOÁCIDOS CON ANHIDRIDO ACÉTICO
Vincent du Vigneaud y Curtis E. Meyer
Biol. Chem. 1932, 99:143-151
http://www.jbc.org/content/99/1/143.citation
Otro problema con el uso de grupos protectores de amidas es la formación de azlactona, que puede conducir a la epimerización de los aminoácidos quirales. - Una nueva ruta sintética a los péptidos
John C. Sheehan y Victor S. Frank
Journal of the American Chemical Society 1949, 71 (5), 1856-1861
DOI: 10.1021/ja01173a095
John Sheehan, el inventor del DCC en el camino hacia la primera síntesis de la penicilina, también hizo Gly-Gly protegido por ftalilo mediante una síntesis de Gabriel. - Un nuevo método para formar enlaces peptídicos
John C. Sheehan y George P. Hess
Journal of the American Chemical Society 1955, 77 (4), 1067-1068
DOI: 1021/ja01609a099
Documento original sobre la síntesis de enlaces peptídicos/enlaces de amida utilizando DCC. - La función 9-Fluorenilmetoxicarbonilo, un nuevo grupo amino-protector sensible a las bases
Louis A. Carpino y Grace Y. Han
Journal of the American Chemical Society 1970, 92 (19), 5748-5749
DOI: 10.1021/ja00722a043 - Grupo amino-protector 9-Fluorenilmetoxicarbonilo
Louis A. Carpino y Grace Y. Han
The Journal of Organic Chemistry 1972 37 (22), 3404-3409
DOI: 10.1021/jo00795a005
El descubrimiento y desarrollo del grupo protector -Fmoc para aminas añade otra capa de ortogonalidad a las estrategias de protección/desprotección de aminas. El grupo -Fmoc es lábil a las bases, y en la síntesis de péptidos se suele eliminar con un 20% de piperidina en DMF. El Cbz se elimina por hidrogenación, el -Boc se elimina con ácido y el -Fmoc con base.