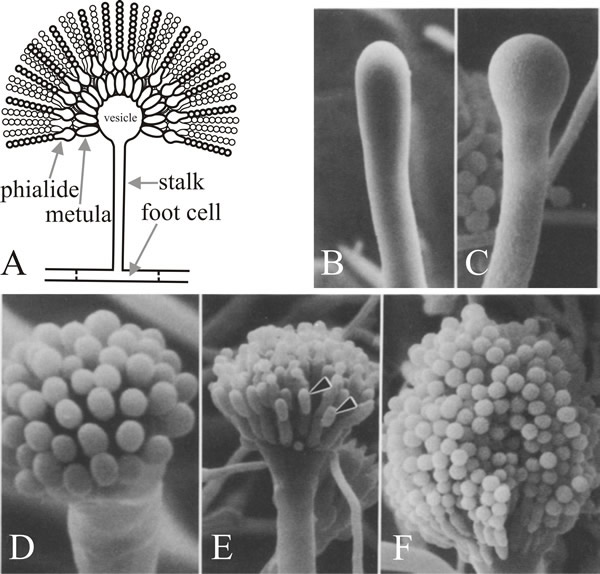
A sejt, amelyből az ág kilép, a conidiophore lábsejt, amelyet az különböztet meg a többi vegetatív sejttől, hogy eredeti falának belső oldalán barna pigmentált másodlagos falvastagság található. A szár apikálisan növekszik, amíg el nem éri a kb. 100 µm hosszúságot, amikor a csúcs megduzzad, és kialakul a kb. 10 µm átmérőjű konídiumos vezikulum. Ezután a számos elsődleges sterigma, az úgynevezett metulae, egyetlen rétegben bimbózik a vezikulából, a másodlagos sterigmák, a phialidák, pedig a metulae szabad csúcsából bimbóznak. A phialidák az őssejtek, amelyek később ismételt aszimmetrikus osztódásokon mennek keresztül, hogy hosszú, körülbelül 3 µm átmérőjű enteroblasztos konídiumláncokat képezzenek (7. ábra).
A klasszikus genetikai elemzés mutánsok izolálásával és elemzésével megállapította az Aspergillus konídiumképződés alapvető genetikai vázlatát. A konídiumképződést befolyásoló lókuszok mutációs gyakoriságának összehasonlításával a konídiumképződést befolyásoló lókuszok és az egyéb funkciók mutációs gyakoriságának összehasonlításával 300 és 1000 génlókusz közöttire becsülték a konídiumképzéssel kapcsolatos génlókuszokat (Martinelli & Clutterbuck, 1971). Az mRNS-fajok elemzése azt mutatta, hogy körülbelül 6000 kifejeződik a vegetatív micéliumban, és további 1200 található a konídiumokat és konídiumokat tartalmazó kultúrákban; ezek közül 200 további mRNS található magukban a konídiumokban. Az A. nidulans konídiumhiányos mutánsainak csak kb. 2%-a mutatott hibát a konídiumfórák növekedésével és fejlődésével kapcsolatos szakaszokban, és a konídiummutánsok 85%-a a vegetatív hifák növekedésében és a kompetencia elérésében is hibás volt.
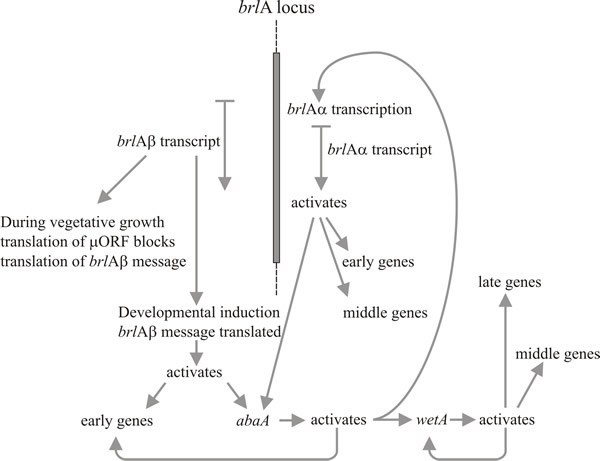
Különösen két gén játszik kulcsszerepet a konídiumfórák morfogenezisében: ezek a “bristle” (brlA) gén, amely hibás a vezikulák és metulák képződésében, és az “abacus” (abaA) gén, amelyben a konídiumok helyett gyöngyház alakú hifahosszúságúak, így feltehetően hibás a konídiumok phialidából való kihajtásában és a végső szeptációban. Egy harmadik gén, a wetA, a spóraérés korai szakaszában hibás. A wetA mutánsok konídiumaiból hiányzik a pigment és a hidrofóbitás; néhány óra múlva autolizálódnak, és nem expresszálnak egy sor spóraspecifikus mRNS-t. A wetA gén átirata hiányzik a brlA és abaA mutánsokból (azaz a brlA és abaA episztatikusan hat a wetA-ra), és a kettős mutánsokon végzett vizsgálatok azt mutatják, hogy ez a három gén a következő sorrendben hat: brlA → abaA → wetA.
Az A. nidulans konídiumfejlődésének mutációs elemzése során feltűnő, hogy csak ennek a három génnek a mutánsai okoznak hibákat a konídiumfejlődésben és a spóra morfogenezisében, míg mutáció esetén akár 1000 más génloci is a konídiumképződés hiányát okozza. Ez arra utal, hogy a brlA, abaA és wetA olyan szabályozók, amelyek más, a konídiumképződéshez szükséges, de önmagukban nem a konídiumképződéshez kötődő gének kifejeződését integrálják. Az Aspergillus konídiumképző mutánsok közül sokan az ivaros szaporodásban is hibásak voltak, így egy másik következtetés az, hogy a különböző fejlődési folyamatokban a morfogenetikai gének használatában van némi gazdaságosság. Feltehetően a különböző fejlődési módok olyan szerkezeti géneket alkalmaznak, amelyek nem kizárólagosan fejlődési gének, hanem számos útvonalban működnek, és fejlődésspecifikus jellegüket azok a szabályozók adják meg nekik, amelyekre reagálnak. Ezt fejezi ki az az elképzelés, hogy az eukarióta fejlődés kulcsa abban a képességben rejlik, hogy viszonylag kevés szabályozó gént használnak sok más gén tevékenységének integrálására.
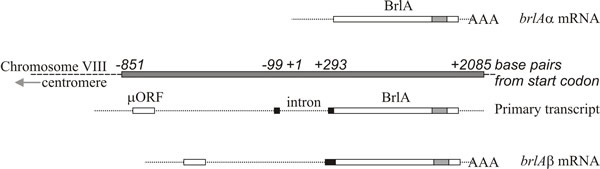
A molekuláris elemzés alátámasztja azt az értelmezést, hogy a brlA, abaA és wetA szabályozók; a brlA szekvencia egy cinkujj fehérjét kódol, amely egy szekvenciaspecifikus DNS-kötő transzkripciós aktivátor a fejlődésileg szabályozott célgének számára (8. ábra). Ez azonban nem a teljes történet, mivel a brlA termék eltérő affinitással rendelkezik a különböző célgénekhez. A brlA-lokusz ugyanis egymást átfedő transzkripciós egységekből áll (9. ábra), a downstream egységet brlAα-nak, a upstream egységet pedig brlAβ-nak nevezzük; termékeik egymás között két klasszikus fejlődési problémát oldanak meg: hogyan válaszoljunk egy jelre, és hogyan tartsuk fenn ezt a választ, amikor a jel eloszlik.
A két brlA transzkripciós egység hosszának nagy részén ugyanaz az olvasási keret, de a brlAβ-nak az olvasási keret amino-terminális végén további 23 aminosavmaradvány van, és a transzkriptje az 5′ terminus közelében egy 41 aminosavmaradványból álló külön olvasási kerettel (µORF) is rendelkezik. A µORF termék elnyomja a fordítást a downstream (BrlA) leolvasási keretből, és bár a brlAβ transzkriptum kimutatható a vegetatív hifákban, a BrlA peptid nem termelődik. A µORF által okozott represszió csak akkor szűnik meg, ha a micélium kompetens, amit valószínűleg nitrogénlimitáció jelez (az Ascomycotákban gyakori környezeti jel a sporuláció beindításához), ami csökkenti az aminoacil-tRNS-poolokat és megzavarja a µORF általi transzlációs szabályozást. Amikor a µORF hatása leáll, a BrlA peptid a meglévő transzkriptumról lefordítható.
A folyamat felfedezője a konídiumképződési útvonal aktiválását “transzlációs triggerelésként” írta le (Timberlake, 1993), ami arra utal, hogy a transzlációs triggerelés egy módja annak, hogy a differenciálódás érzékennyé váljon a hifa tápláltsági állapotára. A kompetens hifát tehát felkészítik a konídiumfejlődésre, de a konídiumképződési útvonal irreverzibilis aktiválódását megakadályozza egy transzlációs represszió, amely fenntartja a vegetatív növekedést, amíg a sporulációs feltételek ideálisak nem lesznek.
A brlA aktiválódása tehát a konídiumfejlődés első lépésének tekinthető, és terméke viszont a konídium-specifikus gének egy csoportját aktiválja, amelyek között a következő szabályozó, az abaA is megtalálható. Az abaA terméke szintén egy DNS-kötő transzkripciós szabályozó fehérje, amely fokozza a brlA által indukált strukturális gének kifejeződését. A brlA és az abaA gének reciprok aktivátorok, mivel az abaA a brlA-t is aktiválja. Természetesen a brlA kifejeződésének meg kell történnie, mielőtt az abaA kifejeződhetne, de a brlA következetes abaA-aktiválása megerősíti az utóbbi kifejeződését, és gyakorlatilag függetleníti az útvonal előrehaladását a külső eseményektől. Az abaA termék további szerkezeti géneket és a végső szabályozó gént, a wetA-t is aktiválja, amely a spóraspecifikus szerkezeti géneket aktiválja. Mivel a brlA és az abaA nem fejeződik ki a differenciálódó konídiumokban, a wetA valószínűleg részt vesz a spórákban (és talán a phialidiumban is; amint az aktuális spóratestmag eléri a wetA-szabályozott génekre igényt tartó érési stádiumot, a phialidiummagokat “vissza kell fordítani” a konídium-iniciációs állapotba a következő spóra kialakulásának megkezdéséhez). A wetA expressziója kezdetben a brlA és az abaA egymást követő hatására aktiválódik a phialidában, majd autoregulálódik (a wetA termék aktiválja a wetA transzkripciót). A wetA pozitív autoregulációja ezt követően fenntartja az expresszióját, miután a konídium (fizikailag és citológiailag) elvált a phialidtól.
Timberlake (1993) ezt a mechanizmust feedback fixációnak nevezte: a központi szabályozó szekvenciák kölcsönös aktiválása, visszacsatolt aktiválása és autoregulációja megerősíti az egész útvonal expresszióját, függetlenné téve azt a külső környezeti hatásoktól, amelyek elindították, és lehetővé téve a spóra további érését a phialidtól való elválás után is. A konídiumfórák fejlődése, mint sok más morfogenetikai folyamat, természetesen szekvenciális lépésekre oszlik. Ez a szabályozó hálózat megmutatja, hogy a transzlációs kiváltás hogyan kapcsolhat egy morfogenetikai útvonalat egyrészt a kompetencia kialakulásához, másrészt a környezeti jel(ek)re válaszul történő beinduláshoz. A beindulást követően a visszacsatolásos rögzítés a klasszikus embriológiai értelemben vett fejlődési determinációt eredményez, amely a morfogenezis folytatását eredményezi még akkor is, ha eltávolítjuk a beindító környezettől.
Ebben a részben szándékosan választottuk azt, hogy leírásunkat a mintegy 50 évvel ezelőtt végzett kutatásokra alapozzuk, amelyek nagyszámú, megváltozott konídiumfenotípussal rendelkező mutáció izolálásával kezdődtek, és a génszegregáció és a génkomplementáció “klasszikus” vizsgálataival folytatódtak (Martinelli & Clutterbuck, 1971). Amellett, hogy bemutatja, hogyan értettük meg a sporuláció megértését, azt is demonstrálja, hogy milyen értékkel bírnak ezek a “régimódi” technikák az ilyen jelenségek vizsgálatára.
Mindamellett nem hagyhatjuk figyelmen kívül azokat a kiterjedt kutatásokat, amelyek az Aspergillus növekedésének és fejlődésének hátterében álló molekuláris mechanizmusokkal kapcsolatban fejeződtek be. Ezek a vizsgálatok megerősítették, hogy a sporuláció kulcsfontosságú eseménye a brlA által kódolt cink-ujj transzkripciós faktor aktiválása, és hogy az abaA és wetA gének a konídiumképződés szükséges szabályozói. Az abaA által kódolt transzkripciós faktort a brlA aktiválja a metula differenciálódása után és a konídiumfejlődés középső szakaszában; awetA gén pedig, amelyet az abaA aktivál, a konídiumképződés késői szakaszában működik, irányítva a létfontosságú sejtfal-komponensek szintézisét és átalakítva az érő konídium anyagcseréjét. Az Aspergillus nidulansban ez a három gén alkotja a központi szabályozási útvonalat, amely más génekkel együtt szabályozza a konídium-specifikus génexpressziót és a fejlődési kompetencia megszerzésében, a konídiumfórás fejlődésben és a spóraérésben részt vevő génaktiváció sorrendjét (Lee és mtsai., 2016).
Az említett fejlődési útvonalak számos aspektusa konzerválódott más aspergillákban. Az Aspergillus nemzetség tagjai a leggyakrabban előforduló gombák közé tartoznak, és mind aszexuálisan, hosszú konídiumláncok kialakításával szaporodnak. Számos fajt, köztük az Aspergillus oryzae-t és az Aspergillus niger-t az iparban enzimtermelésre és élelmiszer-feldolgozásra használják; míg az Aspergillus flavus az aflatoxinok, a természetben előforduló leghatásosabb ismert rákkeltő anyagok előállításával felelős az élelmiszerromlásért. Egy másik aggodalomra okot adó faj az Aspergillus fumigatus opportunista humán patogén, amely elsődleges terjedési eszközként nagyszámú kis hidrofób konídiumot termel, és a fejlett országokban a levegőben terjedő gombák széles körben elterjedt kórokozójává vált. Immunhiányos betegekben az A. fumigatus invazív aspergillózist okoz, amely magas halálozási aránnyal jár. A BrlA-AbaA-WetA fejlődési jelátviteli útvonal konzerválódott ezen Aspergillus fajok konídiumképződésében (Yu, 2010; Tao & Yu, 2011; Krijgsheld és mtsai., 2013). Továbbá proteomikai, transzkriptomikai és metabolomikai vizsgálatok részletes képet adtak a sok ezer génben, transzkriptumban, enzimben és metabolikus reakcióban az Aspergillus konídiumok kialakulása, érése, nyugalmi állapota és csírázása során bekövetkező dinamikus változásokról (van Leeuwen et al., 2013; Novodvorska et al., 2016; Teertstra et al., 2017).
Frissítve: 2019. július