Az s- és p-blokk elemeinek ionizációs energiái
A periódusos rendszer harmadik sorában szereplő elemek ionizációs energiái ugyanazt a mintázatot mutatják, mint a \(Li\) és \(Be\) (\(\PageIndex{2}\) táblázat): Az egymást követő ionizációs energiák folyamatosan nőnek, ahogy az elektronokat eltávolítják a valenciapályákról (ebben az esetben 3s vagy 3p), majd az ionizációs energia különösen nagy mértékben növekszik, amikor az elektronokat eltávolítják a töltött magszintekről, amint azt az \(\(\PageIndex{2}\) táblázatban a vastagított átlós vonal jelzi. Így a periódusos rendszer harmadik sorában az ionizációs energia legnagyobb növekedése a negyedik elektron eltávolításának felel meg \(Al\), az ötödik elektron eltávolításának Si-ból, és így tovább – vagyis egy elektron eltávolításának egy olyan ionból, amely az előző nemesgáz valenciaelektron-konfigurációjával rendelkezik. Ez a minta megmagyarázza, hogy az elemek kémiája általában miért csak valenciaelektronokat tartalmaz. Túl sok energia szükséges a belső elektronok eltávolításához vagy megosztásához.
| Elem | \(I_1\) | \(I_2\) | \(I_3\) | \(I_3\) | \(I_4\) | \(I_5\) | \(I_6\) | \(I_7\) |
|---|---|---|---|---|---|---|---|---|
| *Inner-héjelektron | ||||||||
| Na | 495.8 | 4562.4* | – | – | – | – | – | – |
| Mg | 737.7 | 1450.7 | 7732.7 | – | – | – | – | – |
| Al | 577.4.4 | 1816.7 | 2744.8 | 11,577.4.4 | – | – | – | |
| Si | 786.5 | 1577.1 | 3231.6 | 4355.5 | 16,090.6 | – | – | |
| P | 1011.8 | 1907.4.4 | 2914.1 | 4963.6 | 6274.0 | 21,267.4.3 | – | |
| S | 999.6 | 2251.8 | 3357 | 4556.2 | 7004.3 | 8495.8 | 27,107.4.3 | |
| Cl | 1251.2 | 2297.7 | 3822 | 5158.6 | 6540 | 9362 | 11,018.2 | |
| Ar | 1520.6 | 2665.9 | 3931 | 5771 | 7238 | 8781.0 | 11,995.3 | |
Példa \(\PageIndex{1}\): Legmagasabb negyedik ionizációs energia
A periódusos rendszerben elfoglalt helyük alapján jósolja meg, hogy az alábbi elemek közül melyiknek van a legmagasabb negyedik ionizációs energiája: B, C vagy N.
Adott: három elem
Kérdés: a legnagyobb negyedik ionizációs energiával rendelkező elem
Stratégia:
- Listázza az egyes elemek elektronkonfigurációját.
- Meghatározza, hogy az elektronok egy kitöltött vagy egy részben kitöltött valenciahéjból kerülnek-e ki. Jósold meg, hogy melyik elemnek van a legmagasabb negyedik ionizációs energiája, felismerve, hogy a legmagasabb energia megfelel az elektronok eltávolításának a töltött elektronhéjból.
Megoldás:
A Ezek az elemek mind a periódusos rendszer második sorában helyezkednek el, és a következő elektronkonfigurációkkal rendelkeznek:
- B: 2s22p1
- C: 2s22p2
- N: 2s22p3
B Egy elem negyedik ionizációs energiáját (\(I_4\)) a negyedik elektron eltávolításához szükséges energiaként határozzuk meg:
\
Mivel a szénnek négy, illetve a nitrogénnek öt valenciaelektronja van, negyedik ionizációs energiájuk megfelel egy elektron eltávolításának egy részben betöltött valenciahéjból. A bór negyedik ionizációs energiája viszont egy elektron eltávolításának felel meg a kitöltött 1s2 alhéjból. Ehhez sokkal több energiára lenne szükség. A tényleges értékek a következők: B, 25 026 kJ/mol; C, 6223 kJ/mol; és N, 7475 kJ/mol.
GYakorlat \(\PageIndex{1}\):
A periódusos rendszerben elfoglalt helyük alapján jósolja meg, hogy az alábbi elemek közül melyiknek van a legalacsonyabb második ionizációs energiája: Sr, Rb vagy Ar.
Válasz
\(\ce{Sr}\)
Az \(\PageIndex{2}\) táblázat első adatoszlopa azt mutatja, hogy az első ionizációs energiák a periódusos rendszer harmadik sorában növekvő tendenciát mutatnak. Ennek az az oka, hogy a valenciaelektronok nem árnyékolják egymást túl jól, így az effektív magtöltés folyamatosan növekszik a sorban. A valenciaelektronok ezért erősebben vonzódnak az atommaghoz, így az atomméret csökken, az ionizációs energiák pedig nőnek. Ezek a hatások ugyanannak az éremnek a két oldalát képviselik: az elektronok és az atommag közötti erősebb elektrosztatikus kölcsönhatások tovább növelik az elektronok eltávolításához szükséges energiát.
Az első ionizációs energia azonban csökken az Al-nál (3s23p1) és az S-nél (3s23p4). Ezeknek a “kivételeknek” az elektronkonfigurációi adják meg a választ arra, hogy miért. Az alumínium töltött 3s2 alhéjban lévő elektronok jobban árnyékolják a 3p1 elektront, mint egymást a magtöltéstől, így az s elektronok közelebb hatolnak az atommaghoz, mint a p elektron, és a p elektron könnyebben eltávolítható. Az S-nél a csökkenés azért következik be, mert az azonos p-orbitálisban lévő két elektron taszítja egymást. Ez az S atomot kissé kevésbé stabillá teszi, mint amire egyébként számítani lehetne, ahogy ez a 16. csoport összes elemére igaz.
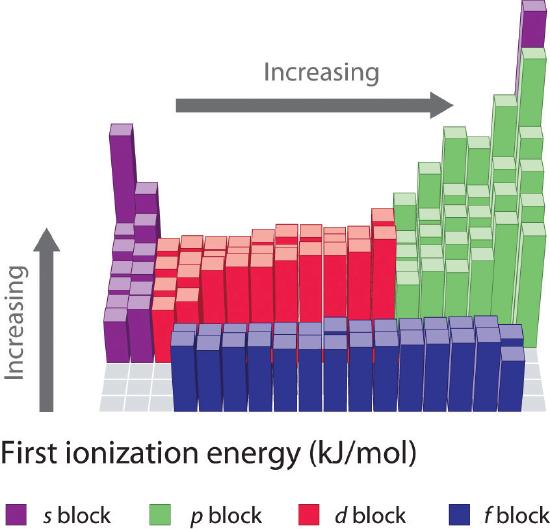
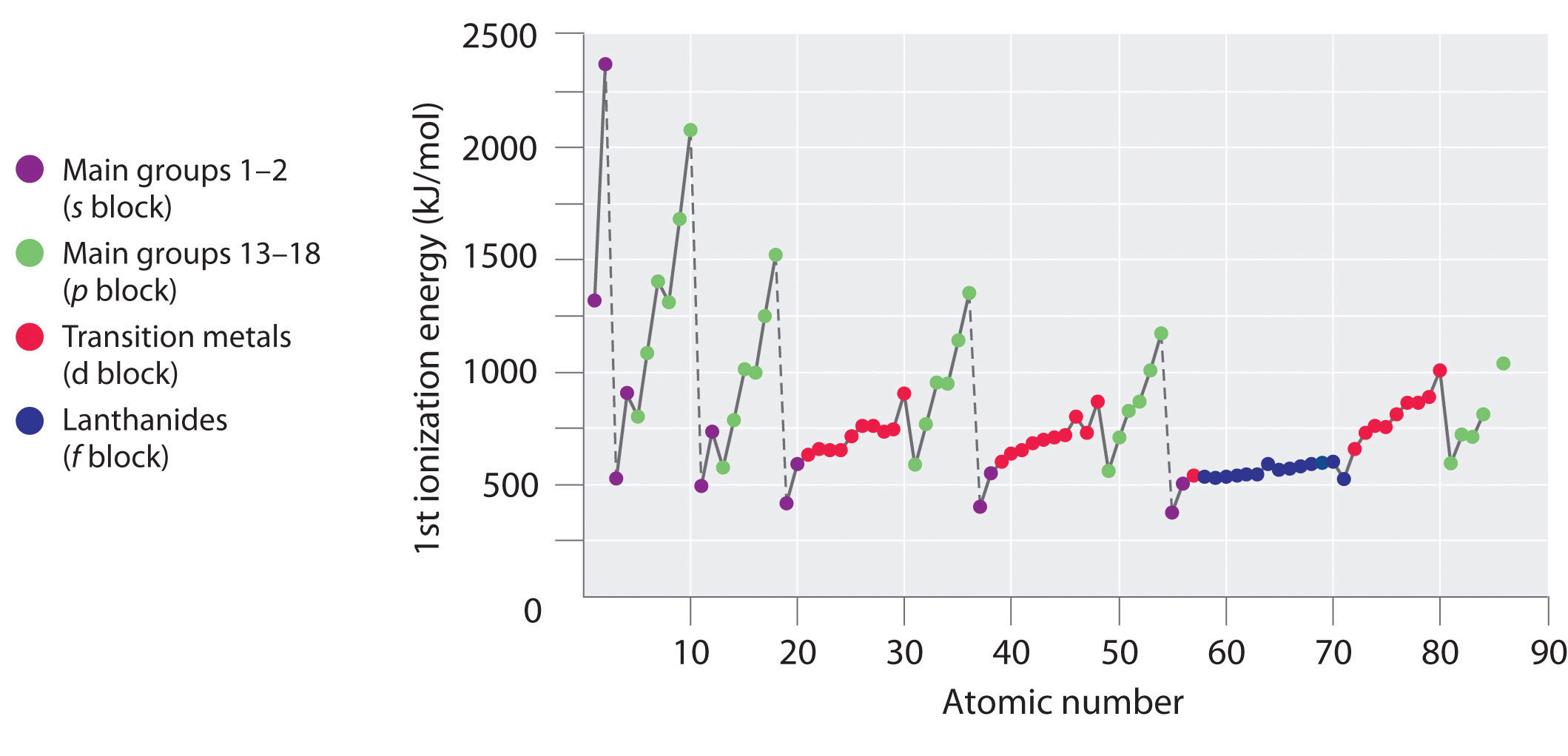
A periódusos rendszer első hat sorában lévő elemek első ionizációs energiáit a \(\PageIndex{1}\) ábra ábrázolja, és a \(\PageIndex{2}\) ábra numerikusan és grafikusan mutatja be. Ezek az ábrák három fontos tendenciát szemléltetnek:
- Az s és p blokk második (Li-ről Ne-re), negyedik (K-ról Kr-re), ötödik (Rb-ről Xe-re) és hatodik (Cs-ről Rn-re) sorában megfigyelhető változások a periódusos rendszer harmadik sorára leírtakhoz hasonló mintázatot követnek. Az átmeneti fémek azonban a negyedik, ötödik és hatodik sorban szerepelnek, a lantanidák pedig a hatodik sorban. Az átmeneti fémek első ionizációs energiái némileg hasonlóak egymáshoz, akárcsak a lantanidáké. Az ionizációs energiák balról jobbra haladva minden sorban nőnek, eltérések az ns2np1 (13. csoport), ns2np4 (16. csoport) és ns2(n – 1)d10 (12. csoport) esetén fordulnak elő.
- Az első ionizációs energiák általában egy oszlopban lefelé csökkennek. Bár az n fő kvantumszám oszloponként lefelé növekszik, a kitöltött belső héjak hatékonyan árnyékolják a valenciaelektronokat, így az effektív magtöltés viszonylag kis mértékben növekszik. Következésképpen az atomok az elektronok felvételével nagyobbak lesznek. Az atommagtól távolabb lévő valenciaelektronok kevésbé szorosan kötődnek, így könnyebben eltávolíthatók, ami az ionizációs energiák csökkenését okozza. A nagyobb sugár jellemzően alacsonyabb ionizációs energiának felel meg.
- Az első két tendencia miatt a periódusos rendszer bal alsó sarkában helyezkednek el azok az elemek, amelyek a legkönnyebben képeznek pozitív ionokat (a legkisebb ionizációs energiával rendelkeznek), míg a legnehezebben ionizálható elemek a periódusos rendszer jobb felső sarkában találhatók. Következésképpen az ionizációs energiák általában átlósan nőnek a bal alsó (Cs) és a jobb felső (He) között.

A periódusos rendszerben általában az \(I_1\) átlósan nő a periódusos rendszer bal alsó sarkától a jobb felső sarkáig.
A gallium (Ga), amely az első elem az átmeneti fémek első sora után, a következő elektronkonfigurációval rendelkezik: 4s23d104p1. Első ionizációs energiája lényegesen alacsonyabb, mint a közvetlenül megelőző elemé, a cinké, mivel a gallium kitöltött 3d10 alhéja a 4p alhéjon belül helyezkedik el, árnyékolva az egyetlen 4p elektront az atommagtól. A kísérletek még ennél is érdekesebb dolgot tártak fel: a gallium ionizációjakor eltávolított második és harmadik elektron a 4s2 orbitálisból származik, nem pedig a 3d10 alhéjból. A gallium kémiáját a keletkező Ga3+ ion uralja, amelynek 3d10 elektronkonfigurációja van. Ez és a hasonló elektronkonfigurációk különösen stabilak, és gyakran előfordulnak a nehezebb p-blokk elemeiben. Néha pszeudo-nemesgáz-konfigurációknak is nevezik őket. Valójában az ilyen konfigurációkat mutató elemek esetében nem ismertek olyan kémiai vegyületek, amelyekben az elektronokat eltávolították volna az (n – 1)d10 töltésű alhéjból.