1. ábra. Toll-szerű receptor jelátviteli útvonal
Mi a Toll-szerű receptor?
A Toll-szerű receptorok (TLR-ek) a fehérjék egy olyan osztálya, amely kulcsszerepet játszik a veleszületett immunitásban. Ezek egydoménes transzmembrán receptorok, amelyek a mintafelismerő receptorok (PRR) közé tartoznak, és általában az őrszemsejtekben, például a makrofágokban, a dendritikus sejtekben és sok más, nem immunsejtben, például a fibroblasztokban és a hámsejtekben fejeződnek ki. Felismerik a mikrobáktól származó, szerkezetileg konzervált molekulákat, amelyeket patogén-asszociált molekuláris mintáknak (PAMP) vagy a károsodott sejtekből származó, saját maguk által létrehozott molekulákat, amelyeket károsodással kapcsolatos molekuláris mintáknak (DAMP) neveznek. A PAMP-ok közé tartoznak a különböző bakteriális sejtfalkomponensek, mint a lipopoliszacharid (LPS), a peptidoglikán (PGN) és a lipopeptidek, valamint a flagellin, a bakteriális DNS és a vírusos kettős szálú RNS. A DAMP-ok közé tartoznak az intracelluláris fehérjék, például a hősokkfehérjék, valamint az extracelluláris mátrixból származó fehérjefragmentumok. A PRR-ek olyan downstream jelátviteli utakat aktiválnak, amelyek gyulladásos citokinek, I. típusú interferon (IFN) és más mediátorok termelésével veleszületett immunválaszok indukciójához vezetnek. Ezek a folyamatok nemcsak azonnali gazdaszervezeti védekező válaszokat, például gyulladást váltanak ki, hanem az antigénspecifikus adaptív immunválaszokat is előkészítik és irányítják. Ezek a válaszok nélkülözhetetlenek a fertőző mikrobák kiürítéséhez, valamint döntő fontosságúak az antigénspecifikus adaptív immunválaszok következetes utasításához.
2. ábra. A TLR-ek molekuláris szerkezetének sematikus ábrája.
Toll-like receptor család
A TLR család 10 tagból (TLR1-TLR10) áll az emberben és 12-ből (TLR1-TLR9, TLR11-TLR13) az egérben. A TLR-ek a sejtfelszínen vagy intracelluláris kompartmentekben, például az ER-ben, az endoszómában és a lizoszómában lokalizálódnak. A sejtfelszíni TLR-ek közé tartoznak a TLR1, TLR2, TLR4, TLR5, TLR6 és TLR10, míg az intracelluláris TLR-ek az endoszómában lokalizálódnak és a TLR3, TLR7, TLR8, TLR9, TLR11, TLR12 és TLR13 (1. ábra). A sejtfelszíni TLR-ek elsősorban a mikrobiális membránkomponenseket, például a lipideket, lipoproteineket és fehérjéket ismerik fel. Az intracelluláris TLR-ek felismerik a baktériumokból és vírusokból származó nukleinsavakat, valamint felismerik a saját nukleinsavakat olyan betegségekben, mint az autoimmunitás.
A Toll-like receptor működése általában két TLR molekula dimerizációs folyamatán alapul, de nem mindig. Például a TLR-1 és a TLR-2 egymáshoz kötődve egy dimert alkot, amikor felismeri a PAMPs molekulákat, beleértve főként a lipoproteineket, peptidoglikánokat, lipotejsavakat (LTA, Gram-), zimozánt, mannánt és tGPI-mucint. A TLR-2 a TLR-6-tal is képezhet dimmert, amikor ugyanazokat a fent felsorolt PAMP-okat ismerik fel. A TLR-4 képes felismerni a lipopoliszacharidot (LPS, Gram+) és homodimert alkotni egy másik TLR-4 molekulával. A TLR-5 felismerheti a bakteriális flagellint, de nem alkotnak dimmert. A TLR-11 egerekben funkcionális, és elsősorban uropatogén baktériumokat ismer fel. A TLR-3, 7, 8, 9, 13 az endoszóma felszínén, a citoplazmában fejeződik ki. A TLR3 felismeri a vírusos kettősszálú RNS-t (dsRNS), a kis interferáló RNS-t és a sérült sejtekből származó ön-RNS-t. A TLR-7 túlnyomórészt a plazmacitoid DC-kben (pDC-k) expresszálódik, és felismeri a vírusokból származó egyszálú (ss) RNS-t. A hagyományos DC-kben (cDC-k) a Streptococcus B baktériumokból származó RNS-t is felismeri. A TLR8 vírusos és bakteriális RNS-re reagál. A TLR-9 felismeri a nem metilezett CpG-DNS-motívumokban gazdag bakteriális és vírus-DNS-t. A TLR13 felismeri a bakteriális 23S rRNS-t és a vesicularis stomatitis vírus ismeretlen komponenseit.
Noha nagyon sokféle TLR molekula létezik, amelyek a ligandok széles skáláját ismerik fel, mindezek a TLR-ek közös szerkezeti vázzal rendelkeznek az extracelluláris, ligandkötő doménekben. Ezek a domének mind patkó alakú szerkezetet vesznek fel, amely leucinban gazdag ismétlődő motívumokból épül fel. Jellemzően a ligandumkötéskor a két extracelluláris domén egy ”m”-alakú dimert alkot, amely szendvicsbe zárja a ligandummolekulát, így a transzmembrán és citoplazmatikus domének közel kerülnek egymáshoz, és elindítják a downstream jelátviteli kaszkádot (2. ábra).
Toll-like receptor jelátviteli útvonal
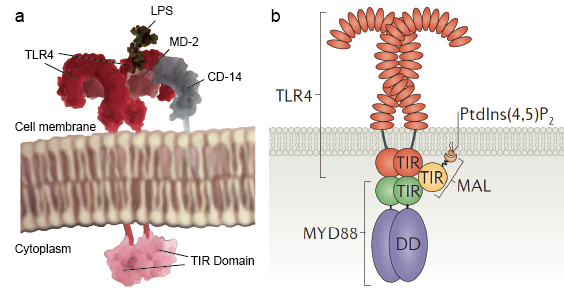
1. Toll-szerű receptor jelátviteli kaszkád
A Toll-szerű receptorok lehetővé teszik az őrszemsejtek, például a makrofágok számára, hogy a mikrobákat PAMP-okon, például az LPS-en keresztül észleljék. Az LPS a bakteriális sejtfal egyik összetevője. A lipopoliszacharid Toll-szerű receptorok általi felismerésének mechanizmusa összetett, és több járulékos fehérjét igényel. Egy szérumfehérje, az LPS-kötő fehérje megköti az LPS-monomereket, és átadja azt a CD14 nevű fehérjének. A CD14 lehet oldható, vagy egy glikozil-foszfatidil-inozitol horgonyon keresztül kötődhet a sejtfelszínhez. A CD 14 szállítja és terheli az LPS-t a Toll-szerű receptorok extracelluláris doménjéhez. A TLR-ek az LPS-t egy MD-2 nevű kiegészítő fehérje segítségével képesek felismerni. Ezután a TLR-ek homodimerizációja indukálódik, amikor az LPS a TLR-CD14-MD2 komplexhez kötődik. Az extracelluláris domének konformációs változása elindítja a citoplazmatikus Toll IL-1 receptor (TIR) domén dimerizációját. A TIR konformációs változás egy új állványzatot biztosít, amely lehetővé teszi az adaptor fehérjék toborzását a receptor utáni jelátviteli komplex kialakításához. A TIR tartalmaz egy adaptorfehérjét, a myeloid differenciálódás elsődleges válaszfehérjét 88 (MyD88).
A MyD88 adaptorként működik, amely összekapcsolja a TLR-eket/IL-1R-eket a DD-vel rendelkező downstream szignálmolekulákkal. Felismeri a TLR-ek TIR-doménjének konformációs változását, kötődik az új receptorkomplexhez, és a jelátvitelt az IL-1R-hez kapcsolódó kinázokkal (IRAK-ok) való amino (N)-terminális haláldomén (DD) kölcsönhatás révén továbbítja. Ezek eredményeként egy komplex jelátviteli kaszkád jön létre, amely figyelmezteti a sejtet a kórokozó inváziójára. Négy IRAK létezik (IRAK 1, 2, 4, M). Ezek egy N-terminális DD-t és egy központi szerin/treonin-kináz domént tartalmaznak. Az IRAK1 és IRAK4 saját kinázaktivitással rendelkezik, míg az IRAK2 és IRAK-M nem rendelkezik kimutatható kinázaktivitással. Az IRAK4-et a MyD88 aktiválja, és ez tovább aktiválja az IRAK1-et. Az IRAK1 ezután aktiválja a downstream TRAF6-ot. A TRAF6 a tumor nekrózis faktor receptor (TNFR) asszociált faktor (TRAF) család tagja, amely citokin jelátviteli útvonalakat közvetít. Stimuláció hatására a TRAF6 a receptorkomplexhez rekrutálódik, és a TRAF6 TRAF-doménjéhez kötődő IRAK-1 aktiválja. Ezután az IRAK-1/TRAF6 komplex disszociál a receptorról, és társul a TGF-béta-aktivált kináz 1 (TAK1) és a TAK1-kötő fehérjékkel, a TAB1 és TAB2-vel. A TRAF6, TAK1, TAB1 és TAB2 komplex a citoplazmába kerül, ahol más fehérjékkel, például az Ubc13 és az Uev1A E2 ligázokkal nagy komplexet alkot. Kimutatták, hogy az Ubc13 és az Uev1A komplex katalizálja a TRAF6 Lys 63-hoz kötött poliubikvitin láncának szintézisét, és ezáltal a TRAF6 által közvetített TAK1 és végül az NF-kB aktiválását indukálja. Ezeket a fent leírt jelútvonalakat MyD88-függő útvonalnak nevezzük, mivel a jel a MyD88 molekulából indul ki. Létezik egy másik, MyD88-független útvonal is, amely jelátvitel nem a MyD88-ból indul ki. Ehelyett a jel a TRIF fehérjéből indul. A TRIF kölcsönhatásba lép a TRAF6-tal és a TRAF3-mal. A TRAF6 rekrutálja a RIP-1 kinázt, amely viszont kölcsönhatásba lép a TAK1 komplexszel és aktiválja azt, ami az NF-kB és a MAPK-k aktiválásához és a gyulladásos citokinek indukciójához vezet. Ezzel szemben a TRAF3 az IRF3 foszforilációjához és aktiválásához a NEMO-val együtt az IKK-val kapcsolatos TBK1 és IKKi kinázokat toborozza. Az IRF3 dimert képez és a citoplazmából a sejtmagba transzlokálódik, az I-es típusú IFN expresszióját indukálja.
2. Downstream jelátvitel
A TLR-ek valójában elsősorban specifikus adaptor molekulák toborzásán keresztül jeleznek, ami az NF-kB és az IRFs transzkripciós faktorok aktiválásához vezet, amelyek a veleszületett immunválaszok kimenetelét diktálják. Tehát ez az útvonal downstream jelátvitel az IRFs transzkripciós faktor, az NF-kB jelátviteli útvonal és a MAKP útvonal aktiválása. Az NF-kB és a MAKP jelátviteli útvonalról részletesebb információt találhat a:
NF-kB jelátviteli útvonal, P38 jelátviteli útvonal és MAKP jelátviteli útvonal.
3. Az útvonal szabályozása
Azért van bizonyos negatív szabályozás számos molekula által különböző mechanizmusokon keresztül, hogy megakadályozza vagy megszüntesse a túlzott immunválaszokat, amelyek az autoimmunitással és gyulladásos betegségekkel kapcsolatos káros következményekhez vezetnek. A MyD88-függő útvonal aktiválódását az ST2825, a SOCS1 és a Cbl-b, a TRIF-függő útvonal aktiválódását pedig a SARM és a TAG gátolja. Ezek a molekulák társulnak a MyD88-hoz vagy a TRIF-hez, hogy megakadályozzák a TLR-ekhez vagy a downstream molekulákhoz való kötődésüket. A TRAF3 aktiválódását a SOCS3 és a DUBA negatívan szabályozza. A TRAF6-ot számos gátló molekula, például az A20, USP4, CYLD, TANK, TRIM38 és SHP célozza. A TAK1 aktiválódását a TRIM30a és az A20 gátolja.
4. Kapcsolat a betegségekkel
Mivel a TLR részt vesz az LPS érzékelésében, és szerepe lehet a szepszisben, a TLR-ek célzott kezelése számos betegség kezelésében fontos. A TLR-válaszok beavatkozása mellett a kórokozó fertőzések kezelésére a TLR-vizsgálatokból nyert ismeretek kézenfekvő klinikai alkalmazása a TLR-ligandumok vakcina-adjuvánsként való alkalmazása. Sőt, a klinikumban TLR-gátlással is próbálkoztak, amelynek célja a túlzott gyulladás korlátozása, amelyet feltehetően egy adott TLR túlzott aktivációja okoz.
| Takeda, Kiyoshi és Shizuo Akira. “TLR jelátviteli útvonalak”. Seminars in immunology. Vol. 16. No. 1. Academic Press, 2004. | |
| Akira, Shizuo, and Kiyoshi Takeda. “Toll-szerű receptorok jelátvitel”. Nature reviews immunology 4.7 (2004): 499-511. | |
| Lim, Kian-Huat és Louis M. Staudt. “Toll-szerű receptorok jelátvitele”. Cold Spring Harbor perspectives in biology 5.1 (2013): a011247. | |
| ésTaro Kawai, Takumi Kawasaki. “Toll-like receptor jelátviteli útvonalak”. Pattern Recognition Receptors and Cancer 8916 (2015): 7. | |
| Gay, Nicholas J., et al. “Assembly and localization of Toll-like receptor signalling complexes”. Nature reviews Immunology 14.8 (2014): 546-558. | |
| O’Neill, Luke AJ, Douglas Golenbock és Andrew G. Bowie. “A Toll-szerű receptorok története a veleszületett immunitás újradefiniálása”. Nature Reviews Immunology 13.6 (2013): 453-460. | |
| Botos, Istvan, David M. Segal és David R. Davies. “A Toll-szerű receptorok szerkezeti biológiája”. Structure 19.4 (2011): 447-459. |