Bevezetés
A metán (CH4) az egyik legfontosabb üvegházhatású gáz. A természetes környezetekből, például a vizes élőhelyekről, óceánokból és üledékekből származó kibocsátása a légköri metán több mint 70%-át teszi ki globálisan (IPCC, 2007). A közzétett adatok értékelése a vizes élőhelyek, tavak, folyók, torkolatok és óceánok metánkibocsátásának különböző arányait mutatta ki (csökkenő sorrendben, S1. kiegészítő ábra). A természetes vizes élőhelyek önmagukban a biogén CH4-termelés 62%-át adják (Kirschke et al., 2013; Nazaries et al., 2013), és a vizes élőhelyek kibocsátása dominál a metánforrások évközi változékonyságában (Bousquet et al., 2006). Ezzel szemben a tengeri ökoszisztémák hatalmas területe csak mintegy 8%-kal járul hozzá a CH4 természetes forrásaihoz (Nazaries et al., 2013). A globális óceáni metánkibocsátáson belül a torkolatok kevesebb mint 10%-kal járulnak hozzá (Bange et al., 1994).
A metanogenezist, a metán biológiai képződését metanogén archaea végzi, amelyek anoxikus körülmények között elsősorban H2/CO2-ból, metilcsoportokból vagy acetátból állítanak elő metánt (Thauer et al., 2008). Ezt a reakciót a metil-koenzim M reduktáz (MCR) katalizálja. Az ezen enzim egyik alegységét kódoló mcrA gén a molekuláris vizsgálatokban gyakran használt génmarker (Conrad, 2007; Bridgham et al., 2013). Az mcrA génmarker előnye, hogy a metanogének filogenetikai és funkcionális szignatúráját egyaránt megragadja, és nagy szekvenálási mélységet kínál e különleges funkcióhoz (Luton et al., 2002; Borrel et al., 2013; Yang et al., 2014). Nagyszámú mcrA szekvenciát szereztünk be különböző természetes környezetekből. A nyilvános mcrA adathalmaz lehetővé teszi az általános ökológiai minták kinyerését és a formáló környezeti gradiensek vizsgálatát globális és regionális léptékben. Emellett 152 metanogén izolátum fiziológiai tulajdonságait összefoglaló adatbázis is rendelkezésre áll1 (Jabłoński et al., 2015). A közelmúltban a genombontás szokatlan mcrA szekvenciákat tárt fel az új Methanofastidiosa osztályban (Nobu et al., 2016) és az új Bathyarchaeota (Evans et al., 2015) és Verstraetearchaeota (Vanwonterghem et al., 2016) filákban. Ezek az új eredmények bővítették a potenciális metanogének diverzitásával kapcsolatos ismereteinket, de nem homályosították el az mcrA gén molekuláris markerként való alkalmazhatóságát a metanogén közösségek nagy többségére.
Mostanáig metanogén közösségeket észleltek vizes élőhelyeken, üledékekben, permafroszt területeken, rizsföldeken, emésztőgödrökben, geotermikus forrásokban és hidrotermális nyílásokban (Conrad, 2007; Thauer et al., 2008; Wagner és Liebner, 2009). A metanogén közösség szerkezete különböző térbeli és időbeli skálákon összefüggést mutatott a környezeti pH-val, hőmérséklettel, sótartalommal, talajvízszinttel és a növényzet dinamikájával (Megonigal et al., 2005; Milferstedt et al., 2010; Frank-Fahle et al., 2014; McCalley et al., 2014; Cui et al., 2015; Liebner et al., 2015). Az acetoklasztikus metanogenezist például általában akadályozza az alacsony pH, mivel csökkenti az acetát disszociációt (Megonigal et al., 2005; Kotsyurbenko et al., 2007). A növényzet labilis, jó minőségű szerves szénnel képes ellátni a metanogéneket gyökér exudátum vagy detritusz formájában, így a növényi exudátumok általában az acetoklasztikus metanogéneknek kedveznek elsősorban a lápokban (Bridgham et al., 2013). A tengervízből származó szulfát gátolja a metántermelést a dagályos vizes élőhelyeken, ezért a sótartalmat a metánkibocsátás általános előrejelzőjeként használták (Holm et al., 2016). Egy tibeti tóüledékeken végzett vizsgálat kimutatta, hogy a növekvő sótartalom gátolja a hidrogénotróf metanogéneket, de fokozza az acetoklasztikus metanogenezist (Liu et al., 2016). Ezek a tanulmányok jelezték a metanogén közösségek környezeti mozgatórugóit, de egyetlen élőhelyre vagy korlátozott területi léptékre összpontosítottak.
A metanogének különböző környezeti változásokhoz való alkalmazkodásának megértéséhez azonban a mikrobiális közösségek összetétele és a környezeti feltételek közötti összefüggések szisztematikus és globális feltárására van szükség (Lozupone és Knight, 2007). Jelenleg csak néhány tanulmány foglalkozik a metanogén közösségek diszperziójával és élőhelyszűrésével (Auguet et al., 2010; Barreto et al., 2014). Feltételezésünk szerint a metanogén együtteseket elsősorban az élőhelyszűrés befolyásolja, és ezt globális környezeti kontrollok irányítják. Tekintettel arra, hogy a természetes ökoszisztémák között a metánkibocsátás mértéke nagymértékben eltér, a metanogén együttesek összetételének, diverzitásának és biogeográfiájának explicit integrálása ezekben az ökoszisztémákban alapvető fontosságú lehet a metántermelés jelenlegi és jövőbeli éghajlatváltozásra adott válaszának meghatározásához. Ezt a meta-tanulmányt a metanogén biogeográfiával, diverzitással és annak környezeti kontrolljával kapcsolatos hiányosságok pótlására végezzük a nyilvánosan elérhető mcrA szekvenciaadatok és az irodalom felhasználásával, kiegészítve a metanogén izolátumok fiziológiai adataival.
Anyagok és módszerek
Adatgyűjtés
A GenBankban elérhető mcrA szekvenciákat kerestünk (2016 január)2. Minden találat esetében ellenőriztük az eredeti cikket, és a megfelelő mcrA szekvenciákat egy egyedi Perl szkript segítségével elemeztük. Mivel természetes környezetekre összpontosítottunk, a metanogén mcrA-szekvenciákat természetes élőhelyekről szereztük be, és a talaj, tó-, torkolat-, tengeri és hidrotermális üledékek, valamint iszapvulkánok közé soroltuk. A klónkönyvtárak szekvenciái mellett öt újgenerációs szekvenálásból (NGS) származó könyvtárat is bevontunk. A szekvenciákat az eredeti adathalmazban szereplő relatív gyakoriság figyelembevétele nélkül töltöttük le. Mivel a klónkönyvtárak szekvenciái elsősorban a bőséges filotípusokat fedik le, míg az NGS sokkal mélyebb diverzitást képes megragadni, kompromisszumot kötöttünk az NGS-adatok felhasználása érdekében, de mérsékeltük a szekvenálási módszerek eltérő felbontásából adódó lehetséges hibát. Ezért csak a bőséges, 1%-nál nagyobb relatív gyakoriságú OTU-k reprezentatív szekvenciáit választottuk ki. Elvetettük továbbá azokat az NGS-szekvenciákat, amelyek elbuktak a nukleotidból fehérjeszekvenciává történő fordítás ellenőrzésén, vagy alacsony minőségűek voltak (szekvenciák < 250 bps). Végül egy olyan adathalmazt állítottunk össze, amely 4466 egyedi mcrA szekvenciát tartalmazott 94 globálisan elterjedt helyről (1. ábra és kiegészítő táblázatok: S1, S2). Emellett nem vontuk ki az adathalmazból a potenciális archeális metanotrófok mcrA-szekvenciáit, amelyeket a genomikai felmérés során elkerülhetetlenül észleltünk (Conrad, 2007). Ez a rész meghaladja a jelen tanulmány fókuszát.
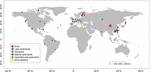
1. ÁBRA. A tanulmányhoz felhasznált helyszínek elhelyezkedése. A helyszíneket élőhelyeik szerint hat különböző kategóriába soroltuk és különböző színekkel jelöltük. A hat élőhely összefoglalóját az S1. és S2. kiegészítő táblázatok tartalmazzák.
A földrajzi koordinátákat és a környezeti beállításokat, beleértve a pH-t, a sótartalmat, a tengerszint feletti magasságot, az átlagos éves léghőmérsékletet (MAAT) és az átlagos éves csapadékmennyiséget (MAP) az e tanulmányban figyelembe vett minden egyes kutatási helyszínre vonatkozóan a megfelelő publikációkból nyertük ki, feltéve, hogy az adatok rendelkezésre állnak (lásd az S1. kiegészítő táblázatot). A több tanulmányban hiányzó környezeti paraméterek figyelembevétele érdekében néhány környezeti változót kvalitatív módon definiáltunk a vonatkozó szakirodalomban szereplő helyszínleírások alapján, majd ezeket a kategóriaadatokat félmetrikus numerikus értékekké alakítottuk át, például a tengeri üledékeket, hidrotermális üledékeket, vulkáni iszapot és szóda-tó üledékmintákat “sósnak”, a talaj- és édesvízi tó üledékmintákat “nem sósnak”, a mangrove- és torkolatmintákat pedig “vegyes” mintáknak tekintettük.
Raw Sequence Processing
A szekvenciafeldolgozást a Mothur szoftverplatformmal (Schloss et al., 2009). A különböző könyvtárakból származó szekvenciákat a feldolgozás előtt összevontuk. A 350 bp-nál rövidebb vagy 8-nál több kétértelmű bázist tartalmazó szekvenciákat elvetettük. Ezt követően ezeket a szekvenciákat összehangoltuk az mcrA szekvenciák egy előre összehangolt részhalmazával, amelyet a FunGene adatbázisból http://fungene.cme.msu.edu/ (Fish et al., 2013) szereztünk be. A kiméra szekvenciákat a Mothur szoftverrel azonosítottuk az uchime módszerrel (Edgar et al., 2011), magát az adathalmazt referenciaként használva. Ezután az érvényes mcrA gén nukleotidszekvenciákat az összehangolt DNS-szekvenciák közötti korrigálatlan páros távolságok kiszámításához használtuk, majd 84%-os határértékkel, amely megfelel a 16S rRNS gén 97%-ának (Yang et al., 2014), operatív rendszertani egységekbe (OTU) soroltuk. Az egyes mcrA OTU-k gyakoriságát csak jelenlétként vagy hiányként vettük figyelembe. Az OTU-k taxonómiai osztályozásának pontosságát a nukleotid- és aminosav-szekvenciák figyelembevételével növeltük. DNS-szinten a taxonómiai azonosságot a Mothur platform rendelte hozzá egy referencia adatbázis alapján (Yang et al., 2014). Fehérjeszinten az összehangolt fehérjeszekvenciákból ARB-ben fát építettünk, majd a taxonómiai hozzárendelést a megfelelő adatbázis alapján végeztük. Ha egy OTU hozzárendelése ellentmondásos volt, kézzel blastoltuk mind a nukleotid-, mind a fehérjeszekvenciát az NCBI-ban, és a végső rendszertani azonosságot a lekérdezési lefedettség (>95%), az azonosság (>84%) és az e-érték (<1E-5) figyelembevételével határoztuk meg. A fehérjeszekvenciák esetében a nemzetségszintű határérték a 83,5%-os küszöbértékre vonatkozott (Hunger et al., 2011).
Ökológiai és statisztikai elemzés
A statisztikai elemzést különböző R csomagokkal végeztük. A főkoordináta-analízis (PCoA) ordinációkat a vegan csomag v2.2.0 (Oksanen et al., 2015) segítségével konstruált Jaccard-távolságmátrixok alapján hoztuk létre. Permutációs MANOVA-t (többváltozós varianciaanalízis) végeztünk a Jaccard-mátrix variációjának forrásának értékelésére (McArdle és Anderson, 2001) a vegánban 104 permutációval. A Jaccard-távolsági mértékek a fajok jelenlétén/hiányán alapulnak, ami alkalmasabb a mi adatállományunkhoz, mivel a legtöbb tanulmány csak a reprezentatív szekvenciákat adta meg, míg a gyakoriságra vonatkozó információk hiányoznak. A taxonómiai előfordulási gyakoriságokat az élőhelyek között a ggplot2 csomag (v1.0.0) (Wickham, 2009) segítségével buborékdiagramokon keresztül szemléltettük. A nem sós talaj és a tavi üledék közösségek hierarchikus klaszterezési elemzését a “hclust” R függvénnyel végeztük (R Core Team, 2014). A kapott közösségi klasztereket az eredeti minták pH- és hőmérsékleti rendszere szerint írtuk le, mivel a PCoA segítségével előzetesen azonosítottuk, hogy a pH és a hőmérséklet mindkét paraméter befolyásolja a metanogén közösségek összetételét a nem sós talajokban és a tóüledékekben. Az egyes metanogén vonalak társulását az egyes klaszterekhez korreláción alapuló indikátorfaj-elemzéssel határoztuk meg (Dufrene és Legendre, 1997). Az indikátorfajokat itt úgy határozzuk meg, mint amelyek egy adott élőhelytípusban bőségesen előfordulnak (specificitás) és túlnyomórészt ebben az élőhelytípusban fordulnak elő (fidelitás). Ebben a tanulmányban az indikátor taxonokat – az indikátorfajok fogalmához hasonlóan – a nem sós talajok és a tavi üledékek esetében az R-csomag labdsv (Roberts, 2016) által kiválasztott indikátorérték (IndVal-érték) szerint választottuk ki, ha a megadott iterációk során megfigyelt magas indikátorérték elérésének valószínűsége kisebb, mint 0,05. Az indikátort taxonokat az R-csomag (Roberts, 2016) akkor választotta ki, ha a megadott iterációk során a megfigyelthez hasonlóan magas indikátorértéket kapunk. A Chao2-indexeket minden egyes mintára a vegan csomag segítségével számoltuk ki. Az élőhelyek közötti Chao2-indexek Wilcoxon rangsorösszeg-tesztjét a “wilcox.test” (R Core Team, 2014) R-funkcióval végeztük el. Az élőhelyszűrés metanogén archaea izolátumokra gyakorolt hatásának megszilárdítása érdekében a leírt metanogén kultúrák fiziológiai és biokémiai jellemzőit a3 ‘Methanogenic archaea database’ (Jabłoński et al., 2015) adatbázisból hívtuk le. Közülük az optimális NaCl-szükségletre vonatkozó információval rendelkező izolátumokat kiszűrtük, kategorizáltuk és ábrázoltuk az izolációs forrásuk szerint.
Az elterjedési korlátozás metanogén közösségi szerkezetre gyakorolt hatásának vizsgálatához lineáris regressziós elemzést végeztünk a földrajzi távolságmátrix és a közösségi Jaccard-távolságmátrix alapján az ‘lm’ R függvény segítségével (R Core Team, 2014). Mantel- és részleges Mantel-teszteket végeztünk a diszperziós limitáció hatásának értékelésére a két mátrix alapján, ismét az R-ben található vegan csomag segítségével (Oksanen et al., 2015). Továbbá többváltozós térbeli elemzést (spatial PCA) alkalmaztunk 16 európai talaj- és tóüledékmintára a Moran I index alapján a metanogének térbeli szerkezetének feltárására az R ade4 csomag “multispati” függvényével (Dray és Dufour, 2007). Ezenkívül a Jaccard-távolság mátrixon alapuló Ward-féle minimális variancia klaszterezést is végrehajtottuk ezen a 16 mintán az R “hclust” (R Core Team, 2014) függvény segítségével, majd a klaszterezés eredményeit tovább vetítettük egy földrajzi térképre. Az európai shapefile az állami szintű térképezéshez elérhető a GSHHG adatbázisban (v2.3.6)4. A térképet a QGIS v2.18.25 segítségével generáltuk.
Eredmények
Biogeography of Methanogenic Archaea in Natural Environments
A mcrA génszekvenciákat 94 globálisan elterjedt természetes környezetből szereztük be. E 94 helyszín elhelyezkedését és ökoszisztémájának típusát az 1. ábra mutatja be. A metanogén vonalak előfordulási (jelenlét/hiány) gyakoriságát az ökoszisztéma típusa szerint összevontuk és a 2. ábrán szemléltetjük. Röviden: a talajokban a Methanoregula a leggyakrabban megfigyelt taxon, a Methanobacterium, Methanosaeta, Methanocella, Methanomassiliicoccus és Methanosarcina mellett. A torkolati üledékekben a Methanosaeta, a Methanobacterium, a Methanoregula és a Methanoculleus szekvenciáit mutatták ki leggyakrabban. A tavi üledékekben pedig főként a Methanoregula és a Methanosaeta fordult elő. A tengeri üledékekben a Methanoculleus és a Methanosaeta a leggyakoribb vonal, amelyet a Methanolinea követett.
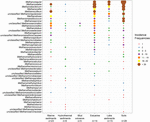
2. ÁBRA. A metanogén vonalak előfordulási gyakoriságát bemutató buborékdiagram a különböző természetes környezetekben. A függőleges tengely mentén a rangsor megfelel a vonalak csökkenő teljes előfordulási gyakoriságának. A taxonómia a nemzetség szintjén látható. Ha a nemzetségszinthez való hozzárendelés nem volt lehetséges, a következő magasabb taxonómiai szintet használtuk. A minták száma (n) minden egyes élőhelyhez meg van adva.
Noha sok taxont különböző környezetekben mutattak ki, egyesek mégis környezeti preferenciákat mutatnak. A nem tengeri és átmeneti környezetben (talajok, tavi üledékek és torkolatok) gyakran előforduló taxon, a Methanoregula hiányzik a tengeri élőhelyekről (tengeri üledékek, hidrotermális üledékek és iszapvulkánok). A nem tengeri és átmeneti környezetben uralkodó Methanobacterium és Methanocella ritkán fordul elő tengeri élőhelyeken. Ezzel szemben a Methanococcoides, mint a tengeri üledékekben, hidrotermális üledékekben és iszapvulkánokban uralkodó vonal, alig figyelhető meg talajokban és tavi üledékekben. Továbbá a Methanogenium és a Methanolacinia csak torkolati és tengeri üledékekben figyelhető meg, míg a Methanospirillum és a Methanosphaerula csak szárazföldi környezetben található. Ezenkívül néhány speciális taxon kizárólag hidrotermális üledékekben található, köztük a Methanocaldococcus, Methanothermococcus, Methanopyrus, Methanotorris és Methanococcus. Bár néhány vonal, mint például a Methanosaeta, a legtöbb környezetben jelen van, egyetlen vonal sem tekinthető mindenütt jelenlévőnek.
A legnagyobb vonalgazdagság a torkolati üledékekben fordult elő, amelyekben a különböző vonalak előfordulási gyakorisága is egyenletesebb. Ezzel szemben az iszapvulkánok és a hidrotermális ökoszisztémák viszonylag alacsony metanogén diverzitást mutatnak. A torkolatokhoz hasonló talajokat és tóüledékeket változatos metanogén együttesek jellemzik.
A metanogén közösségek alfa-diverzitása természetes környezetekben
A metanogén archaea gazdagsága a Chao2 index szerint nagymértékben változott az ökoszisztémák típusai között (3. ábra). Az alfa-diverzitások közvetlen összehasonlítása és a minták közötti ésszerű kiegyenlítés érdekében minden helyszínen 15 szekvenciára történő almintavételt végeztünk. A Chao2-index azt mutatja, hogy a torkolati üledékek tartalmazzák a metanogének legnagyobb fajgazdagságát a hat ökoszisztématípus mentén (S3. kiegészítő táblázat), ami alátámasztja a buborékdiagram eredményeit (2. ábra). A talajok és a tavi üledékek, amelyek alacsonyabb fajgazdagságot mutatnak, mint a torkolati minták, szignifikánsan magasabb Chao2-indexszel rendelkeznek, mint a tengeri üledékek és a hidrotermikus üledékek, és nincs szignifikáns különbség a tengeri üledékek és a hidrotermikus üledékek között (S3 kiegészítő táblázat).
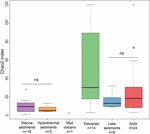
3. ÁBRÁZAT A különböző ökoszisztématípusok Chao2-indexeinek box plotja. A grafikon az egyes helyszínek 15 szekvenciáját tartalmazó részmintavételezett adathalmazokon alapul, hogy az alfa-diverzitási mértékek összehasonlítása robusztusabbá váljon. Az egyes élőhelyek mintáinak száma “n”-ként van megadva az élőhely címkéje alatt. Az “ns” a Wilcoxon-tesztben nem jelent statisztikai szignifikanciát. Az OTU-szintű alfa-diverzitás statisztikai eredményét az S3. kiegészítő táblázat tartalmazza.
A természetes környezetben élő metanogén közösségek globális kontrollja
A 94 globálisan elterjedt metanogén közösséget a Jaccard-távolság mátrixon alapuló PCoA alkalmazásával rendezési diagramba klasztereztük. A PCoA elemzés szerint az első és a második tengely együttesen a teljes variancia 16,3%-át magyarázza. A minták közötti eltérések tehát nagyrészt a sótartalommal magyarázhatók (4. ábra). Mivel a sókoncentrációra vonatkozó kezdeti adatok néhány esetben nem álltak rendelkezésre, ezeket a mintákat a fentiek szerint minőségileg sós, vegyes (köztes) és nem sós mintáknak soroltuk be. A sós és nem sós minták gyakorlatilag az első tengely mentén különülnek el. A kevert minták összességében a sós és a nem sós minták között helyezkednek el. A Jaccard-távolsági mátrixon alapuló permutációs MANOVA szintén arra utal, hogy a sótartalom az elsődleges abiotikus tényező, amely a globális metanogén közösségek eloszlását irányítja (R2 = 0,099, P < 0,001) (1. táblázat).
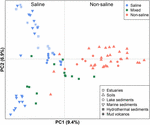
4. ÁBRÁZAT. A metanogén mcrA génszekvencia-könyvtárak Jaccard-távolsági mátrixán alapuló főkoordináta-analízis (PCoA) ordinációja 94 minta összehasonlításával. A PCoA a sótartalom szerint van színezve: A piros szimbólumok nem sós környezetet, a kék szimbólumok sós környezetet, a zöld szimbólumok pedig köztes környezetet jelölnek. A különböző szimbólumok különböző környezeteket ábrázolnak. A tengelyeken az ábrázolt főkoordináták által magyarázott variáció százalékos aránya látható.

TÁBLA 1. TÁBLA. Permutációs MANOVA-analízis a hat élőhelyről származó összes minta Jaccard-távolságmátrixán, hogy teszteljük a közösség varianciájának összefüggését a különböző környezeti változókkal.
Kiegészítésképpen ellenőriztük a metanogén tiszta kultúrák izolációs forrása és a növekedéshez szükséges NaCl optimális koncentrációja közötti lehetséges összefüggést. A metanogén tiszta kultúrák optimális NaCl-koncentrációja csökkenést mutatott a tengeri, a torkolati, a tavi üledék és a talaj ökoszisztémák között (S2. kiegészítő ábra). Néhány kiugró izolátum szódabikarbónás tóüledékekből vagy hiperszalin talajokból származik.
Környezeti kontrollok és metanogén indikátor taxonok nem sós talajokban és tóüledékekben
A nem sós talajokból és tóüledékekből származó metanogén közösségek globális szinten szorosan csoportosulnak (4. ábra), ezért tovább elemeztük e két élőhely metanogén közösségeinek környezeti kontrolljait, amelyek összesen 33 vizsgálati helyet jelentenek. A közösségalapú klaszterelemzés e két élőhelytípus esetében négy klasztert mutatott ki a Jaccard-távolság mátrix alapján (S3. kiegészítő ábra). A permutációs MANOVA arra utal, hogy mind a pH (R2 = 0,099, P < 0,001), mind a hőmérséklet (R2 = 0,069, P < 0,001) befolyásolja a metanogén β-diverzitást a nem sós talajokban és a tavi üledékekben (2. táblázat). Ennek megfelelően a négy klasztert az eredeti mintavételi hely pH-jának és MAAT-jának rendeltük hozzá, és a közösségek klaszterezéséhez nagyrészt konzisztens alcsoportokat kaptunk (5C,D ábra). A környezeti jellemzők és e négy közösségi klaszter kombinációja lehetővé teszi, hogy ezt a négy alcsoportot semleges és hideg 1. csoportként, savas és hideg 2. csoportként, savas és mérsékelt 3. csoportként, valamint semleges és meleg 4. csoportként határozzuk meg (5. ábra). A Jaccard-féle diszharmónia-mátrixon alapuló további PCoA-rendezés azt mutatja, hogy a PC1 tengely mentén a 2. és 3. csoportba tartozó minták többsége savas talajokból és tóüledékekből származik, míg az 1. és 4. csoport főként semleges környezetből (5A. ábra). Továbbá a PC2 tengely mentén a mérsékelt területekről származó minták (3. csoport) elkülönültek a meleg és hideg területekről származó mintáktól, míg a PC3 tengely mentén a meleg környezetből származó minták (4. csoport) elkülönültek a többi mintától (5B ábra). Ezáltal a PCoA ordináció első három tengelye a teljes variáció 38,8%-át magyarázza.

TABLE 2. TÁBLA. Nem sós talaj- és tóüledék minták Jaccard-távolság mátrixon alapuló permutációs MANOVA a közösségek varianciájának a különböző környezeti változókkal való összefüggésének vizsgálatára.
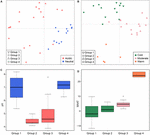
5. ábra. Jaccard-távolságmátrixon alapuló főkoordináta-elemzési diagram 33 nem sós talaj és tóüledék esetében. Az (A) altábla a PC1 és PC2 értékeket mutatja, a szimbólumok a pH szerint vannak színezve, a (B) altábla pedig a PC2 és PC3 értékeket mutatja, a szimbólumok pedig a hőmérséklet szerint vannak színezve. Az első három komponens a variancia 17,1, 11,7 és 10%-át magyarázza. A dobozdiagramok a négy azonosított alcsoport pH-ját (C) és MAAT-ját (D) (átlagos éves léghőmérséklet) mutatják. A C ábrán a doboz színe megfelel az (A) ábrán szereplő pH-kategóriának. A boxplotok színei a páronkénti Wilcoxon-teszt (P < 0,05) alapján mutatják a statisztikai szignifikanciát, ahol az azonos színű minták nem különböznek szignifikánsan egymástól. Hasonlóképpen, a (D) szín a (B) hőmérséklet-csoportosítást követi. Az alcsoportok a közösségi hasonlóságok hierarchikus klaszterelemzésére utalnak.
A metanogén vonalak előfordulását vizsgáltuk az egyes alcsoportokban az előfordulási gyakoriságok alapján (6. ábra). A Methanoregula minden típusú nem sós élőhelyen uralkodik. A Methanoregula mellett a semleges és hideg alcsoportban (1. csoport) a Methanosaeta, a Methanobacterium és a Methanosarcina nagy gyakorisággal fordul elő. A savas és hideg 2. csoportot a Methanobacterium, a Methanocella és a Methanosarcina képviseli, míg a Methanosaeta itt hiányzik. A Methanocella és a Methanosaeta gyakori a savas és mérsékelt 3. csoportban. A semleges és meleg 4. csoportban a Methanolinea és a Methanosaeta fontos tagok. Ez a csoport az egyetlen, ahol a Methanoculleus-t azonosították.

6. ÁBRA A metanogén vonalak előfordulási gyakorisága a metanogén közösségek négy meghatározott csoportján belül talajokban és tóüledékekben. A függőleges tengely alfabetikus sorrendben van elrendezve. A sávok hossza megfelel az egyes vonalak átlagos előfordulási gyakoriságának a megfelelő csoporton belül. A hibasávok egy adott taxon standard eltérését jelentik az adott csoport különböző mintáiban. A csillagok a < 0,05 P-értékkel rendelkező specialista taxonokat jelölik. A taxonómia a nemzetség szintjén van feltüntetve. Ha a nemzetségszintre történő hozzárendelés nem volt lehetséges, akkor a következő magasabb hozzárendelhető rendszertani szintet használtuk. A négy csoport leírását az 5. ábra tartalmazza.
Mind a négy csoport esetében a magas előfordulási gyakoriságú taxonok a következők: Methanoregula, Methanobacterium, Methanosarcina, Methanosaeta, Methanomassiliicoccus és Methanocella. A specialista taxonokat, amelyek egy adott csoporton belül a legtöbb helyszínen szignifikánsan nagyobb arányban képviseltetik magukat, a korábban ismertetett indikátorfaj-elemzés alapján mutattuk ki. Összesen a 31 taxonból hat mutatott szignifikáns indikátorértéket (P < 0,05) (a 6. ábrán csillaggal jelölve). Az 1. csoport (semleges és hideg) mutatta a legnagyobb számú specialistát a Methanosaeta, Methanolobus és Methanomethylovorans vonalakkal. A 2. csoportban (hideg és savas) a Methanobacterium szolgált specialistaként, míg a 4. csoportban (semleges és meleg) a Methanolinea-t azonosították specialistaként, de a többi csoportban alig volt megfigyelhető. Emellett a Methanoregula nagymértékben képviseltette magát a savas és mérsékelt 3. csoportban.
Diszperziós korlátok
A lineáris regressziós elemzés (R2= 0,05, P < 0,001) gyenge korrelációt mutatott a földrajzi távolság és a metanogén közösség szerkezete között a globális adathalmazon. Ugyanakkor a Mantel-teszt azt mutatta, hogy a környezeti változók magasabb korrelációt mutatnak a közösségi struktúrával, mint a földrajzi távolságok (lásd 3. táblázat). Ezt a tendenciát az autokorrelációs hatásokat ellenőrző részleges Mantel-teszt is megerősíti. A földrajzi távolság és a Jaccard-közösségi hasonlóság ábrázolása nem mutat egyértelmű lineáris trendet, hanem olyan mintázatokat, amelyek főként a mintavételi pontok globális eloszlásából adódnak (lásd az S4. kiegészítő ábrát).

TÁBLA 3. TÁBLA. Mantel- és részleges Mantel-teszt elemzések a környezeti változók és a földrajzi távolság mikrobiális eloszlásra gyakorolt hatásának meghatározására a globális adathalmaz és egy 16 európai mintából álló alminta esetében.
A szóródás hatásának további elemzése érdekében elemzésünket Európára korlátoztuk, ahol a legsűrűbben és legegyenletesebben vettünk mintát. A Mantel-tesztek és a részleges Mantel-tesztek ezen a részhalmazon reprodukálták azt a tendenciát, hogy a közösségi adatok nagyobb mértékben korrelálnak a környezeti változókkal, mint a földrajzi távolságokkal (lásd a 3. táblázatot). A környezeti változókat kontrolláló részleges Mantel-teszt nem tudott statisztikailag szignifikáns korrelációt kimutatni a mikrobiális közösség és a földrajzi távolság között. A 16 európai helyszínen végzett térbeli PCA-elemzés a metanogén közösség térbeli struktúráját jelzi (a teljes variancia 23,7%-át magyarázta ez a struktúra), ami megfelel a helyszínek pozitív térbeli autokorrelációjának, amint azt a Moran’s I index jelzi (Moran’s I = 0,4018). Csak az első sajátérték volt stabil, és megfelelt a minták Közép-Európa és a balti államok közötti elkülönülésének (S5. kiegészítő ábra). A kis adathalmaz azonban megnehezíti ennek a megfigyelt térbeli struktúrának a földrajzi, környezeti változókhoz vagy mindkettőhöz való robusztus hozzárendelését. Ezért a fentiek szerint klaszterelemzést végeztünk a metanogén közösségeken, és három csoportot mutattunk ki (7A. ábra), amelyeket földrajzi térképre vetítettünk (7B. ábra). A klaszterezés nem reprodukálta a Balti-tenger mentén végzett térbeli PCA elkülönítését. Ennek megfelelően egyes, földrajzilag egymáshoz nagyon közeli helyek eltérő metanogén közösségi struktúrát mutatnak, és különböző klaszterekbe tömörülnek. Másrészt néhány földrajzilag nagyon távoli helyszín nagyon hasonló közösségi összetételt mutat, és együttesen klasztereződnek (7B. ábra). Úgy tűnik, hogy a csoportok regionális szétszóródása Európában nem felel meg egy földrajzi struktúrának, és nem is korlátozza azt.
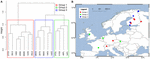
7. ábra. Hierarchikus klaszterelemzés Jaccard-távolságmátrixa 16 európai talaj- és tóüledékminta között. Az elemzéshez a Ward-féle klaszterezési módszert használtuk. A helyszíneket három csoportba osztottuk, amelyeket a klaszterezési dendrogramban (A) különböző téglalapok színeznek, és egy európai térképre vetítettünk (B).
Diszkusszió
A mikrobiális ökológiában nagy jelentőséggel bír a biogeográfia fogalmainak azonosítása és alkalmazása a mikrobiális közösségekre. A mikrobiális biogeográfiát feltehetően négy fő folyamat evolúciós és ökológiai kölcsönhatása irányítja: az élőhelyszűrés, a szétszóródás, a sodródás és a mutáció (Hanson és mtsai., 2012). Bár az elsodródás és a mutáció hatása meghaladja e tanulmány értelmezési lehetőségeit, megmutatjuk, hogy a természetes környezetben a metanogén közösségek globális mintázatai léteznek. Ez a tanulmány a metanogén közösségek globális biogeográfiai mintázatát mutatja be, amely inkább az élőhelyszűréshez, mint a földrajzi szétszóródáshoz kapcsolódik. A szóda tavi üledékekből származó metanogén közösségek például szorosan klasztereződnek a földrajzilag távoli tengeri mintákhoz (4. ábra), és nagyon hasonló metanogén közösségek fordulnak elő az európai talaj- és tóüledékekben annak ellenére, hogy nagy távolságban helyezkednek el egymástól (7. ábra). Összességében a lehetséges diszperziós korlátozások feltárására tett kísérleteink a földrajzi elhelyezkedésnek a metanogén közösségek szerkezetére gyakorolt gyenge hatását mutatták ki, ami ellentétben áll a környezeti feltételek egyértelmű hatásával. A mikrobiális közösségekre gyakorolt térbeli hatások végleges kizárása a rendelkezésre álló adatpontok alapján nem lehetséges. A mintavételi pontok bizonyos élőhelyekre és/vagy területekre összpontosítanak, míg a minták száma összességében alacsony. Ha van is hatás, feltételezzük, hogy a térbeli hatások csak regionális vagy helyi szinten jelentkeznek. Helyi terjedési korlátozásokról számoltak be a földrajzi akadályok által okozott hipertermofil archaea (Whitaker et al., 2003), az ammónia-oxidáló baktériumok esetében a helyi sós mocsarakban, de nem regionális és kontinentális léptékben (Martiny et al., 2011), a mélytengeri üledékekben élő mikroorganizmusok esetében a környezeti beállításokkal együtt (Schauer et al., 2009), és a baktériumok számára egy nagyszámú heterogén hókörnyezetet, amelyet főként az allochton szén elérhetősége okoz (Lutz et al., 2016). A természetes környezetben a metanogénekre gyakorolt diszperziós korlátozás csekély hatása azt jelenti, hogy a metanogének véletlenszerűen eloszolhatnak a térben, a helyi környezet sikeresen szelektálja őket, ha fiziológiai követelményeik teljesülnek, és stabil közösségeket hozhatnak létre (Martiny et al., 2006; von Mering et al., 2007).
Az élőhelyszűrés fogalma azt jelenti, hogy a hasonló ökológiai követelményekkel rendelkező fajoknak gyakrabban kell együtt előfordulniuk, mint ahogy az véletlenszerűen várható (Weiher és Keddy, 2001; Cornwell et al., 2006; Ulrich et al., 2010). Eredményeink azt mutatják, hogy a metanogén közösségek összetételében nagy különbségek mutatkoznak a tengeri és a vizes élőhelyek és tavak ökoszisztémái között, míg a torkolatok a kettő között csoportosulnak. Környezeti mintákon végzett génvizsgálatokon alapuló biogeográfiai mintázatokról számoltak be az általános baktériumok (Nemergut et al., 2011), a metánszivárgási mikrobiom (Ruff et al., 2015), az ammóniaoxidáló archaea (Cao et al., 2013), a tengeri pelágikus és benti baktériumok (Zinger et al., 2011) és a nitrogénciklikus mikroorganizmusok (Church et al., 2008) esetében is. Az élőhelyszűrésről kifejezetten a nem kultúrált archaea (Auguet et al., 2010), egész baktériumközösségek különböző környezetekben (von Mering et al., 2007; Chaffron et al., 2010) vagy dél-amerikai tőzeglápokban regionális léptékben (Oloo et al., 2016), valamint specifikus baktériumcsoportok, például metánoxidáló (Knief, 2015) és nitrogénmegkötő baktériumok (Nelson et al., 2016).
Eredményeink azt mutatják, hogy globális szinten a sótartalom jelentősen szabályozza a metanogén közösségek összetételét, és nagy különbségeket határoz meg a tengeri és szárazföldi metanogén együttesek között. A szóda tavi üledékekből származó metanogének is a tengeri üledékekből származó metanogénekkel klasztereződnek (4. ábra), kiemelve a sótartalom globális hatását. Ez az eredmény összhangban van más, a 16S rRNS-génen alapuló vizsgálatokkal, amelyek feltárják, hogy a sótartalom elsődleges tényező, amely az általános bakteriális és az általános archeális közösségek globális mintázatát alakítja (Lozupone és Knight, 2007; Auguet et al., 2010; Caporaso et al., 2011; Cao et al., 2013). A földrajzi elkülönülés csekély, de a sótartalomnak az általános mikrobiális közösségekre gyakorolt erős hatását korábbi vizsgálatokban is megfigyelték (Logares et al., 2013; Yang et al., 2016). Ennek megfelelően a sótartalom nagymértékben meghatározza, hogy mely vonalak maradhatnak fenn. Különböző élőhelyeken a metántermelési aktivitás negatívan korrelált a sótartalommal (Bartlett et al., 1987; Potter et al., 2009; Poffenbarger et al., 2011). A metántermelés sótartalom általi gátlása ezáltal feltételezhetően egybeesik a metanogén populáció méretének csökkenésével (Pattnaik et al., 2000). A sótartalom hatása a hidrogénotróf, acetotróf és metilotróf metanogenezisre ezáltal a sótartalom szintjétől függ, és a metanogenezis különböző útjai esetében eltérő (Liu et al., 2016). Jelenleg nincs egyértelmű mechanizmus a sótartalom közösségi szerkezetre gyakorolt hatásának magyarázatára, de számos hipotézis szolgálhat lehetséges magyarázatként. Fiziológiai szempontból a sótartalom befolyásolja a sejtek külső és belső ozmolaritását. A nem sóhoz alkalmazkodó metanogén sejtek fiziológiai alkalmazkodást fejlesztettek ki a belső turgornyomás ellensúlyozására, míg a sóhoz alkalmazkodó sejtek elvesztették ezt a tulajdonságukat (Zinder, 1993). Emellett a növekvő sótartalom arra késztetheti a metanogéneket, hogy jelentős energetikai és ezáltal metabolikus költséggel járó kompatibilis oldott anyagok nagyobb arányát szintetizálják vagy vegyék fel (McGenity, 2010). A sótűrés tulajdonsága még a metanogén tiszta kultúrák növekedéséhez szükséges NaCl optimális koncentrációjában is megnyilvánul, mivel azt találtuk, hogy a tengeri üledékekből és hidrotermális üledékekből származó izolátumok optimális NaCl koncentrációja jelentősen magasabb, mint a talajokból származó izolátumoké (S2. kiegészítő ábra).
A nem sós szárazföldi ökoszisztémákban, különösen a talajokban és a tavi üledékekben a metanogén közösség összetételét a hőmérséklet és a pH kombinációja szabályozza. Ennek megfelelően e környezetek metanogénjei négy csoportba sorolhatók (6. ábra). A tengeri ökoszisztémáktól eltérően a nem sós szárazföldi ökoszisztémák mind a pH, mind a hőmérséklet tekintetében nagy természetes változékonyságot mutatnak. A hőmérséklet nemcsak a metanogén útvonalat, hanem magukat a metanogén populációkat is befolyásolhatja (Conrad, 2007; Rooney-Varga et al., 2007). A metántermelés nagymértékben fokozódhat, ha a hőmérséklet emelkedik a fermentáció és az acetogenezis során a hőmérsékletre érzékeny lépések következtében (Megonigal et al., 2005; Kotsyurbenko et al., 2007). Emellett az alacsony pH jelentősen korlátozhatja az acetát elérhetőségét azáltal, hogy megakadályozza az acetát disszociációját, és így negatívan befolyásolja az acetoklasztikus metanogenezist (Fukuzaki et al., 1990; Bridgham et al., 2013). Ez lehet az egyik lehetséges oka annak, hogy a Methanosaeta hiányzott a 2. csoportból, míg a Methanosarcina képes váltani a különböző források között, és nem befolyásolta jelentősen. Ezenkívül a pH szabályozhatja a metántermelés hatékonyságát és a metanogén útvonalakat az ombrotróf és a minerotróf tőzeglápok között, mindkét metanogenezis útvonal közvetlen gátlásán keresztül és közvetve a fermentációra gyakorolt hatásán keresztül (Ye et al., 2012). Ezért mind a hőmérséklet, mind a pH közvetlenül vagy közvetve szabályozhatja a metanogenezishez kapcsolódó metabolikus lépéseket és az upstream fermentációt, amely szubsztrátot biztosít a metanogének számára.
A metanoregula mindenütt jelen van és nagyon gyakori a szárazföldi élőhelyek mind a négy csoportjában (6. ábra), de gyakorlatilag hiányzik a tengeri rendszerből, így az édesvíz hatásának helyettesítőjének bizonyulhat a tengeri birodalomban. Globális jelentőségéről nemrégiben máshol is beszámoltunk (Yang et al., 2017). A talajokban és tavi üledékekben való mindenütt jelenlévő elterjedése ellenére a Methanoregula indikátor vonalként a mérsékelt hőmérsékletű, savas élőhelyeken fordul elő. Továbbá úgy tűnik, hogy (1) a Methanolinea különösen a meleg, semleges szárazföldi környezetekhez, (2) a Methanobacterium a hideg, savas környezetekhez, (3) a Methanosaeta pedig a pH-semleges környezetekhez alkalmazkodott, ami összhangban van más vizsgálatokkal (Rosenberg et al., 2014), és hangsúlyozza megközelítésünk robusztusságát. Általában a metanogén közösségeket körülvevő geokémiai körülmények niche-differenciálódáshoz vezetnek. Mivel a niche-válogatás hajlamos az adaptív specialistákat elhagyni (Langenheder és Székely, 2011), a progresszív hosszú távú környezeti szelekció különböző niche-eket hozott létre, amelyeket az endemikus élőhelyi specialisták egy sora töltött be, amelyek más, eltérő környezeti feltételek mellett kevésbé képviseltetik magukat vagy hiányozhatnak. A közösséget olyan biotikus tényezők is alakítják, mint az ökológiai kölcsönhatások, a dinamika, a versengés és a szimbiózis. E biológiai tényezők ellenére von Mering és munkatársai (2007) megállapították, hogy az élőhelypreferenciák gyakran figyelemre méltóan stabilak az idők folyamán, és a környezeti közösségek jellegzetes taxonómiai összetétele viszont fontos mutatója lehet ökológiájuknak és működésüknek.
A metanogén archaea élőhelypreferenciájával összhangban úgy tűnik, hogy a közeli rokon metanogén törzseket gyakran hasonló környezetből izolálták. Úgy tűnik például, hogy a Methanoregulaceae természetes környezetben meglehetősen változatos (Yang et al., 2017), és a semleges törzsek eddig ellenálltak a tenyésztésnek. A Methanoregula jelenleg leírt törzsei mindketten enyhén acidofil környezetből származnak, míg a Methanolinea két képviselője viszonylag meleg élőhelyről, például emésztőiszapból, illetve rizsföldek talajából (Rosenberg és mtsai., 2014). Bár a Methanobacterium törzseket különböző környezetekből izolálták, a nemzetség meglévő izolátumainak körülbelül a fele 7-nél valamivel kisebb pH-optimumot mutat, ami azt jelenti, hogy a környezeti szekvenciák alapján azonosított indikátor vonalak a meglévő metanogén kultúrák fiziológiájának és forrásainak differenciálódását tükrözhetik. Például az élőhely sótartalma, mint az élőhely általános tulajdonsága, fokozatosan erős környezeti szelekciónak teheti ki a szervezeteket, és szűrheti a környezeti sótartalomhoz legjobban alkalmazkodó új fajkészlet összeállítását (Logares et al., 2013).
A biológiai sokféleség megőrzése és kezelése napjaink társadalmának egyik elsődleges kihívása. Itt azt mutatjuk be, hogy a természetes környezetek metanogén archaeiái a torkolati üledékekben a legváltozatosabbak. A torkolatok átmeneti zónák a tengeri és szárazföldi ökoszisztémák között. Ez két fő folyamatot tesz lehetővé, amelyek hozzájárulhatnak a fajgazdagsághoz. Először is, a torkolatokban a tengerből és a szárazföldről származó mikrobák keverednek, és végül összességében magas diverzitást foglalnak magukban (McLusky és Elliott, 2004). Megfigyelték például a torkolati baktériumok, archaea, gombák, sőt egyedi funkciókat ellátó specifikus baktériumok nagy változatosságát (Cunliffe és mtsai., 2008; Mosier és Francis, 2008; Crump és mtsai., 2012). Egy másik szempont a magas tápanyagszint, amely a szárazföldi, árapály-beviteleknek köszönhető, és amellyel a torkolati élőlények táplálkozhatnak (McLusky és Elliott, 2004; Statham, 2012). Ebben az összefüggésben a torkolati környezetek fontosak a metanogének generikus újdonságainak helyreállításában. A faji sokféleség ökoszisztéma-folyamatokra gyakorolt hatásai eddig jelentős kutatási erőfeszítéseket vonzottak. A biológiai sokféleség és az ökoszisztémafunkció közötti kapcsolat még mindig vita tárgyát képezi, és a mikrobiális közösségek esetében továbbra is megfoghatatlan (Loreau et al., 2001; Tilman et al., 2014). Annak ellenére, hogy a talajok és a tavi üledékek elsődleges metánforrások és egyben nagy metanogén diverzitással rendelkező élőhelyek, azt javasoljuk, hogy a fajgazdagság nem megfelelő proxy a metántermelési potenciál és az ökoszisztéma metánkibocsátásának mérésére; úgy tűnik, inkább a környezet heterogenitását és történetét tükrözi. A környezetek fajgazdagság szerinti rangsorolása nem feltétlenül jelenti a metánkibocsátási potenciált, amely a talajokból és a tavakból a legmagasabb, a torkolatokból pedig viszonylag kisebb (3. ábra és az S1 kiegészítő ábra).
Végezetül, a környezeti információk hiánya a nyilvános adatbázisokban akadályozhatta az itt megfigyelt környezeti tényezők teljes körű értelmezését. Bár a szakirodalomban és a nyilvános adatbázisokban egyre több szekvenciaadat található a metanogénekről, a megadott kapcsolódó abiotikus változók gyakran következetlenek és ritkák. A környezeti változókra vonatkozó konzisztens információk korlátozott mennyisége korlátozza a többváltozós statisztikai elemzések alkalmazását. Emlékeztetve arra, hogy az abiotikus tényezők ebben a tanulmányban a közösségi varianciáknak csak egy korlátozott hányadát képesek megmagyarázni, arra utal, hogy más magyarázó változók is hiányoznak. Különösen fontos lehet a metanogén szubsztrátok, például az acetát, a hidrogén és a metilaminok koncentrációja és elérhetősége. Mindazonáltal az abiotikus paraméterek talán soha nem lesznek elegendőek a metanogén együttesek szerkezetének teljes megmagyarázására, egyszerűen azért, mert az élőhelyek eltérő történettel rendelkeznek, és csak helyileg vizsgálhatók. A rendelkezésre álló mcrA-adatok között az orosz és kanadai szubarktikus és sarkvidéki területek hatalmas területei is gyengén reprezentáltak. Az mcrA génadatok jobb földrajzi lefedettsége és egyenletesebb eloszlása javítaná a metanogén közösségek globális szintű értékelését.
Author Contributions
SL és XW tervezte a tanulmányt. XW és SY összegyűjtötte és elemezte az adatokat. XW, SY és FH végezte a statisztikai elemzést. XW, MW és SY végezte a filogenetikai korrekciót. XW, SY, FH, MW, DW és SL értelmezték az eredményeket és írták a tanulmányt. Minden szerző hozzájárult a megbeszélésekhez és átnézte a kéziratot.
Kérdések összeférhetetlenségi nyilatkozata
A szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségként értelmezhetők.
Köszönet
A Kínai Ösztöndíj Tanács (CSC) által XW számára biztosított pénzügyi támogatást (Grant No. 201408620031 to XW) hálásan köszönjük. Ezt a tanulmányt a Helmholtz Gemeinschaft (HGF) támogatta a Helmholtz Young Investigators Group of SL (VH-NG-919) finanszírozásával.
Kiegészítő anyag
A cikkhez tartozó kiegészítő anyag online elérhető a következő címen: https://www.frontiersin.org/article/10.3389/fmicb.2017.01339/full#supplementary-material
Lábjegyzetek
- ^ http://metanogen.biotech.uni.wroc.pl/
- ^ http://www.ncbi.nlm.nih.gov/
- ^ http://metanogen.biotech.uni.wroc.pl/
- ^ https://www.ngdc.noaa.gov/mgg/shorelines/gshhs.html
- ^ http://qgis.osgeo.org
Auguet, J. C., Barberan, A. és Casamayor, E. O. (2010). Global ecological patterns in uncultured Archaea. ISME J. 4, 182-190. doi: 10.1038/ismej.2009.109
PubMed Abstract | CrossRef Full Text | Google Scholar
Bange, H. W., Bartell, U. H., Rapsomanikis, S., and Andreae, M. O. (1994). Metán a Balti- és az Északi-tengerben és a tengeri metánkibocsátás újraértékelése. Glob. Biogeochem. Cycles 8, 465-480. doi: 10.1029/94GB02181
CrossRef Full Text | Google Scholar
Barreto, D. P., Conrad, R., Klose, M., Claus, P., and Enrich-Prast, A. (2014). Baktériumok, archaea és metanogén archaea távolság-lebomlási és taxon-terület kapcsolatai egy trópusi tó üledékében. PLoS ONE 9:e110128. doi: 10.1371/journal.pone.0110128
PubMed Abstract | CrossRef Full Text | Google Scholar
Bartlett, K. B., Bartlett, D. S., Harriss, R. C., and Sebacher, D. I. (1987). Metánkibocsátás egy sós mocsár sótartalmi gradiens mentén. Biogeochemistry 4, 183-202. doi: 10.1007/BF02187365
CrossRef Full Text | Google Scholar
Borrel, G., O’Toole, P. W., Harris, H. M. B., Peyret, P., Brugere, J. F., and Gribaldo, S. (2013). A filogenomikai adatok alátámasztják a metilotróf metanogének hetedik rendjét, és betekintést nyújtanak a metanogenezis evolúciójába. Genome Biol. Evol. 5, 1769-1780. doi: 10.1093/Gbe/Evt128
PubMed Abstract | CrossRef Full Text | Google Scholar
Bousquet, P., Ciais, P., Miller, J., Dlugokencky, E., Hauglustaine, D., Prigent, C., et al. (2006). Az antropogén és természetes források hozzájárulása a légköri metán változékonyságához. Nature 443, 439-443. doi: 10.1038/nature05132
PubMed Abstract | CrossRef Full Text | Google Scholar
Bridgham, S. D., Cadillo-Quiroz, H., Keller, J. K., and Zhuang, Q. (2013). A vizes élőhelyekből származó metánkibocsátás: biogeokémiai, mikrobiológiai és modellezési perspektívák a helyi és a globális lépték között. Glob. Chang. Biol. 19, 1325-1346. doi: 10.1111/gcb.12131
PubMed Abstract | CrossRef Full Text | Google Scholar
Cao, H., Auguet, J.-C., and Gu, J.-D. (2013). Az ammónia-oxidáló archaea globális ökológiai mintázata. PLoS ONE 8:e52853. doi: 10.1371/journal.pone.0052853
PubMed Abstract | CrossRef Full Text | Google Scholar
Caporaso, J. G., Lauber, C. L., Walters, W. A., Berg-Lyons, D., Lozupone, C. A., Turnbaugh, P. J., et al. (2011). A 16S rRNS diverzitás globális mintázatai mintánként több millió szekvencia mélységben. Proc. Natl. Acad. Sci. U.S.A. 108, 4516-4522. doi: 10.1073/pnas.1000080107
PubMed Abstract | CrossRef Full Text | Google Scholar
Chaffron, S., Rehrauer, H., Pernthaler, J., and von Mering, C. (2010). Az együttélő mikrobák globális hálózata környezeti és teljes genom szekvencia adatokból. Genome Res. 20, 947-959. doi: 10.1101/gr.104521.109
PubMed Abstract | CrossRef Full Text | Google Scholar
Church, M. J., Bjorkman, K. M., Karl, D. M., Saito, M. A., and Zehr, J. P. (2008). A nitrogénmegkötő baktériumok regionális eloszlása a Csendes-óceánban. Limnol. Oceanogr. 53, 63-77. doi: 10.4319/lo.2008.53.1.0063
CrossRef Full Text | Google Scholar
Conrad, R. (2007). “A metanogének és metanotrófok mikrobiális ökológiája”, in Advances in Agronomy, szerk. L. S. Donald (Cambridge, MA: Academic Press), 1-63.
Google Scholar
Cornwell, W. K., Schwilk, D. W., and Ackerly, D. D. (2006). Az élőhelyszűrés tulajdonságalapú tesztje: konvex héj térfogata. Ecology 87, 1465-1471. doi: 10.1890/0012-9658(2006)872.0.CO;2
PubMed Abstract | CrossRef Full Text | Google Scholar
Crump, B. C., Amaral-Zettler, L. A., and Kling, G. W. (2012). A sarkvidéki édesvizek mikrobiális diverzitása talajból származó mikrobák beoltásával strukturálódik. ISME J. 6, 1629-1639. doi: 10.1038/ismej.2012.9
PubMed Abstract | CrossRef Full Text | Google Scholar
Cui, M., Ma, A., Qi, H., Zhuang, X., Zhuang, G., and Zhao, G. (2015). A melegebb hőmérséklet felgyorsítja a metánkibocsátást a Zoige vizes élőhelyről a Tibeti-fennsíkon anélkül, hogy a metanogén közösség összetétele megváltozna. Sci. Rep. 5:11616. doi: 10.1038/srep11616
PubMed Abstract | CrossRef Full Text | Google Scholar
Cunliffe, M., Schafer, H., Harrison, E., Cleave, S., Upstill-Goddard, R., and Murrell, J. C. (2008). Egy torkolatvidék felszíni mikrorétegéhez kapcsolódó baktérium- és archeaközösségek filogenetikai és funkcionális génelemzése. ISME J. 2, 776-789. doi: 10.1038/ismej.2008.28
PubMed Abstract | CrossRef Full Text | Google Scholar
Dray, S., and Dufour, A. B. (2007). Az ade4 csomag: a dualitási diagram megvalósítása ökológusok számára. J. Stat. Softw. 22, 1-20. doi: 10.18637/jss.v022.i04
CrossRef Full Text | Google Scholar
Dufrene, M., and Legendre, P. (1997). Fajegyüttesek és indikátorfajok: rugalmas aszimmetrikus megközelítés szükségessége. Ecol. Monogr. 67, 345-366. doi: 10.2307/2963459
CrossRef Full Text | Google Scholar
Edgar, R. C., Haas, B. J., Clemente, J. C., Quince, C., and Knight, R. (2011). Az UCHIME javítja a kiméra kimutatás érzékenységét és sebességét. Bioinformatics 27, 2194-2200. doi: 10.1093/bioinformatics/btr381
PubMed Abstract | CrossRef Full Text | Google Scholar
Evans, P. N., Parks, D. H., Chadwick, G. L., Robbins, S. J., Orphan, V. J., Golding, S. D., et al. (2015). Metán-metabolizmus a Bathyarchaeota törzsben a genom-centrikus metagenomika által feltárt archaeális törzsben. Science 350, 434-438. doi: 10.1126/science.aac7745
PubMed Abstract | CrossRef Full Text | Google Scholar
Fish, J. A., Chai, B., Wang, Q., Sun, Y., Brown, C. T., Tiedje, J. M., et al. (2013). FunGene: a funkcionális gén csővezeték és adattár. Front. Microbiol. 4:291. doi: 10.3389/fmicb.2013.00291
PubMed Abstract | CrossRef Full Text | Google Scholar
Frank-Fahle, B. A., Yergeau, E., Greer, C. W., Lantuit, H., and Wagner, D. (2014). Mikrobiális funkcionális potenciál és a közösségek összetétele az északnyugat-kanadai sarkvidék permafroszt által érintett talajaiban. PLoS ONE 9:e84761. doi: 10.1371/journal.pone.0084761.g001
PubMed Abstract | CrossRef Full Text | Google Scholar
Fukuzaki, S., Nishio, N., and Nagai, S. (1990). Az acetát metanogén fermentációjának kinetikája. Appl. Environ. Microbiol. 56, 3158-3163.
Google Scholar
Hanson, C. A., Fuhrman, J. A., Horner-Devine, M. C., and Martiny, J. B. (2012). A biogeográfiai mintákon túl: a mikrobiális tájat alakító folyamatok. Nat. Rev. Microbiol. 10, 497-506. doi: 10.1038/Nrmicro2795
PubMed Abstract | CrossRef Full Text | Google Scholar
Holm, G. O., Perez, B. C., McWhorter, D. E., Krauss, K. W., Johnson, D. J., Raynie, R. C., et al. (2016). Ökoszisztémaszintű metánáramlások a Mississippi folyó deltájának árapályos édesvízi és brakkos mocsaraiból: következmények a part menti vizes élőhelyek szén-dioxid-projektjeire. Wetlands 36, 401-413. doi: 10.1007/s13157-016-0746-7
CrossRef Full Text | Google Scholar
Hunger, S., Schmidt, O., Hilgarth, M., Horn, M. A., Kolb, S., Conrad, R., et al. (2011). Versengő formát- és szén-dioxid-hasznosító prokarióták egy anoxikus metánt kibocsátó láptalajban. Appl. Environ. Microbiol. 77, 3773-3785. doi: 10.1128/AEM.00282-11
PubMed Abstract | CrossRef Full Text | Google Scholar
IPCC (2007). “Climate Change 2007: the Physical Science Basis,” in Proceedings of the Contribution of Working Group I to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change, eds D. Qin, S. Solomon, M. Manning, Z. Chen, M. Marquis, K. B. Averyt, et al. (Cambridge: Cambridge University Press).
Google Scholar
Jabłoński, S., Rodowicz, P., and Łukaszewicz, M. (2015). Fiziológiai és biokémiai jellemzőket tartalmazó metanogén archaea adatbázis. Int. J. Syst. Evol. Microbiol. 65, 1360-1368. doi: 10.1099/ijs.0.000065
PubMed Abstract | CrossRef Full Text | Google Scholar
Kirschke, S., Bousquet, P., Ciais, P., Saunois, M., Canadell, J. G., Dlugokencky, E. J., et al. (2013). A globális metánforrások és -nyelők három évtizede. Nat. Geosci. 6, 813-823. doi: 10.1038/Ngeo1955
CrossRef Full Text | Google Scholar
Knief, C. (2015). Termesztett és nem termesztett aerob metanotróf baktériumok diverzitása és élőhelypreferenciája a pmoA mint molekuláris marker alapján értékelve. Front. Microbiol. 6:1346. doi: 10.3389/fmicb.2015.01346
PubMed Abstract | CrossRef Full Text | Google Scholar
Kotsyurbenko, O., Friedrich, M., Simankova, M., Nozhevnikova, A., Golyshin, P., Timmis, K., et al. (2007). Az acetoklasztikusról a H2-függő metanogenezisre való áttérés egy nyugat-szibériai tőzeglápban alacsony pH-értékek mellett és egy acidofil Methanobacterium törzs izolálása. Appl. Environ. Microbiol. 73, 2344-2348. doi: 10.1128/AEM.02413-06
PubMed Abstract | CrossRef Full Text | Google Scholar
Langenheder, S., and Székely, A. J. (2011). A fajválogatás és a semleges folyamatok egyaránt fontosak a baktériumközösségek kezdeti összeállása során. ISME J. 5, 1086-1094. doi: 10.1038/ismej.2010.207
PubMed Abstract | CrossRef Full Text | Google Scholar
Liebner, S., Ganzert, L., Kiss, A., Yang, S., Wagner, D., and Svenning, M. M. (2015). A metanogén közösség összetételének és a metánáramlásnak az eltolódása a diszkontinuus permafroszt degradációja mentén. Front. Microbiol. 6:356. doi: 10.3389/fmicb.2015.00356
PubMed Abstract | CrossRef Full Text | Google Scholar
Liu, Y. Q., Priscu, J. C., Xiong, J. B., Conrad, R., Vick-Majors, T., Chu, H. Y., et al. (2016). A sótartalom irányítja az archeális eloszlási mintázatokat a Tibeti-fennsík magaslati tóüledékében. FEMS Microbiol. Ecol. 92:fiw033. doi: 10.1093/femsec/fiw033
PubMed Abstract | CrossRef Full Text | Google Scholar
Logares, R., Lindstrom, E. S., Langenheder, S., Logue, J. B., Paterson, H., Laybourn-Parry, J., et al. (2013). A progresszív hosszú távú környezeti változásoknak kitett baktériumközösségek biogeográfiája. ISME J. 7, 937-948. doi: 10.1038/ismej.2012.168
PubMed Abstract | CrossRef Full Text | Google Scholar
Loreau, M., Naeem, S., Inchausti, P., Bengtsson, J., Grime, J. P., Hector, A., et al. (2001). Biodiverzitás és ökoszisztémák működése: jelenlegi ismeretek és jövőbeli kihívások. Science 294, 804-808. doi: 10.1126/science.1064088
PubMed Abstract | CrossRef Full Text | Google Scholar
Lozupone, C. A., and Knight, R. (2007). A bakteriális diverzitás globális mintázatai. Proc. Natl. Acad. Sci. U.S.A. 104, 11436-11440. doi: 10.1073/pnas.0611525104
PubMed Abstract | CrossRef Full Text | Google Scholar
Luton, P. E., Wayne, J. M., Sharp, R. J., and Riley, P. W. (2002). Az mcrA gén mint a 16S rRNS alternatívája a hulladéklerakók metanogén populációinak filogenetikai elemzésében. Microbiology 148, 3521-3530. doi: 10.1099/00221287-148-11-3521
PubMed Abstract | CrossRef Full Text | Google Scholar
Lutz, S., Anesio, A. M., Raiswell, R., Edwards, A., Newton, R. J., Gill, F., et al. (2016). A vörös hó mikrobiomjainak biogeográfiája és szerepük a sarkvidéki gleccserek olvadásában. Nat. Commun. 7:11968. doi: 10.1038/ncomms11968
PubMed Abstract | CrossRef Full Text | Google Scholar
Martiny, J. B. H., Bohannan, B. J. M., Brown, J. H., Colwell, R. K., Fuhrman, J. A., Green, J. L., et al. (2006). Mikrobiális biogeográfia: a mikroorganizmusok elhelyezése a térképen. Nat. Rev. Microbiol. 4, 102-112. doi: 10.1038/Nrmicro1341
PubMed Abstract | CrossRef Full Text | Google Scholar
Martiny, J. B. H., Eisen, J. A., Penn, K., Allison, S. D., and Horner-Devine, M. C. (2011). A baktériumok béta-diverzitásának mozgatórugói a területi léptéktől függenek. Proc. Natl. Acad. Sci. U.S.A. 108, 7850-7854. doi: 10.1073/pnas.1016308108
PubMed Abstract | CrossRef Full Text | Google Scholar
McArdle, B. H., and Anderson, M. J. (2001). Többváltozós modellek illesztése közösségi adatokra: megjegyzés a távolságalapú redundanciaelemzéshez. Ecology 82, 290-297. doi: 10.1890/0012-9658(2001)0822.0.CO;2
CrossRef Full Text | Google Scholar
McCalley, C. K., Woodcroft, B. J., Hodgkins, S. B., Wehr, R. A., Kim, E.-H., Mondav, R., et al. (2014). A metán dinamikáját szabályozó mikrobiális közösségek válasza a permafroszt olvadására. Nature 514, 478-481. doi: 10.1038/nature13798
PubMed Abstract | CrossRef Full Text | Google Scholar
McGenity, T. J. (2010). “Methanogens and Methanogenesis in Hypersaline Environments,” in Handbook of Hydrocarbon and Lipid Microbiology, ed. K. N. Timmis (Berlin: Springer), 665-680. doi: 10.1007/978-3-540-77587-4_53
CrossRef Full Text | Google Scholar
McLusky, D. S., and Elliott, M. (2004). A torkolati ökoszisztéma: Ecology, Threats and Management. New York, NY: Oxford University Press. doi: 10.1093/acprof:oso/9780198525080.001.0001
CrossRef Full Text | Google Scholar
Megonigal, J. P., Mines, M. E., and Visscher, P. T. (2005). “Anaerob anyagcsere: kapcsolatok a nyomgázokkal és az aerob folyamatokkal”, in Biogeochemistry, szerk. W. H. Schlesinger (Oxford: Elsevier), 350-362.
Google Scholar
Milferstedt, K., Youngblut, N. D., and Whitaker, R. J. (2010). A metanogén populációk térbeli szerkezete és fennmaradása humuszos mocsári tavakban. ISME J. 4, 764-776. doi: 10.1038/Ismej.2010.7
PubMed Abstract | CrossRef Full Text | Google Scholar
Mosier, A. C., and Francis, C. A. (2008). Az ammónia-oxidáló archaea és baktériumok relatív abundanciája és diverzitása a San Francisco-öböl torkolatában. Environ. Microbiol. 10, 3002-3016. doi: 10.1111/j.1462-2920.2008.01764.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Nazaries, L., Murrell, J. C., Millard, P., Baggs, L., and Singh, B. K. (2013). Metán, mikrobák és modellek: a talaj metánciklusának alapvető megértése a jövőbeli előrejelzésekhez. Environ. Microbiol. 15, 2395-2417. doi: 10.1111/1462-2920.12149
PubMed Abstract | CrossRef Full Text | Google Scholar
Nelson, M. B., Martiny, A. C., and Martiny, J. B. H. (2016). A talajban található mikrobiális nitrogénhasznosító tulajdonságok globális biogeográfiája. Proc. Natl. Acad. Sci. U.S.A. 113, 8033-8040. doi: 10.1073/pnas.1601070113
PubMed Abstract | CrossRef Full Text | Google Scholar
Nemergut, D. R., Costello, E. K., Hamady, M., Lozupone, C., Jiang, L., Schmidt, S. K., et al. (2011). Globális minták a bakteriális taxonok biogeográfiájában. Environ. Microbiol. 13, 135-144. doi: 10.1111/j.1462-2920.2010.02315.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Nobu, M. K., Narihiro, T., Kuroda, K., Mei, R., and Liu, W. T. (2016). A megfoghatatlan Euryarchaeota osztály WSA2 üldözése: a genomok egy egyedülállóan igényes metil-reduzáló metanogént tárnak fel. ISME J. 10, 2478-2487. doi: 10.1038/ismej.2016.33
PubMed Abstract | CrossRef Full Text | Google Scholar
Oksanen, J., Blanchet, F. G., Kindt, R., Legendre, P., Minchin, P. R., O’Hara, R. B., et al. (2015). vegan: Community Ecology Package. R csomag 2.2.0 verziója. Elérhető a következő címen: https://CRAN.R-project.org/package=vegan
Google Scholar
Oloo, F., Valverde, A., Quiroga, M. V., Vikram, S., Cowan, D., and Mataloni, G. (2016). Az élőhely heterogenitása és az összekapcsolhatóság alakítja a mikrobiális közösségeket a dél-amerikai tőzeglápokban. Sci. Rep. 6:25712. doi: 10.1038/srep25712
PubMed Abstract | CrossRef Full Text | Google Scholar
Pattnaik, P., Mishra, S. R., Bharati, K., Mohanty, S. R., Sethunathan, N., and Adhya, T. K. (2000). A sótartalom hatása a metanogenezisre és a kapcsolódó mikroflórára trópusi rizstalajokban. Microbiol. Res. 155, 215-220. doi: 10.1016/S0944-5013(00)80035-X
PubMed Abstract | CrossRef Full Text | Google Scholar
Poffenbarger, H. J., Needelman, B. A., and Megonigal, J. P. (2011). A sótartalom hatása az árapály mocsarak metánkibocsátására. Wetlands 31, 831-842. doi: 10.1007/s13157-011-0197-0
PubMed Abstract | CrossRef Full Text | Google Scholar
Potter, E. G., Bebout, B. M., and Kelley, C. A. (2009). A metán és a metanogén szubsztrátumok izotópos összetétele a sótartalom gradiens mentén egy hiperszalin mikrobiális szőnyegrendszerben. Astrobiology 9, 383-390. doi: 10.1089/ast.2008.0260
PubMed Abstract | CrossRef Full Text | Google Scholar
R Core Team (2014). R: A Language and Environment for Statistical Computing (3.0.3 verzió). Bécs: R Foundation for Statistical Computing.
Google Scholar
Roberts, D. (2016). labdsv: Ordination and Multivariate Analysis for Ecology. R Package Version 1.8-0. Elérhető: R Package Version 1.8-0. Available at: https://CRAN.R-project.org/package=labdsv
Google Scholar
Rooney-Varga, J. N., Giewat, M. W., Duddleston, K. N., Chanton, J. P., and Hines, M. E. (2007). Az archeális közösség szerkezete, a vegetáció típusa és a metanogén útvonal közötti kapcsolatok az alaszkai tőzeglápokban. FEMS Microbiol. Ecol. 60, 240-251. doi: 10.1111/j.1574-6941.2007.00278.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Rosenberg, E., DeLong, E. F., Lory, S., Stackebrandt, E., and Thompson, F. (2014). A prokarióták: A baktériumok és az archaea további fő vonalai. Berlin: Springer.
Google Scholar
Ruff, S. E., Biddle, J. F., Teske, A. P., Knittel, K., Boetius, A., and Ramette, A. (2015). A metánszivárgási mikrobiom globális szétszóródása és helyi diverzifikációja. Proc. Natl. Acad. Sci. U.S.A. 112, 4015-4020. doi: 10.1073/pnas.1421865112
PubMed Abstract | CrossRef Full Text | Google Scholar
Schauer, R., Bienhold, C., Ramette, A., and Harder, J. (2009). Bakteriális diverzitás és biogeográfia az Atlanti-óceán déli részének mélytengeri felszíni üledékeiben. ISME J. 4, 159-170. doi: 10.1038/ismej.2009.106
PubMed Abstract | CrossRef Full Text | Google Scholar
Schloss, P. D., Westcott, S. L., Ryabin, T., Hall, J. R., Hartmann, M., Hollister, E. B., et al. (2009). Introducing mothur: nyílt forráskódú, platformfüggetlen, közösség által támogatott szoftver mikrobiális közösségek leírására és összehasonlítására. Appl. Environ. Microbiol. 75, 7537-7541. doi: 10.1128/Aem.01541-09
PubMed Abstract | CrossRef Full Text | Google Scholar
Statham, P. J. (2012). Tápanyagok a torkolatokban – áttekintés és az éghajlatváltozás lehetséges hatásai. Sci. Total Environ. 434, 213-227. doi: 10.1016/j.scitotenv.2011.09.088
PubMed Abstract | CrossRef Full Text | Google Scholar
Thauer, R. K., Kaster, A.-K., Seedorf, H., Buckel, W., and Hedderich, R. (2008). Metanogén archaea: ökológiailag releváns különbségek az energiatakarékosságban. Nat. Rev. Microbiol. 6, 579-591. doi: 10.1038/Nrmicro1931
PubMed Abstract | CrossRef Full Text | Google Scholar
Tilman, D., Isbell, F., and Cowles, J. M. (2014). Biodiverzitás és az ökoszisztémák működése. Annu. Rev. Ecol. Evol. Syst. 45, 471-493. doi: 10.1146/annurev-ecolsys-120213-091917
CrossRef Full Text | Google Scholar
Ulrich, W., Hajdamowicz, I., Zalewski, M., Stañska, M., Ciurzycki, W., and Tykarski, P. (2010). Fajválaszték vagy élőhelyszűrés: a tószigeteken élő pókközösségek esettanulmánya. Ecol. Res. 25, 375-381. doi: 10.1007/s11284-009-0661-y
CrossRef Full Text | Google Scholar
Vanwonterghem, I., Evans, P. N., Parks, D. H., Jensen, P. D., Woodcroft, B. J., Hugenholtz, P., et al. (2016). Metilotróf metanogenezist fedeztek fel a Verstraetearchaeota archaeális törzsben. Nat. Microbiol. 1:16170. doi: 10.1038/nmicrobiol.2016.170
PubMed Abstract | CrossRef Full Text | Google Scholar
von Mering, C., Hugenholtz, P., Raes, J., Tringe, S. G., Doerks, T., Jensen, L. J., et al. (2007). Mikrobiális közösségek kvantitatív filogenetikai értékelése változatos környezetben. Science 315, 1126-1130. doi: 10.1126/science.1133420
PubMed Abstract | CrossRef Full Text | Google Scholar
Wagner, D., and Liebner, S. (2009). “Global warming and carbon dynamics in permafrost soils: methane production and oxidation,” in Permafrost Soils, ed. R. Margesin (Berlin: Springer), 219-236.
Google Scholar
Weiher, E., and Keddy, P. (2001). Ökológiai gyülekezési szabályok: Perspektívák, előrelépések, visszavonulások. Cambridge: Cambridge University Press.
Google Scholar
Whitaker, R. J., Grogan, D. W., and Taylor, J. W. (2003). Geographic barriers isolate endemic populations of hyperthermophilic archaea. Science 301, 976-978. doi: 10.1126/science.1086909
PubMed Abstract | CrossRef Full Text | Google Scholar
Wickham, H. (2009). ggplot2: Elegáns grafika az adatelemzéshez. New York, NY: Springer-Verlag. doi: 10.1007/978-0-387-98141-3
CrossRef Full Text | Google Scholar
Yang, J., Ma, L. A., Jiang, H., Wu, G., and Dong, H. (2016). A sótartalom alakítja a mikrobiális diverzitást és a közösségek szerkezetét a Qinghai-tibeti tavak felszíni üledékeiben. Sci. Rep. 6:25078. doi: 10.1038/srep25078
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, S., Liebner, S., Alawi, M., Ebenhöh, O., and Wagner, D. (2014). Taxonómiai adatbázis és cut-off érték az mcrA gén 454-es piroszekvenálási adatainak MOTHUR általi feldolgozásához. J. Microbiol. Methods 103, 3-5. doi: 10.1016/j.mimet.2014.05.006
PubMed Abstract | CrossRef Full Text | Google Scholar
Yang, S., Liebner, S., Winkel, M., Alawi, M., Horn, F., Dörfer, C., et al. (2017). Magas fekvésű permafroszt-érintett vizes élőhelyek metanogén magközösségeinek mélyreható elemzése. Soil Biol. Biochem. 111, 66-77. doi: 10.1016/j.soilbio.2017.03.007
CrossRef Full Text | Google Scholar
Ye, R. Z., Jin, Q. S., Bohannan, B., Keller, J. K., McAllister, S. A., and Bridgham, S. D. (2012). pH control over anaerobic carbon mineralization, the efficiency of methane production, and methanogenic pathways in peatlands across an ombrotrophic-minerotrophic gradient. Soil Biol. Biochem. 54, 36-47. doi: 10.1016/j.soilbio.2012.05.015
CrossRef Full Text | Google Scholar
Zinder, S. H. (1993). “A metanogének élettani ökológiája”, in Methanogenesis: Ecology, Physiology, Biochemistry & Genetics, szerk. J. G. Ferry (Boston, MA: Springer), 128-206.
Google Scholar
Zinger, L., Amaral-Zettler, L. A., Fuhrman, J. A., Horner-Devine, M. C., Huse, S. M., Welch, D. B. M., et al. (2011). A baktériumok béta-diverzitásának globális mintázatai a tengerfenék és a tengervíz ökoszisztémáiban. PLoS ONE 6:e24570. doi: 10.1371/journal.pone.0024570
PubMed Abstract | CrossRef Full Text | Google Scholar