Subatomi részecskék
Minden elem rendkívül apró anyagrészecskékből, úgynevezett atomokból áll. Az atomot úgy definiálhatjuk, mint egy elem legegyszerűbb részecskéjét, amely rendelkezik az adott elem kémiai tulajdonságaival. A kémiai tulajdonságok közé tartozik az elem fizikai állapota (gáz, folyadék vagy szilárd), az, hogy az elem milyen típusú kötéseket képes kialakítani, hogyan reagál más elemekkel stb. Ezért a szén elemet alkotó összes atomnak ugyanazok a kémiai tulajdonságai.
A fizikusoknak sikerült az atomokat több tucat különböző szubatomi részecskére szétrobbantaniuk, ezek közül azonban csak 3 stabil. Ezek a protonok, a neutronok és az elektronok. A protonok pozitív töltésű részecskék, tömegük van, és az atom közepén, vagyis az atommagban helyezkednek el. A neutronok töltés nélküliek, tömegük van, és szintén az atommagban helyezkednek el. A neutronok úgy kötődnek a protonokhoz, hogy segítenek stabilizálni az atommagot. A túl sok vagy túl kevés neutron olyan atommagot eredményezhet, amely instabil, és bomlással más elemeket képezhet. Ezeket az atomokat radioaktívnak nevezzük. Bár a neutron tömege valamivel nagyobb, mint a protoné, mindkettőnek 1 relatív tömeget (1 atomi tömegegység vagy amu) tudunk rendelni. A neutronok és a protonok alkotják az atomok tömegének majdnem teljes egészét. A harmadik stabil részecsketípus az elektron. Az elektronok negatív töltéssel rendelkeznek, de rendkívül kicsik, és tömegük csak 1/1850 részecske, mint a protonoké vagy a neutronoké. Olyan kicsik, hogy gyakorlati szempontból nem járulnak hozzá az atom tömegéhez. Az elektronok rendkívül nagy sebességgel mozognak az atommag körül, közel a fénysebességgel. Bár gyakran úgy írjuk le, hogy az elektronok az atommag körül keringenek, mint a bolygók a Nap körül, a modern fizika azt tanítja, hogy ez a modell helytelen. Ezek a “pályák” valójában az atommag körüli térben lévő területek, ahol az elektronok az idő nagy részében tartózkodnak. Ezt a területet gyakran nevezik elektron “felhőnek”. Igaz, ez még mindig egy meghatározott terület, de egy kicsit amorfabb, mint egy gömb alakú pálya. Az egyszerűség kedvéért azonban gyakran gondolunk rá úgy, mint műholdszerű körpályára. Az alábbi kép a nitrogénatom jelenlegi modelljét ábrázolja.
A nitrogénmag 7 protont (narancssárga) és 7 neutront (zöld) tartalmaz. Az atommag körüli árnyékolt területek az elektronpályákat (felhőket) jelentik. Az elektronok (kék) valahol ezeken a pályákon belül találhatók. (Megjegyzés: a kép nem méretarányos. Azt feltételezik, hogy ha az atommag akkora lenne, mint egy kosárlabda, az elektronok körülbelül hat kilométerre vagy 3¾ mérföldre lennének tőle!)
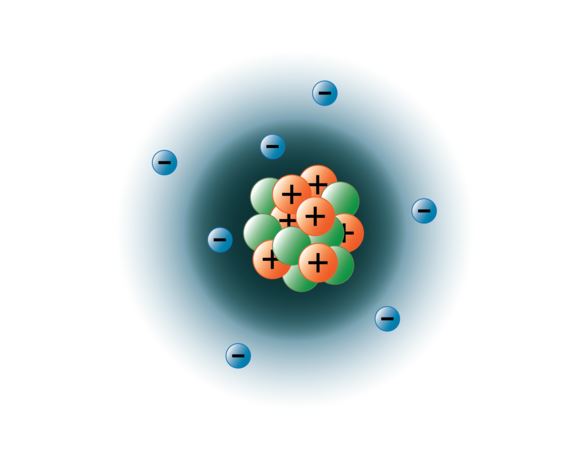
a képet Hannah Crowder BYU-I hallgató készítette 2013 ősze
Atommagszám
Nézd meg újra a periódusos rendszert, és figyeld meg a számot minden doboz tetején. Ez a szám az elem atomi száma, és minden egyes elemnél egyedi. Például a hidrogén atomszáma 1. Egyetlen más elem atomszáma sem 1. A szén atomszáma 6, és szintén egyetlen más elem atomszáma sem 6. Az atomszám jelentősége az, hogy megmondja, hány proton van az egyes elemek atommagjában. Ezért minden hidrogénatomnak 1 protonja van, és minden szénatomnak 6 protonja. Ezenkívül, mivel az atomok semleges töltéssel rendelkeznek, az atomszám az atomban lévő elektronok számát is megadja. A kémiai írásmódban az elem atomszámát az elem szimbólumát megelőző indexként fejezik ki. A szén például 6C.
Tömegszám (atomtömeg)
Az atom tömegszáma, ahogy a neve is mutatja, az atom teljes tömegét fejezi ki. Mivel az elektron tömege rendkívül kicsi (elhanyagolható), a tömegszám kiszámításánál nem használják fel. Emlékezzünk arra is, hogy minden egyes proton, valamint minden egyes neutron tömege 1 atomtömegegység. Ezért a tömegszám az atomban lévő protonok és neutronok összege. Mivel a tömegszám a protonok száma plusz a neutronok száma, az atomszám pedig a protonok száma, a neutronok számát úgy kaphatjuk meg, hogy egyszerűen kivonjuk az atomszámot a tömegszámból. Példaként tegyük fel, hogy van egy olyan elemünk, amelynek az atomszáma 8, tömegszáma pedig 17. Ebből az információból levonható, hogy ennek az elemnek 8 protonja, 8 elektronja és 9 neutronja van (17-8=9). Most hadd dobjak neked egy görbe labdát. Mint fentebb említettük, egy adott elem minden atomjának ugyanannyi protonja (atomszáma) van, azonban egy adott elem különböző atomjainak különböző számú neutronja lehet. Azt mondjuk, hogy ezek az elem különböző izotópjai. Például a hidrogénnek három izotópja van. A leggyakoribb izotóp, amely az összes hidrogénatom 99,98%-át teszi ki, tömegszáma 1. Tehát 1 protonból, neutronok nélkül és egy elektronból áll. A hidrogén másik, ritkábban előforduló izotópjainak tömegszáma 2, illetve 3. Ezek az izotópok az atommagjukban lévő neutronok számában különböznek, de mindháromnak egy protonja és egy elektronja van. A valóságban minden elemnek vannak a természetben előforduló izotópjai, amelyek mindegyike egyedi tömegszámmal rendelkezik. A kémiai írásmódban az adott izotóp tömegszámát az elem szimbóluma előtt egy felirat jelöli. A hidrogén három izotópját 1H, 2H és 3H formában fejezzük ki. Mivel minden elem több izotópból áll, felmerül a kérdés, hogy “mekkora az adott elem tényleges tömege”. Ha ismét megnézzük a fenti periódusos rendszert, észrevehetünk egy számot az egyes dobozok alján. Ez az elem atomtömege. Például a hidrogén atomtömege 1,00794 amu. Ezt a számot a hidrogén 3 izotópjának átlagos tömegének kiszámításával kaptuk. Tegyük fel például, hogy 10 fiú van az osztályunkban. Ha a fiúk átlagos tömegét szeretnénk megtudni, akkor összeadnánk az egyes fiúk tömegét, majd az eredményt elosztanánk 10-zel. Így megkapnánk az átlagos tömegüket. Lényegében így határozzák meg az atomsúlyokat. Mivel az 1H a hidrogén legnagyobb mennyiségben előforduló izotópja, logikus, hogy a hidrogén atomtömege nagyon közel van az 1H atomtömegéhez.
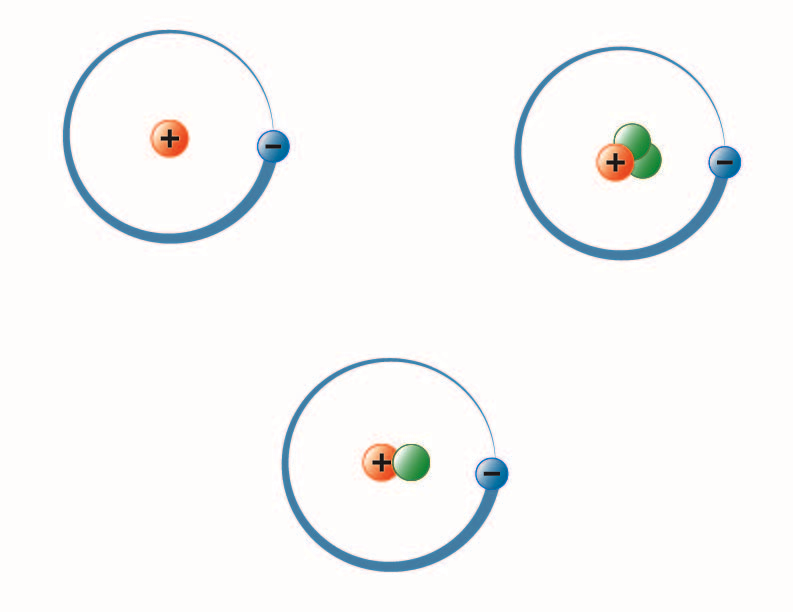
A BYU-I hallgatója, Hannah Crowder által készített kép 2013 ősze
A fenti képen a hidrogén három izotópja látható. A leggyakoribb (balra fent) atommagjában egy proton és egy neutron sincs. A deutériumnak (alul) egy protonja és egy neutronja van, a tríciumnak (jobb felső) pedig egy protonja és két neutronja.
**Az alábbi gombok segítségével a modul következő vagy előző olvasmányához léphetsz**

