Ez a fejezet olyan anyagokat mutat be, amelyek betekintést nyújtanak a hallgatóknak a vas és acél műszaki vizsgálatánál alkalmazott elemzési módszerekbe. E munka jellege nem teszi lehetővé a téma részletes tárgyalását – egy olyan tárgyalás, amely a következő anyagok közül egy vagy több anyag becslését igényelheti: – Szén (szabad és kombinált), kén, szilícium, foszfor, mangán, titán, réz, nikkel, kobalt, króm, alumínium, arzén, antimon, ón, volfrám, vanádium, nitrogén, vas. Általában a szén, a kén, a szilícium és a foszfor becslésére van a legnagyobb szükség. A többi említett elem és vegyület közül egy vagy több elem meghatározására van szükség a különleges acélok esetében. Az ezekkel a meghatározásokkal kapcsolatos információkért a hallgatót Crobaugh Chemical Analysis and Foundry Chemistry, by Crobaugh ; The. Chemical Analysis of Iron, by Blair ; “Carbon in Steel by Direct Combustion,” by Blount, in The Analyst, Jan. 1902; “Sulphur in Wrought Iron and Steel,” by Auchy, in the Jour. Amer. Chem. Soc., 1901. március, és más cikkek ugyanezen folyóiratokban. Az a hallgató, aki tovább szeretne menni, ha lehetséges, szerezzen hozzáférést Campbell, Drown és mások cikkeihez, amelyek időről időre megjelennek a különböző kémiai és kohászati folyóiratokban.
Mivel a hallgató ideje korlátozott, egyelőre elhalaszthatja a szilícium és a foszfor becslését, bár ezeket mind a kohász, mind az öntöde számára fontosságuk miatt megadjuk.
Annak érdekében, hogy a hallgató alaposabban átlássa a témát, nem lesz helytelen néhány megjegyzés a vizsgált anyagok összetételéről és tulajdonságairól. Ami a különböző elemek acélra gyakorolt hatását illeti, lásd H. H. Campbell The Manufacture and Properties of Structural Steel című művét.
A szén háromféle állapotban létezik a vasban – grafitos, oldott és kombinált állapotban. Ezeken kívül a mikroszkóp segítségével más formákat is azonosítottak.
A kén a vasban főként FeS szulfidként létezik, amely oldódik az olvadt vasban.
A foszfor a vas foszfidjaként létezik, amely teljesen oldódik az olvadt vasban.
A szilícium a vas szilicidjét alkotja, amely szintén oldódik az olvadt vasban.
A négy elem közül tehát a szén az egyetlen, amely szabad állapotban is létezhet. A különböző jelenlévő elemek arányának eltérései szinte végtelenek, de a következő rövid táblázat megadja a nyersvas, a kovácsoltvas és az acél hozzávetőleges összetételét, bár ezek mindegyike jelentős eltéréseknek van kitéve.
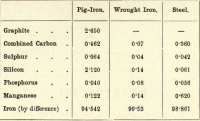
A tanulónak a következőket kell megbecsülnie:-
(1) Szén,
(a) Összes.
(b) Grafitos.
(c) Kombinált.
(2) Kén.
(3) Szilícium. (Ha az idő engedi.)
(4) Foszfor. (Ha az idő engedi.)
SZÉN Összesen
Ezzel a becsléssel a szén CO2-vé alakul át, amelyet a káliumlúg felszív. Az így kapott CO2 tömegéből számítják ki a szenet.
Előre úgy tűnik, hogy a legegyszerűbb eljárás az lenne, ha a vas- vagy acélfúrásokat közvetlenül oxigénáramban gyújtanánk meg, és az így keletkezett CO2-t KHO-ban nyelnénk el. Sajnos ez a módszer eddig vagy pontatlannak bizonyult, vagy ahol teljes égést értek el, ott a magas hőmérséklet elviseléséhez szükséges készülék vagy a kezelés egyéb ingadozásai nem voltak alkalmasak a műszaki munkára (lásd Blount cikkeit a The Analyst-ban). A tanuló meg fogja tapasztalni, hogy az itt megadott módszer technikai szempontból a kényelem és a gyorsaság szempontjából korántsem ideális, és valószínűnek tűnik, hogy a közeljövőben felváltja valamilyen gyorsabb közvetlen oxidációs módszer.
Az elfogadott módszer.-A témával foglalkozó számos munkára hivatkozva a módszerek nagy változatosságát találjuk. Az itt megadott módszer szokásos gondossággal pontos eredményeket fog adni. Röviden a következő:-
A vasat kálium és réz kettős kloridjának HCl-lel savassá tett oldatában oldjuk fel. A fémréz kicsapódik és újra feloldódik; a vas feloldódik, a szén szuszpenzióban marad. Ezután összegyűjtjük és az égetőkemencében oxigénnel meggyújtjuk, majd a keletkezett CO2-t megmérjük.
A vas oldása.-Mérjünk ki 1 gramm nyersvasfuratot. Tegyük át egy 300 köbcentis főzőpohárba. Adjunk hozzá 100 c.cs. CuCl2,2KCl,2H2O oldatot, amelyet a következőképpen készítünk. Oldjunk fel vízben 149,1 rész KCl-t és 170,3 rész kristályosított CuCl2,2H2O-t. Pároljuk be és kristályosítsuk ki a kettős kloridot. Oldjunk fel 300 g kettős sót desztillált vízben. Szűrjük át gyújtott azbeszten, és üvegdugós üvegekben tartósítsuk.
A főzőpohár tartalmához adjunk 7 cs.cs. HCl-t, hogy az oldat savas legyen. Keverjük meg időközönként, amíg a vas oldódása meg nem történik. Helyezzük a főzőpoharat és tartalmát az oldat vége felé vízfürdőre, kb. 60 °C-os hőmérsékletre. A következő reakciók játszódnak le-Fe + CuCl2 = FeCl2 + Cu és Cu + CuCl2 = 2CuCl. A KCl egyszerűen segíti a kicsapódott réz oldódását. A kettős kloridok hozzáadásától számított kb. 40 perc múlva az oldódásnak majdnem teljesnek kell lennie, és a réz nagy részének fel kell oldódnia. Mossuk le a főzőpohár oldalát egy kevés savasított kettős kloriddal. Az oldathoz adjunk egy kevés meggyújtott azbesztet, hogy a széntartalmú anyag leülepedjen és megakadályozza, hogy eltömítse a szűrőt (Barba ajánlása szerint).
A szűréshez nagyon kényelmesek a Gooch-tégely elvén felszerelt speciális platinacsónakok. A tanuló azonban a széntartalmú anyagot mesterséges szívással segített Gooch-tégely segítségével is leszűrheti, a széntartalmú anyagot egy vízsugárral bemosva, miután a folyadék áthaladt a szűrőn. A szűrőn lévő szenet óvatosan mossuk át forró vízzel. Szárítsuk meg a tégelyt és
tartalmát légkemencében 100 C-on. A széntartalmú anyag most már készen áll a gyújtásra.
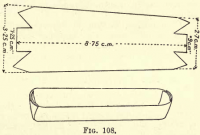
A szén oxidációja.
Készítsünk egy platinacsónakot úgy, hogy egy darab platinafóliát a 108. ábra szerint levágunk, az oldalát és a végeit felhajtjuk, hogy vályút képezzen. A széntartalmú anyagokat és az azbesztet a Goochból a csónakba kell átvinni.
Az égetőkemencét, a tartozékokat és a szerelvényeket rendbe kell tenni. Ismét az oxigéntisztító készüléket kell használni, de ezúttal háromutas csővel ellátva, a tároló és a tisztítók közé helyezett csapokkal. Ez lehetővé teszi, hogy a készülékben áramló levegőt átszívják. Az égetőcső lehet kemény jénai üvegből, porcelánból vagy platinából. A kemence és a káliumhagymák között két U-csövet használnak. Az első csőnek a kemencéhez legközelebbi végága vízmentes CuSO4-et, a másik végága vízmentes CuCl-t tartalmaz. A második U-cső szárított CaCl2-t tartalmaz. Ez a két cső alkotja a “tisztító vonatot”. A CuCl minden Cl-t, a többi anyag pedig minden H2O-t elnyel. Ez a készlet sok meghatározásra szolgál. Ezt követik a káliumhagymák és a védőcsövek, és szükség esetén legyen kéznél egy aspirátor, amely a készülékben levő levegő áramlását biztosítja. A káliumhagymákat 8E-vel töltjük fel. KHO-val, az őrcsövet pedig CaCl2-vel töltjük. Próbáljuk ki a kemencét és az izzókat a korábban leírtak szerint (lásd Szén és koksz), a csövet a vázlat szerint töltjük fel, a csónakot egyelőre a 100 °C-os légkemencében tartjuk.
Amikor minden készen áll, az égőket egy időre kikapcsoljuk, a csónakot és tartalmát behelyezzük. Az égőket az elülső végükről gyújtják meg, fokozatosan visszafelé dolgoznak, és lassú oxigénáramot, körülbelül két buborékot másodpercenként, miután előzőleg bekapcsolták, amíg a cső meg nem telik oxigénnel. Szabályozzuk a hőmérsékletet, amíg a csónak tompa vörös színt nem kap, és ha az égőkben lévő oldat a kemencébe való visszafolyás jeleit mutatja, növeljük az oxigénáramot másodpercenként három-négy buborékra.
A csónak behelyezésétől számítva körülbelül ötven perc elegendő a teljes égéshez. Kapcsoljuk ki az oxigént, és tíz percig engedjük át a levegő áramát.
A káliumhagymákat és az őrcsövet most kivesszük és megmérjük, a szenet pedig a szokásos módon kiszámítjuk.
(b) Grafitos szén -A vasat egyesek HCl-ben, mások HNO3-ban oldják fel, amikor a grafitos szén maradványként megmarad. Nyersvas esetében óvatossággal mindkét módszer jó eredményt ad, de grafittartalmú acélok esetében Blair a salétromsavas oldást ajánlja. (Ehhez a módszerhez forduljon Blairhez.)
Mérjen ki 5 g nyersvasfúrást. Oldjuk fel 50 c.cs. SE. HCl-ben enyhe hő segítségével. Forraljuk néhány percig. Hígítsuk 100 c.cs. (majdnem). Szűrjük át egy Gooch-tégelyen. Forró vízzel, majd forró E. KHO-val jól mossuk át. (Ez feloldja az esetleges SiO2-t.) A KHO eltávolításához mossuk újra forró vízzel. Szárítsuk meg a tégelyt és tartalmát.
A szénmennyiséget az előzőekhez hasonlóan égetéssel határozzuk meg, és a szokásos módon számítsuk ki a százalékot.
(c) Kombinált szén (különbséggel).- Mivel az összes szén és a grafitos szén ismert, az összesített szenet úgy kapjuk meg, hogy az összes szénből kivonjuk a grafitosat.
A becslés közvetlen módszereiért tekintse meg az említett hatóságokat.
A KÉN MEGHATÁROZÁSA VASBAN & ACÉLBAN
A vasban és acélban lévő kén becslésének legjobb módszerét illetően jelentős véleménykülönbségek vannak. A régi királyi vizes oldat és a BaCl2 kicsapatás módszere elismerten nagyon pontatlan; de a lassú oldás HNO3-ban, nagyon kevés vagy egyáltalán nincs jelen HCl, majd gondos kicsapatás BaCl2-vel, meghatározott mennyiségű HCl jelenlétében és a kicsapás idejére és körülményeire vonatkozó kellő gondossággal, valamint a csapadék vas általi szennyeződése elleni óvintézkedésekkel – ezekkel és gondossággal jó eredményeket lehet elérni. Blair ezzel szemben a HCl-ben való oldást ajánlja, az S H2S-ként fejlődik ki, amelyet a Pb(NO3)2 (lúgos) oldata felszív, PbS-t képezve, amelyet HCl + KClO3-ban oldanak fel, és az S BaSO4-ként csapódik ki. További módszereket lásd Blair, Stillman, Auchy, Crobaugh és Drown. Egy másik általánosan használt módszer az S H2S-ként való fejlődése, majd kadmium-klorid-oldatban történő abszorpciója. A kicsapódott kadmium-szulfidot HCl-ben feloldják, és az S-t jódoldattal történő titrálással becsülik meg, vagy még gyakoribb, hogy a H2S-t Br. vízben abszorbeálják, majd BaSO4-ként kicsapódik, vagy NaOH-ban abszorbeálják és jóddal titrálják; ez utóbbi a legkedveltebb módszer. (Lásd Blair.) Itt a következő módszert adjuk meg:-
Oxidálás HNO3-mal (az ún. Aqua Regia módszer). 5 gramm bórát mérjünk ki, és tegyük át egy mély, 200 cm3-es főzőpohárba. Óvatosan adjunk hozzá kb. 40 c.cs. 16E. HNO3-t, egyszerre kb. 10 c.cs. adagokban, a főzőpoharat egy nagy óraüveggel lefedve, és ügyelve arra, hogy a művelet ne legyen túl heves. Amikor a hatás látszólag megszűnik, figyeljük meg, hogy minden részecske feloldódott-e (kivéve a szenet). Ha nem, akkor melegítsük fel a homokfürdőn, és adjunk hozzá 3-4 csepp 16E-t. HCl-t, és melegítsük, amíg fel nem oldódik.
Ha az oldat teljes, adjunk hozzá egy kevés Na2CO3-t, hogy az esetleges H2SO4-ot Na2SO4-vá alakítsuk át, amely párolgáskor nem illékony.
Vegyük le a homokfürdőről, és adjunk hozzá 5 cs. erős HCl-t a szükségesnél nagyobb mennyiségben, hogy a Na2CO3 által kicsapódott vasvegyületek éppen feloldódjanak. Szűrjük le a SiO2-t, és C. Mossuk ki jól. A SiO2 oldhatatlanná tételéhez pároljuk szárazra. Vegyük fel HCl-lel, és párologtassuk, amíg a Fe2Cl6 elkezd kikristályosodni. Ezután adjunk hozzá 5 cs. HCl-t, és szűrjük le, ha maradvány van benne. (Ha nincs, akkor nem volt SiO2 az oldatban, és a bepárlást el lehetett volna hagyni). Szűrjük le és mossuk ki óvatosan a csapadékot a Goochban, a folyadékot és a mosószert kb. 100 c.cs.
Felforraljuk. Adjunk hozzá 10 c.cs. telített BaCl2 oldatot. Forraljuk 30 percig. Hagyjuk állni egy éjszakán át. Szűrjük át egy Goochon. Mossuk ki kevés E. HCl-lel, majd vízzel. Szárítsuk meg, gyújtsuk meg, és a szokásos módon mérjük meg a BaSO4-ot, amelynek fehérnek kell lennie, és nem szabad vastartalmú sókkal szennyezettnek lennie.
Az S százalékos arányát a szokásos módon számítsuk ki. Mivel a felhasznált reagensek némelyike tartalmazhat ként, a tényleges elemzéssel azonos mennyiséget használva vakpróbát kell végezni, és a talált ként le kell vonni az előző eredményből.
SILICON KIVÁLASZTÁSA
Az itt megadott módszer Drown módszere, amely gyors és pontos. A vasat HNO3-ban, majd H2SO4-ban oldjuk fel, és szárazra pároljuk. Ezt követi az oldás, a szilíciumot a maradékban SiO2-ként hagyva.
Fontos részletek: – Mérjünk ki 2 g gramm fúrást, és tegyük át egy platina- vagy porcelánedénybe. Adjunk hozzá 30 c.cs. 8E. HNO3 Amikor a hatás látszólag megszűnik, adjunk hozzá 20 c.cs. 18E. H2SO4-ot, és pároljuk be. (Blair azt ajánlja, hogy a folyadék felszínén finoman játsszon a forró levegő. A levegőt úgy melegítjük fel, hogy egy bunsen fölött felmelegített kis rézcső spirálján vezetjük át. Így a párolgás felgyorsul, a pezsgés pedig megakadályozható). Folytassuk a párologtatást, amíg bőséges SO3-gőzök nem távoznak. Hűtsük le, és óvatosan hígítsuk desztillált vízzel 130 c.cs-re. Melegítsük, amíg az összes FeSO4 fel nem oldódik. Szűrjük le, és mossuk át először egy kis E. HCl-lel, majd forró vízzel. Ezt a szűrést a legjobb egy 7 cm-es hamumentes szűrőpapírral végezni (a hamut két vagy három papír meggyújtásával ellenőrizzük). Szárítsuk meg; tegyük át egy platina tégelybe; a szokásos módon gyújtsuk meg és mérjük meg. A tégelyhez adjunk 5 cs. erős H2SO4-ot és 5 cs. erős HF-ot. Óvatosan pároljuk szárazra, a párolgás meggyorsítása érdekében használjunk forró levegőt. Gyújtsuk meg, és ismét mérjük meg. Amennyiben a H2SO4 és a HF tiszta, a súlykülönbség a SiO2-t jelenti. Ellenőrizzük a H2SO4 és a HF (különösen az utóbbit) egy vaktöltény elpárologtatásával. Minden talált maradékot figyelembe kell venni.
FOSZFOR KÉPZÉSE
Itt is számos módszert adnak meg a különböző hatóságok, amelyek többsége pontos eredményt ad, ha gondosan követjük őket. A műszaki elemzésre legmegfelelőbb két módszer a Nemzetközi Acélszabványügyi Bizottság (USA) albizottsága (Barba, Blair, Drown, Dudley és Shimer urak) által kidolgozott volumetrikus redukciós módszer, valamint a Dudley és Pease urak által megadott módosított redukciós módszer, Jour. Anal. Appl. Chem., vii. 108. Az előbbi módszert a Blair’s Analysis of Iron című könyvben részletesen tárgyalja; az utóbbi módszert itt közöljük.
A vasat feloldjuk, és a P-t ammónium-foszfo-molibdát formájában kicsapjuk. Ezt feloldjuk, és Zn és H2SO4 hatására a MoO3 redukálódik, majd a redukált folyadékot K2Mn2O8-cal (standard oldat) titráljuk, és a felhasznált c.cs. számából kiszámítható a P-tartalom.
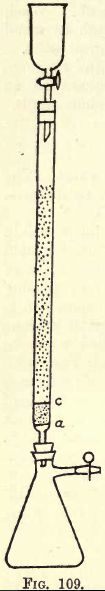
Details. -Ahol sok munkát kell végezni, ott rázó készülékre van szükség (lásd a Vegyszerellátási katalógusokat). A tanuló azonban a szükséges rázást kézzel is elvégezheti. Az analízis megkezdése előtt elő kell készíteni a redukáló készüléket (a Jones reduktor módosítását) (lásd a 109. ábrát).
Az a ponton egy finom perforált, erős platinafóliából készült korong található. A és c között kb. ¾ inch tiszta fehér homok van, c egy másik perforált platina korong.
A korong fölött a csövet finom szemcsés amalgámcinkkel töltjük meg, amelyet így állítunk elő: – Oldjunk fel 5 gms. Hg-t 25 c.cs. erős HNO3-ban, vízzel hígítva és az oldatot 1 literre felhígítva. Ebbe az oldatba
öntsünk fél kilogramm granulált cinket, amely átmegy a 20-as, de nem a 30-as szitán. Rázzuk egy-két percig. Öntsük le az oldatot. Mossuk és szárítsuk meg a cinket, amely most már amalgámosodott. A tölcsért és a lombikot az ábrán látható módon szereljük a készülékre.
Készítsük elő a következő reagenseket :-
(a) A K2Mn2O8 erős oxidáló oldata. 12 gramm tiszta K2Mn2O8 1 liter vízben. Szűrjük le és palackozzuk.
(b) A molibdátoldat.- Oldjunk fel 50 gms. MoO3 200 köbcenti NH4HO-ban (S.G. .96). Szűrjük le, és a szűrlethez adjunk 500 c.cs. HNO3 (S.G. 1,2). Használat előtt legalább 24 órát hagyjuk állni.
c) A savas amnwnium-szulfát oldat.- 500 c.cs. desztillált vízhez adjunk 27,5 c.cs. NH4HO-t (S.G. 0,96), majd 24 c.cs. tiszta H2SO4-ot (S.G. 1,84), és hígítsuk 1000 c.cs-re.
(d) A standard K2Mn2O8 oldat.- Oldjunk fel 2 g kristályos K2Mn2O8-t 1000 c.cs desztillált vízben. Standardizáljuk az oldatot a következőképpen : Mérjünk ki 3 tételt, egyenként 0,1 és 0,3 g közötti mennyiséget alaposan megtisztított vashuzalból, amelynek vastartalma ismert. Tegyük át 100 c.c. Erlenmeyer-lombikba, és adjunk mindegyikhez 40 c.cs. 8E. H2SO4-OT. Ha feloldódott, forraljuk 5 percig ; hígítsuk 150 c.cs.-re, majd engedjük át a reduktoron és mossuk át, hogy a térfogat 200 c.cs.-re emelkedjen, az analízisben leírtak szerint. Titráljuk az egyes tételeket K2Mn2O8 -kal. Az eredményeknek a fémes vas tekintetében 1/100 milligramm pontossággal meg kell egyezniük. Tegyük meg a szükséges engedményt a vett drótban lévő szennyeződésekre. Tegyük fel, hogy 1 köbcenti K2Mn2O8 = 0,0034923 g Fe, majd szorozzuk meg ezt az értéket Fe-ben a MoO3 és Fe arányával, azaz 0,9076, és a terméket a P
jelenlévő és a MoO3 arányával, azaz 0,019, és megkapjuk:
1 köbcenti K2Mn2O8 = 0,0000602 g Fe. P
Analízis
Mérjük ki az 1 gm-es fúrásokat. Töltsük át egy 200 köbcentis Erlenmeyer-lombikba. Adjunk hozzá 70 c.cs. 5E. HNO3. Amikor az oldat teljes, forraljuk egy percig, és adjunk hozzá 10 c.cs. K2Mn2O8 “oxidáló” oldatot. Addig forraljuk, amíg a rózsaszínű szín el nem tűnik, és a MnO2 el nem válik. Vegyük ki, és keverés közben fokozatosan adjuk hozzá a tiszta (foszformentes) FeSO4 kristályait, amíg a tartalom ki nem tisztul. Melegítsük az oldatot 80 °C-ra (As jelenléte esetén 35 °C-ra). Adjunk hozzá 75 köbcenti molibdátoldatot 27° C-on. Zárjuk le a lombikot gumidugóval, és rázzuk 5 percig. Hagyjuk állni 5 percig. Ezután szűrjük át egy 9 cm-es szűrőn, szűrjük le, és mossuk ki a savas amm. szulfát oldattal, amíg néhány csepp mosás után ammónium-szulfiddal nem kapunk színt.
A csapadékot a papíron oldjuk fel 5 c.cs. NH4HO (S.G. 0,90) és 25 c.cs. vízzel, visszaengedve az oldatot az eredeti lombikba, így oldva fel az oldalára tapadt csapadékot. Mossuk, amíg a szűrlet és a mosófolyadék mennyisége 150 cs. Adjunk hozzá 10 cs. erős H2SO4-ot (S.G. 1,84), és hígítsuk 200 cs.-ra. Az oldat most már készen áll a redukcióra.
Töltsünk 100 cs. meleg ~E/2 H2SO4-ot a tölcsérbe. Csatlakoztassuk a lombikot a szűrőszivattyúhoz, és nyissuk ki a bilincset, hogy az oldat majdnem, de nem teljesen kifolyjon a tölcsérből. Ezután a tölcsérhez adjuk hozzá a következő üres-5 c.cs. NH4HO (S.G. 0,90), 10 c.cs. H2SO4 (S.G. 1,84) és 50 c.cs. vizet, összekeverve. Ismét nyissuk ki a bilincset, hogy ez a keverék szinte kifusson a tölcsérből. Most adjunk a tölcsérbe 200 c.cs, E/2 H2SO4-ot, és majdnem fusson át rajta.
Vegyük ki a lombikot, először zárjuk el a csapot a tölcséren. Titráljuk a lombik tartalmát K2Mn2O8-al. Általában kb. 0,1 c.cs. permanganát fogy el így, és ezt a mennyiséget le kell vonni a későbbi leolvasásokból.
Most a redukálandó oldatot a tölcsérbe öntjük. Tegyünk rá egy tiszta lombikot. Csatlakoztassuk és indítsuk el a szűrőszivattyút. Nyissa ki a csapot és a szorítót, hogy szinte átfolyjon az oldat. Mossuk ki az oldatot tartalmazó lombikot 100 c.cs. E/2 H2SO4-GYEL. Adjuk ezt a tölcsérbe, és kezeljük az előzőek szerint.
Végül adjunk hozzá és majdnem futtassunk át újabb 100 cs. savat.
A szűrőlombikban lévő redukált oldatnak most már élénkzöldnek kell lennie.
Vegyük ki az előzőek szerint, és titráljuk a permanganátoldattal. A zöld rózsaszínes barnává, majd rózsaszínes sárgává, majd színtelenné változik, végül tartós rózsaszínt kapunk (egy perc állás után). A kapott leolvasásból vonjuk le a vakértéket, és a fenti adatokból számítsuk ki a jelen lévő P százalékos arányát.
Ez a volumetrikus módszer helyett egyes vegyészek a sárga foszfo-molibdát csapadék közvetlen mérését részesítik előnyben. A részleteket lásd Blair’s Analysis of Iron, 108. o.
Megjegyzés: A tanulónak, ahol csak lehet, ki kell használnia a speciális szaktekintélyekre való hivatkozásokat. Ekkorra már képesnek kell lennie az ilyen anyagok megismerésére, összehasonlítására és bizonyos mértékig megfontolt felhasználására. Egyetlen tankönyv sem képes a “Vas és acél”, vagy az ebben a fejezetben tárgyalt témák bármelyikének amúgy is átfogó feldolgozását adni; ezért a megadott hivatkozásokat, valamint az aktuális szakirodalmat gondosan át kell tanulmányoznia annak az elemzőnek, aki a műszaki munkában ki akar tűnni. A kombinált szén kolorimetriás meghatározását az Eggertz-módszerrel adtuk meg ; a mangán némileg hasonlóan meghatározható a Peter-féle kolorimetriás módszerrel vagy az acetát módszerrel (lásd Blair stb.).