Energie di ionizzazione degli elementi del blocco s e p
Le energie di ionizzazione degli elementi della terza fila della tavola periodica mostrano lo stesso schema di quelle di \Li\ e \Be\ (Tabella \PageIndex{2}): le energie di ionizzazione successive aumentano costantemente man mano che gli elettroni vengono rimossi dagli orbitali di valenza (3s o 3p, in questo caso), seguite da un aumento particolarmente grande dell’energia di ionizzazione quando gli elettroni vengono rimossi dai livelli di nucleo pieni, come indicato dalla linea diagonale in grassetto nella tabella \(\PageIndex{2}\). Così, nella terza riga della tavola periodica, il più grande aumento di energia di ionizzazione corrisponde alla rimozione del quarto elettrone da \ Al\, il quinto elettrone da Si, e così via – cioè, la rimozione di un elettrone da uno ione che ha la configurazione elettronica di valenza del gas nobile precedente. Questo schema spiega perché la chimica degli elementi normalmente coinvolge solo gli elettroni di valenza. Troppa energia è richiesta per rimuovere o condividere gli elettroni interni.
| Elemento | \(I_1\) | \(I_2\) | \(I_3\) | \(I_4\) | \(I_5\) | \(I_6\) | \(I_7\) |
|---|---|---|---|---|---|---|---|
| *elettrone di guscio interno | |||||||
| Na | 495.8 | 4562.4* | – | – | – | – | – |
| Mg | 737.7 | 1450.7 | 7732.7 | – | – | – | – |
| Al | 577.4.4 | 1816.7 | 2744.8 | 11.577.4.4 | – | – | – |
| Si | 786.5 | 1577.1 | 3231.6 | 4355.5 | 16.090.6 | – | – |
| P | 1011.8 | 1907.4.4 | 2914.1 | 4963.6 | 6274.0 | 21,267.4.3 | – |
| S | 999.6 | 2251.8 | 3357 | 4556.2 | 7004.3 | 8495.8 | 27,107.4.3 |
| Cl | 1251.2 | 2297.7 | 3822 | 5158.6 | 6540 | 9362 | 11.018.2 |
| Ar | 1520.6 | 2665.9 | 3931 | 5771 | 7238 | 8781.0 | 11,995.3 |
Example \(\PageIndex{1}}): Highest Fourth Ionization Energy
Dalla loro posizione nella tavola periodica, prevedere quale di questi elementi ha la quarta energia di ionizzazione più alta: B, C, o N.
Dati: tre elementi
Chiesto: elemento con la quarta energia di ionizzazione più alta
Strategia:
- Elenca la configurazione elettronica di ogni elemento.
- Determina se gli elettroni vengono rimossi da un guscio di valenza pieno o parzialmente pieno. Prevedere quale elemento ha la quarta energia di ionizzazione più alta, riconoscendo che l’energia più alta corrisponde alla rimozione di elettroni da un nucleo elettronico pieno.
Soluzione:
A Questi elementi si trovano tutti nella seconda fila della tavola periodica e hanno le seguenti configurazioni elettroniche:
- B: 2s22p1
- C: 2s22p2
- N: 2s22p3
B La quarta energia di ionizzazione di un elemento (\(I_4\)) è definita come l’energia richiesta per rimuovere il quarto elettrone:
\
Perché il carbonio e l’azoto hanno rispettivamente quattro e cinque elettroni di valenza, le loro energie di quarta ionizzazione corrispondono alla rimozione di un elettrone da un guscio di valenza parzialmente pieno. La quarta energia di ionizzazione per il boro, invece, corrisponde alla rimozione di un elettrone dal sottoguscio 1s2 pieno. Questo dovrebbe richiedere molta più energia. I valori reali sono i seguenti: B, 25.026 kJ/mol; C, 6223 kJ/mol; e N, 7475 kJ/mol.
Esercizio \(\PageIndex{1}): Lowest Second Ionization Energy
Dalla loro posizione nella tavola periodica, prevedere quale di questi elementi ha la più bassa energia di seconda ionizzazione: Sr, Rb, o Ar.
Risposta
\(\ce{Sr})
La prima colonna di dati nella tabella \(\PageIndex{2}\ mostra che le energie di prima ionizzazione tendono ad aumentare lungo la terza riga della tavola periodica. Questo perché gli elettroni di valenza non si schermano a vicenda molto bene, permettendo alla carica nucleare effettiva di aumentare costantemente lungo la fila. Gli elettroni di valenza sono quindi attratti più fortemente dal nucleo, quindi le dimensioni atomiche diminuiscono e le energie di ionizzazione aumentano. Questi effetti rappresentano due lati della stessa medaglia: interazioni elettrostatiche più forti tra gli elettroni e il nucleo aumentano ulteriormente l’energia richiesta per rimuovere gli elettroni.
Tuttavia, la prima energia di ionizzazione diminuisce in Al (3s23p1) e in S (3s23p4). Le configurazioni elettroniche di queste “eccezioni” forniscono la risposta al perché. Gli elettroni nel sottoguscio 3s2 pieno dell’alluminio sono più bravi a schermare l’elettrone 3p1 che a schermarsi a vicenda dalla carica nucleare, così gli elettroni s penetrano più vicino al nucleo di quanto faccia l’elettrone p e l’elettrone p viene rimosso più facilmente. La diminuzione a S avviene perché i due elettroni nello stesso orbitale p si respingono a vicenda. Questo rende l’atomo S leggermente meno stabile di quanto ci si aspetterebbe altrimenti, come è vero per tutti gli elementi del gruppo 16.
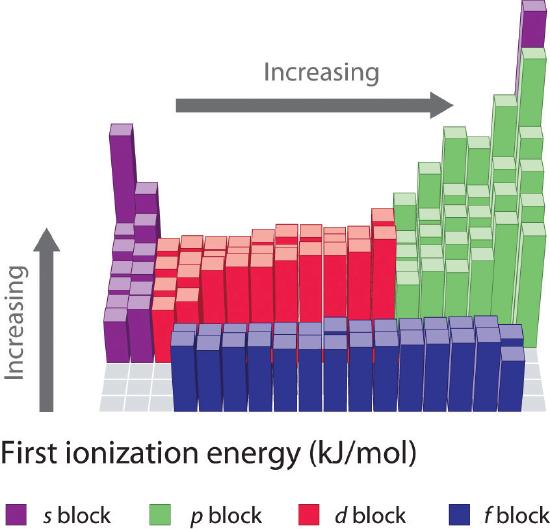
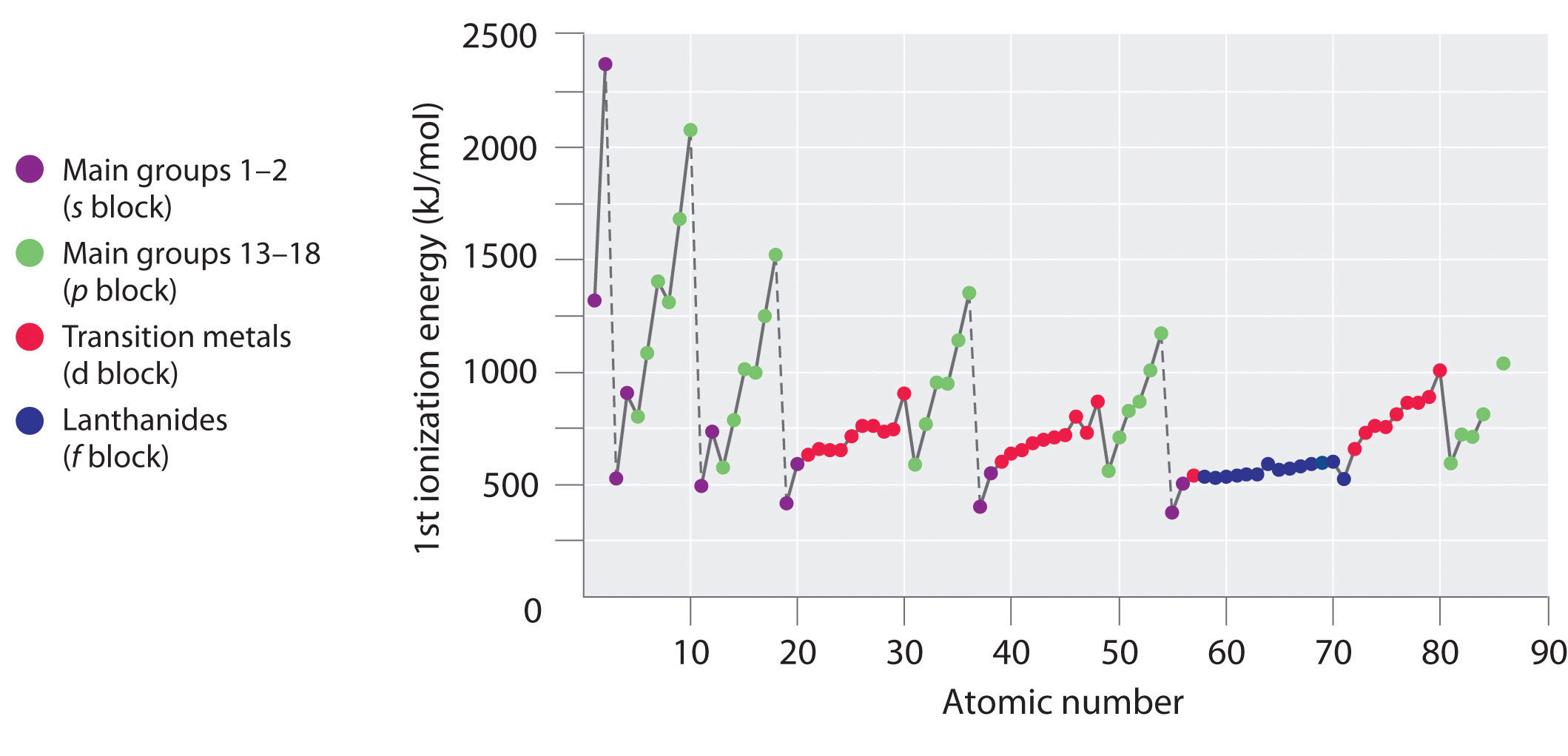
Le energie di prima ionizzazione degli elementi nelle prime sei righe della tavola periodica sono tracciate nella figura (\PageIndex{1}) e sono presentate numericamente e graficamente nella figura (\PageIndex{2}). Queste figure illustrano tre importanti tendenze:
- I cambiamenti visti nella seconda (Li a Ne), quarta (K a Kr), quinta (Rb a Xe), e sesta (Cs a Rn) riga dei blocchi s e p seguono un modello simile a quello descritto per la terza riga della tavola periodica. I metalli di transizione sono inclusi nella quarta, quinta e sesta fila, tuttavia, e i lantanidi sono inclusi nella sesta fila. Le prime energie di ionizzazione dei metalli di transizione sono in qualche modo simili tra loro, così come quelle dei lantanidi. Le energie di ionizzazione aumentano da sinistra a destra attraverso ogni riga, con discrepanze che si verificano a ns2np1 (gruppo 13), ns2np4 (gruppo 16), e ns2(n – 1)d10 (gruppo 12).
- Le energie di prima ionizzazione generalmente diminuiscono lungo una colonna. Anche se il numero quantico principale n aumenta lungo una colonna, i gusci interni riempiti sono efficaci per schermare gli elettroni di valenza, quindi c’è un aumento relativamente piccolo della carica nucleare effettiva. Di conseguenza, gli atomi diventano più grandi man mano che acquistano elettroni. Gli elettroni di valenza che sono più lontani dal nucleo sono meno legati, il che li rende più facili da rimuovere, il che fa diminuire le energie di ionizzazione. Un raggio più grande corrisponde tipicamente ad un’energia di ionizzazione più bassa.
- A causa delle prime due tendenze, gli elementi che formano ioni positivi più facilmente (hanno le energie di ionizzazione più basse) si trovano nell’angolo inferiore sinistro della tavola periodica, mentre quelli che sono più difficili da ionizzare si trovano nell’angolo superiore destro della tavola periodica. Di conseguenza, le energie di ionizzazione generalmente aumentano diagonalmente dal basso a sinistra (Cs) all’alto a destra (He).

Generalmente, \(I_1\) aumenta diagonalmente dalla sinistra inferiore della tavola periodica alla destra superiore.
Il gallio (Ga), che è il primo elemento dopo la prima fila di metalli di transizione, ha la seguente configurazione elettronica: 4s23d104p1. La sua prima energia di ionizzazione è significativamente più bassa di quella dell’elemento immediatamente precedente, lo zinco, perché il sottoguscio 3d10 pieno del gallio si trova all’interno del sottoguscio 4p, schermando il singolo elettrone 4p dal nucleo. Gli esperimenti hanno rivelato qualcosa di ancora più interessante: il secondo e il terzo elettrone che vengono rimossi quando il gallio viene ionizzato provengono dall’orbitale 4s2, non dal sottoguscio 3d10. La chimica del gallio è dominata dallo ione Ga3+ risultante, con la sua configurazione elettronica 3d10. Questa e altre configurazioni elettroniche simili sono particolarmente stabili e si incontrano spesso negli elementi del blocco p più pesanti. Sono a volte indicati come configurazioni pseudo gas nobili. Infatti, per gli elementi che esibiscono queste configurazioni, non sono noti composti chimici in cui gli elettroni vengono rimossi dal sottoguscio riempito (n – 1)d10.