Particelle subatomiche
Tutti gli elementi sono composti da particelle di materia estremamente piccole chiamate atomi. Possiamo definire un atomo come la particella più semplice di un elemento che ha le proprietà chimiche di quell’elemento. Le proprietà chimiche includono lo stato fisico dell’elemento (gas, liquido o solido), i tipi di legami che l’elemento può formare, come reagisce con altri elementi, ecc. Quindi tutti gli atomi che compongono l’elemento carbonio hanno le stesse proprietà chimiche.
I fisici sono riusciti a dividere gli atomi in decine di particelle subatomiche diverse, ma solo 3 di esse sono stabili. Queste sono i protoni, i neutroni e gli elettroni. I protoni sono particelle con carica positiva, hanno massa e si trovano nel centro, o nucleo, dell’atomo. I neutroni non hanno carica, hanno massa e si trovano anch’essi nel nucleo dell’atomo. I neutroni si legano ai protoni in un modo che aiuta a stabilizzare il nucleo. Troppi o troppo pochi neutroni possono risultare in un nucleo atomico che è instabile e può decadere per formare altri elementi. Ci riferiamo a questi atomi come radioattivi. Anche se la massa del neutrone è leggermente maggiore di quella di un protone, possiamo assegnare a entrambi la massa relativa di 1 (1 unità di massa atomica o amu). Neutroni e protoni costituiscono quasi tutta la massa di un atomo. Il terzo tipo di particella stabile è l’elettrone. Gli elettroni hanno una carica negativa ma sono estremamente piccoli e hanno una massa solo 1/1850 di quella di un protone o di un neutrone. Sono così piccoli che per scopi pratici non contribuiscono alla massa dell’atomo. Gli elettroni si muovono intorno al nucleo a velocità tremendamente elevate, viaggiando in realtà alla velocità della luce. Anche se spesso descriviamo gli elettroni come residenti in orbite che circondano il nucleo, come i pianeti che orbitano intorno al sole, la fisica moderna ci insegna che questo modello non è corretto. Queste “orbite” sono in realtà aree nello spazio intorno al nucleo dove gli elettroni si trovano per la maggior parte del tempo. Quest’area è spesso chiamata “nuvola” di elettroni. È vero, è ancora un’area specifica, ma è un po’ più amorfa di un’orbita sferica. Per semplicità, tuttavia, pensiamo spesso a queste come orbite circolari simili a satelliti. L’immagine qui sotto rappresenta il nostro attuale modello di un atomo di azoto.
Il nucleo di azoto contiene 7 protoni (arancione) e 7 neutroni (verde). Le aree ombreggiate intorno al nucleo rappresentano gli orbitali degli elettroni (nuvole). Gli elettroni (blu) si troveranno da qualche parte all’interno di queste orbite. (Nota: l’immagine non è disegnata in scala. È stato suggerito che se il nucleo fosse grande come un pallone da basket gli elettroni sarebbero a circa sei chilometri o 3¾ miglia di distanza!)
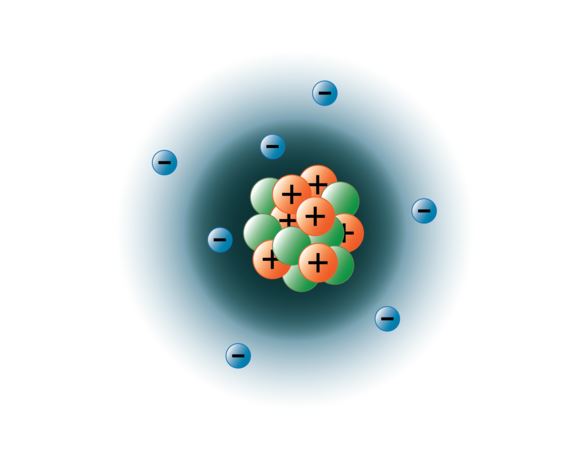
immagine creata dalla studentessa BYU-I Hannah Crowder Autunno 2013
Numero atomico
Guarda ancora la tavola periodica e nota il numero in cima ad ogni casella. Questo numero è il numero atomico dell’elemento ed è unico per ogni elemento diverso. Per esempio, il numero atomico dell’idrogeno è 1. Nessun altro elemento ha un numero atomico di 1. Per il carbonio, il numero atomico è 6 e, di nuovo, nessun altro elemento ha un numero atomico di 6. Il significato del numero atomico è che ci dice il numero di protoni nel nucleo di ogni elemento. Pertanto, tutti gli atomi di idrogeno hanno 1 protone e tutti gli atomi di carbonio hanno 6 protoni. Inoltre, poiché gli atomi hanno una carica neutra, il numero atomico ci dice anche il numero di elettroni nell’atomo. Nella notazione chimica il numero atomico di un elemento è espresso come un pedice che precede il simbolo dell’elemento. Per esempio il carbonio sarebbe espresso come 6C.
Numero di massa (massa atomica)
Il numero di massa di un atomo, come dice il nome, dice la massa totale dell’atomo. Poiché la massa di un elettrone è estremamente piccola (trascurabile), non viene utilizzata nel calcolo del numero di massa. Inoltre, ricordiamo che la massa di ogni protone e di ogni neutrone è di 1 unità di massa atomica. Quindi il numero di massa è la somma dei protoni e dei neutroni nell’atomo. Poiché il numero di massa è il numero di protoni più il numero di neutroni e il numero atomico è il numero di protoni, si può trovare il numero di neutroni semplicemente sottraendo il numero atomico dal numero di massa. Come esempio, supponiamo di avere un elemento con un numero atomico di 8 e un numero di massa di 17. Da questa informazione puoi dedurre che questo elemento ha 8 protoni, 8 elettroni e 9 neutroni (17-8=9). Ora lascia che ti lanci una palla curva. Come detto sopra, tutti gli atomi di un dato elemento hanno lo stesso numero di protoni (numero atomico), tuttavia, diversi atomi di un dato elemento possono avere diversi numeri di neutroni. Diciamo che questi sono diversi isotopi dell’elemento. Per esempio, ci sono tre isotopi di idrogeno. L’isotopo più comune, che comprende il 99,98% di tutti gli atomi di idrogeno, ha un numero di massa 1. È quindi composto da 1 protone, nessun neutrone e un elettrone. Gli altri isotopi meno abbondanti dell’idrogeno hanno numeri di massa 2 e 3, rispettivamente. Questi isotopi differiscono nel numero di neutroni nei loro nuclei, ma tutti e tre hanno un protone e un elettrone. In realtà ci sono isotopi naturali di ogni elemento, ognuno dei quali ha un numero di massa unico. Nella notazione chimica il numero di massa per un dato isotopo è espresso come un apice che precede il simbolo dell’elemento. I tre isotopi dell’idrogeno sarebbero espressi come 1H, 2H e 3H. Poiché ogni elemento è composto da diversi isotopi, una domanda che sorge è “qual è la massa effettiva di un dato elemento? Di nuovo, se guardi la tabella periodica qui sopra, noterai un numero nella parte inferiore di ogni casella. Questo è il peso atomico dell’elemento. Per esempio, il peso atomico dell’idrogeno è 1,00794 amu. Questo numero è stato ricavato calcolando la massa media dei 3 isotopi dell’idrogeno. Per esempio, supponiamo di avere 10 ragazzi nella nostra classe. Se volessimo conoscere il peso medio dei ragazzi, aggiungeremmo i loro pesi individuali e poi dividere il totale per 10. Questo ci darebbe il loro peso medio. Questo è essenzialmente il modo in cui vengono determinati i pesi atomici. Poiché 1H è l’isotopo più abbondante dell’idrogeno, ha senso che il peso atomico dell’idrogeno sia molto vicino alla massa atomica di 1H.
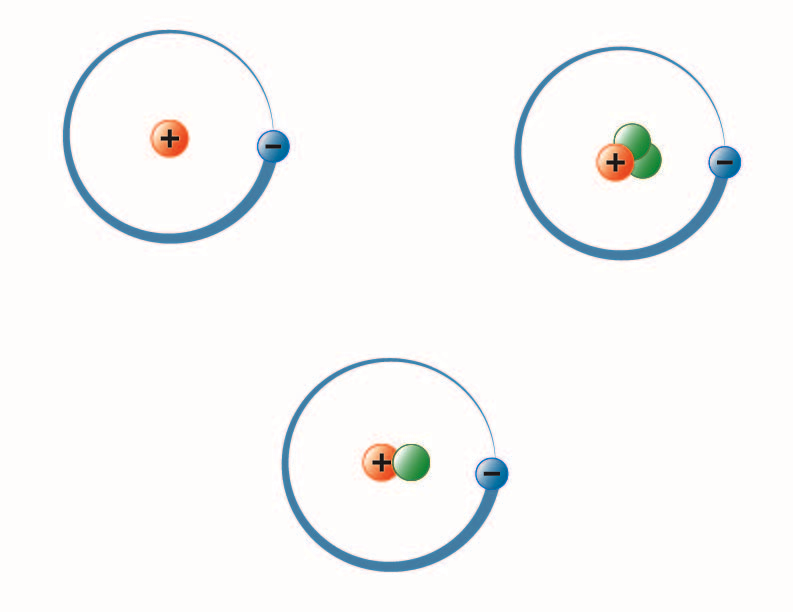
immagine creata dallo studente BYU-I Hannah Crowder Autunno 2013
L’immagine sopra rappresenta i tre isotopi dell’idrogeno. Il più comune (in alto a sinistra) ha un protone e nessun neutrone nel nucleo. Il deuterio (in basso) ha un protone e un neutrone e il trizio (in alto a destra) ha un protone e due neutroni.
** Puoi usare i pulsanti qui sotto per andare alla lettura successiva o precedente di questo modulo**

