In questo capitolo viene presentata tanta materia che darà allo studente una certa comprensione dei metodi di analisi usati nell’esame tecnico del ferro e dell’acciaio. La natura di questo lavoro impedisce un trattamento dettagliato del soggetto, un trattamento che può richiedere una stima di una o più delle seguenti sostanze: -Carbonio (libero e combinato), zolfo, silicio, fosforo, manganese, titanio, rame, nichel, cobalto, cromo, alluminio, arsenico, antimonio, stagno, tungsteno, vanadio, azoto, ferro. In generale, le stime più richieste sono quelle di carbonio, zolfo, silicio e fosforo. Degli altri elementi e composti menzionati, le determinazioni di uno o più sono richieste nel caso di acciai speciali. Per informazioni riguardanti queste determinazioni lo studente è riferito all’analisi chimica e chimica di fonderia, da Crobaugh; The. Analisi chimica del ferro, da Blair; “Carbonio in acciaio da combustione diretta,” da Blount, in The Analyst, gennaio 1902; “Zolfo in ferro battuto e acciaio,” da Auchy, nel Jour. Amer. Chem. Soc., marzo 1901, e altri articoli nelle stesse riviste. Lo studente che desidera andare oltre dovrebbe, se possibile, ottenere l’accesso ai documenti e agli articoli di Campbell, Drown e altri, pubblicati di volta in volta nelle varie riviste chimiche e metallurgiche.
Come il tempo dello studente è limitato, egli può per il momento rimandare la stima di silicio e fosforo, anche se questi sono dati a causa della loro importanza sia per il metallurgista e il fonditore.
Al fine che lo studente può ottenere una comprensione più approfondita del soggetto, alcune note sulla composizione e le proprietà delle sostanze considerate non sarà fuori luogo. Per quanto riguarda l’influenza dei vari elementi sull’acciaio, consultare The Manufacture and Properties of Structural Steel, di H. H. Campbell.
Il carbonio esiste nel ferro in tre stati: grafitico, dissolto e combinato. Oltre a queste, altre forme sono state identificate dal microscopio.
Lo zolfo esiste nel ferro principalmente come il solfuro FeS. che è solubile nel ferro fuso.
Il fosforo esiste come fosfuro di ferro, che è completamente solubile nel ferro fuso.
Il silicio forma silicidi di ferro, che è anche solubile nel ferro fuso.
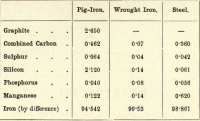
Di questi quattro elementi, quindi, il carbonio è il solo che può esistere allo stato libero. Le variazioni nelle proporzioni dei vari elementi presenti sono quasi infinite, ma la seguente breve tabella fornisce la composizione approssimativa della ghisa, del ferro battuto e dell’acciaio, anche se ognuno di questi è soggetto a notevoli variazioni.
Lo studente deve stimare quanto segue:-
(1) Carbonio,
(a) Totale.
(b) Grafitico.
(c) Combinato.
(2) Zolfo.
(3) Silicio. (Se il tempo lo permette.)
(4) Fosforo. (Se il tempo lo permette.)
CARBONE Totale
In questa stima il carbonio viene convertito in CO2 che viene assorbito nella potassa caustica. Dal peso di CO2 così ottenuto si calcola il carbonio.
A prima vista sembrerebbe che la procedura più semplice sarebbe quella di incendiare direttamente i fori di ferro o acciaio in una corrente di ossigeno e assorbire il CO2 così formato in KHO. Sfortunatamente questo metodo, fino ad ora, si è rivelato impreciso, o quando si è ottenuta una combustione completa, l’apparato necessario per sopportare l’alta temperatura o altre variazioni nel trattamento non era adatto al lavoro tecnico (vedi articoli di Blount in The Analyst). Lo studente troverà che il metodo qui dato non è affatto ideale, da un punto di vista tecnico, per quanto riguarda la convenienza e la rapidità, e sembra probabile che venga sostituito in un prossimo futuro da qualche metodo di ossidazione diretta più veloce.
Metodo adottato.- Facendo riferimento alle molte opere su questo argomento, si troverà una grande varietà di metodi. Il metodo qui dato darà con cura ordinaria risultati accurati. Brevemente è il seguente:-
Il ferro viene sciolto in una soluzione di doppio cloruro di potassio e rame, reso acido con HCl. Il rame metallico è precipitato e ridisciogliuto; il ferro è dissolto, il carbonio è lasciato in sospensione. Si raccoglie e si accende nel forno di combustione con ossigeno, e si pesa la CO2 evoluta.
Soluzione del ferro.-Pesare 1 grammo di borlande di ghisa. Trasferire in un becher da 300 c.c. Aggiungere 100 c.c. CuCl2,2KCl,2H2O soluzione, che è fatto come segue. Sciogliere in acqua 149,1 parti di KCl e 170,3 parti di CuCl2 cristallizzato, 2H2O. Evaporare e cristallizzare il doppio cloruro. Sciogliere 300 g. del sale doppio in acqua distillata. Filtrare attraverso amianto infiammato, e conservare in bottiglie di vetro con tappo.
Al contenuto del bicchiere aggiungere 7 c.cs. HCl per rendere la soluzione acida. Mescolare a intermittenza fino alla soluzione del ferro. Posizionare il becher e il contenuto verso la fine della soluzione su un bagno d’acqua ad una temperatura di circa 60° C. Le seguenti reazioni hanno luogo: Fe + CuCl2 = FeCl2 + Cu e Cu + CuCl2 = 2CuCl. Il KCl aiuta semplicemente la soluzione del rame precipitato. In circa 40 minuti dall’aggiunta dei doppi cloruri, la soluzione dovrebbe essere quasi completa e la maggior parte del rame dissolto. Lavare i lati del becher con un po’ di doppio cloruro acidulato. Alla soluzione aggiungi un po’ di amianto acceso per sistemare la materia carboniosa ed evitare che intasi il filtro (come raccomandato da Barba).
Per la filtrazione, sono molto convenienti le speciali barche di platino, montate sul principio del crogiolo di Gooch. Lo studente può comunque filtrare la materia carboniosa per mezzo di un crogiolo Gooch aiutato dall’aspirazione artificiale, lavando la materia carboniosa con un getto d’acqua dopo che il liquido è passato attraverso il filtro. Lavare accuratamente il carbonio sul filtro con acqua calda. Asciugare il crogiolo e il contenuto nel forno ad aria a 100 C. La materia carboniosa è ora pronta per l’accensione.
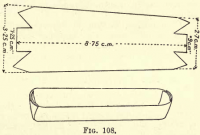
Ossidazione del carbonio.- Preparare una barca di platino tagliando un pezzo di lamina di platino come in fig. 108, ripiegando i lati e le estremità per formare un trogolo. Trasferire la materia carboniosa e l’amianto dal Gooch alla barca.
Il forno di combustione, gli accessori e gli accessori devono essere messi in ordine. Si usa di nuovo l’apparecchio di purificazione dell’ossigeno, ma questa volta è dotato di un tubo a tre vie, con rubinetti inseriti tra il deposito e i depuratori. Questo permette di far passare una corrente d’aria attraverso l’apparecchio. Il tubo di combustione può essere di vetro duro di Jena, porcellana o platino. Due tubi a U sono usati tra la fornace e i bulbi di potassio. L’arto del primo tubo più vicino alla fornace contiene CuSO4 anidro e l’altro arto CuCl anidro. Il secondo tubo a U contiene CaCl2 essiccato. Questi due tubi formano il “treno di purificazione”. Il CuCl assorbe qualsiasi Cl, e le altre sostanze qualsiasi H2O. Questo set servirà per molte determinazioni. Seguono i bulbi di potassio e i tubi di guardia, e un aspiratore dovrebbe essere a portata di mano per disegnare una corrente d’aria attraverso l’apparato quando necessario. I bulbi di potassio sono caricati con 8E. KHO, e il tubo di guardia con CaCl2. Prova la fornace e i bulbi come descritto in precedenza (vedi Carbone e Coke), il tubo viene caricato come nel disegno, la barca è per il momento tenuta nel forno ad aria a 100° C.
Quando tutto è pronto, i bruciatori sono stati spenti per qualche tempo, la barca e il contenuto vengono inseriti. I bruciatori sono accesi dall’estremità anteriore, gradualmente lavorano all’indietro, e una lenta corrente di ossigeno di circa due bolle al secondo è stata precedentemente accesa fino a quando il tubo è pieno di ossigeno. Regolare la temperatura fino a quando la barca è ad un rosso spento, e se la soluzione nei bulbi mostra segni di riflusso verso il forno, aumentare la corrente di ossigeno a tre o quattro bolle al secondo.
Dal momento della messa in barca circa cinquanta minuti saranno sufficienti per una combustione completa. Spegnere l’ossigeno e passare una corrente d’aria per dieci minuti.
I bulbi di potassa e il tubo di guardia sono ora rimossi e pesati, e il carbonio calcolato come al solito.
(b) Carbonio grafitico – Il ferro è, da alcuni, sciolto in HCl, da altri in HNO3 quando il carbonio grafitico rimane come residuo. Per la ghisa entrambi i metodi, con attenzione, dà buoni risultati, ma per gli acciai contenenti grafite Blair raccomanda la soluzione in acido nitrico. (Per questo metodo consultare Blair.)
Pesare 5 gr. di fori di ghisa. Sciogliere in 50 c.cs. SE. HCl con l’aiuto di calore dolce. Far bollire per qualche minuto. Diluire a 100 c.c. (quasi). Filtrare attraverso un crogiolo Gooch. Lavare bene con acqua calda e poi con E. KHO bollente. (Questo dissolve qualsiasi SiO2.) Lavare di nuovo con acqua calda per rimuovere il KHO. Asciugare il crogiolo e il contenuto.
Stimare il carbonio come prima per combustione, e calcolare la percentuale come al solito.
(c) Carbonio combinato (per differenza).- Essendo noti il carbonio totale e il carbonio grafitico, il carbonio combinato si ottiene sottraendo il grafitico dal carbonio totale.
Per i metodi diretti di stima consultare le autorità menzionate.
ESTIMAZIONE DELLO ZOLFO NEL FERRO & ACCIAIO
Considerevoli differenze di opinione esistono riguardo al miglior metodo di stima dello zolfo nel ferro e nell’acciaio. Il vecchio metodo dell’acqua regia e della precipitazione con BaCl2 è ammesso essere molto impreciso; ma la soluzione lenta in HNO3, con pochissimo o nessun HCl presente, seguita da un’attenta precipitazione con BaCl2 in presenza di un preciso eccesso di HCl e con la dovuta attenzione al tempo e alle condizioni di precipitazione, e le precauzioni contro la contaminazione del precipitato da parte del ferro – con questi e la cura si possono ottenere buoni risultati. Blair, d’altra parte, raccomanda la soluzione in HCl, l’S si evolve come H2S, che viene assorbito in una soluzione (alcalina) di Pb(NO3)2 formando PbS, che viene sciolto in HCl + KClO3, e l’S precipitato come BaSO4. Per altri metodi vedi Blair, Stillman, Auchy, Crobaugh e Drown. Un altro metodo di uso comune è quello dell’evoluzione dell’S come H2S, seguito dall’assorbimento in soluzione di cloruro di cadmio. Il solfuro di cadmio precipitato è disciolto in HCl e la S stimata dalla titolazione con una soluzione di iodio, o più comune ancora, l’H2S è assorbito in acqua Br. e poi precipitato come BaSO4 o è assorbito in NaOH e titolato con iodio; quest’ultimo è il metodo preferito. (Vedi Blair.) Il seguente metodo è qui dato:-
Ossidazione con HNO3 (il cosiddetto metodo Aqua Regia).-Pesare 5 gms. di boring e trasferire in un becher profondo 200 c.c. Aggiungere con cura circa 40 c.c. 16E. HNO3, in lotti di circa 10 c.c. alla volta, coprendo il becher con un grande bicchiere da orologio e facendo attenzione che l’azione non sia troppo violenta. Quando l’azione apparentemente cessa, nota se tutte le particelle sono dissolte (tranne il carbonio). In caso contrario, riscaldare sul bagno di sabbia e aggiungere 3 o 4 gocce di 16E. Quando la soluzione è completa, aggiungi un po’ di Na2CO3 per convertire l’H2SO4 in Na2SO4, che non è volatile all’evaporazione.
Rimuovi dal bagno di sabbia e aggiungi 5 c.c. di HCl forte in eccesso rispetto a quello necessario per dissolvere i composti di ferro precipitati dall’Na2CO3. Filtrare il SiO2 e lavare bene. Evaporare a secco per rendere SiO2 insolubile. Riprendere con HCl ed evaporare fino a quando Fe2Cl6 comincia a cristallizzare. Poi aggiungere 5 c.cs. HCl. e filtrare se è presente qualche residuo. (Se nessuno è presente, nessun SiO2 era in soluzione, e l’evaporazione avrebbe potuto essere omessa). Filtrare e lavare accuratamente il precipitato nel Gooch, portando il liquido e i lavaggi fino a circa 100 c.cs.
Riscaldare all’ebollizione. Aggiungere 10 c.c. di soluzione satura di BaCl2. Far bollire per 30 minuti. Lasciare riposare durante la notte. Filtrare attraverso un Gooch. Lavare con un po’ di E. HCl. e poi con acqua. Asciugare, incendiare e pesare come al solito il BaSO4, che deve essere bianco e non contaminato da sali di ferro.
Calcolare la percentuale di S nel solito modo. Poiché alcuni dei reagenti utilizzati possono contenere zolfo, è necessario eseguire un bianco, utilizzando le stesse quantità come nell’analisi reale, e lo zolfo eventualmente trovato dedotto dal risultato precedente.
ESTIMAZIONE DEL SILICIO
Il metodo qui dato è quello di Drown, ed è sia rapido che esatto. Il ferro viene sciolto in HNO3, seguito da H2SO4, con evaporazione a secco. Questo è seguito dalla soluzione, lasciando il silicio nel residuo come SiO2.
Dettagli.-Pesare 2 grammi di boring, e trasferire in un piatto di platino o porcellana. Aggiungere 30 c.cs. 8E. HNO3 Quando l’azione apparentemente cessa, aggiungere 20 c.cs. 18E. H2SO4 ed evaporare. (Blair raccomanda un leggero soffio di aria calda che gioca sulla superficie del liquido. L’aria viene riscaldata facendola passare attraverso una piccola spirale di tubo di rame riscaldato su un bunsen. L’evaporazione è così accelerata e lo spirting impedito). Continuare l’evaporazione fino a quando si sprigionano copiosi fumi di SO3. Raffreddare, e cautamente diluire con acqua distillata a 130 c.c. Riscaldare fino a quando tutto il FeSO4 è dissolto. Filtrare e lavare prima con un po’ di E. HCl e poi con acqua calda. Questa filtrazione è meglio eseguita con una carta da filtro senza cenere di 7 cm. (controllare la cenere accendendo due o tre delle carte). Asciugare; trasferire in un crogiolo di platino; accendere come al solito e pesare. Al crogiolo aggiungere 5 c.c. di H2SO4 forte e 5 c.c. di HF forte. Evaporare accuratamente a secco, usando un soffio d’aria calda per accelerare l’evaporazione. Accendere e pesare di nuovo. Se l’H2SO4 e l’HF sono puri, la differenza di peso rappresenta SiO2. Controllare l’H2SO4 e l’HF (in particolare quest’ultimo) facendo evaporare un bianco. Qualsiasi residuo trovato deve essere considerato.
ESTIMAZIONE DEL FOSFORO
Ancora una volta, numerosi metodi sono dati da diverse autorità, la maggior parte dei quali danno risultati accurati se seguiti attentamente. I due metodi più adatti all’analisi tecnica sono il metodo di riduzione volumetrica preparato dal sottocomitato (i signori Barba, Blair, Drown, Dudley e Shimer) dell’International Steel Standards Committee, U.S.A., e il metodo di riduzione modificato dato dai signori Dudley e Pease, Jour. Anal. Appl. Chem., vii. 108. Il primo metodo è completamente discusso in Blair’s Analysis of Iron; il secondo metodo è dato qui.
Il ferro è sciolto, e il P precipitato come fosfo-molibdato di ammonio. Questo è disciolto, e per l’azione di Zn e H2SO4 il MoO3 è ridotto, e il liquido ridotto è poi titolato con K2Mn2O8 (soluzione standard), e dal numero di c.c. utilizzati il contenuto P può essere calcolato.
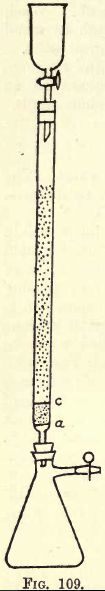
Dettagli. -Dove c’è molto lavoro da fare, è necessario un apparato di agitazione (vedi cataloghi di forniture chimiche). Lo studente, tuttavia, può eseguire l’agitazione necessaria a mano. Prima di procedere all’analisi, l’apparato riduttore (una modifica del riduttore Jones) deve essere preparato (vedi fig. 109).
In corrispondenza di a si trova un disco finemente perforato di robusto foglio di platino. Tra a e c c’è circa ¾ di pollice di sabbia bianca pulita, c è un altro disco di platino perforato.
Sopra questo disco il tubo è riempito con zinco amalgamato finemente granulato, preparato così:-Dissolvere 5 gms. Hg in 25 c.c. di HNO3 forte, diluendo con acqua e portando la soluzione a 1 litro. In questa soluzione versare mezzo chilo di zinco granulato che passa un setaccio da 20 ma non da 30. Agitare per uno o due minuti. Versare la soluzione. Lavare e asciugare lo zinco, che ora è amalgamato. L’imbuto e il pallone sono montati sull’apparecchio come mostrato.
Preparare i seguenti reagenti :-
(a) La soluzione fortemente ossidante di K2Mn2O8. 12 gms. di K2Mn2O8 puro in 1 litro di acqua. Filtrare e imbottigliare.
(b) La soluzione di molibdato. MoO3 in 200 c.cs, NH4HO (S.G. .96). Filtrare, e al filtrato aggiungere 500 c.cs. HNO3 (S.G. 1.2). Lasciare riposare almeno 24 ore prima dell’uso.
(c) La soluzione di solfato di amnwnium acido. A 500 cs. di acqua distillata aggiungere 27,5 cs. NH4HO (S.G. 0.96), e poi 24 c.c. di H2SO4 puro (S.G. 1.84), e diluire a 1000 c.cs.
(d) La soluzione standard di K2Mn2O8.-Dissolvere 2 g. di K2Mn2O8 cristallizzato in 1000 c.c. di acqua distillata. Standardizzare la soluzione come segue: Pesare 3 lotti da .1 a .3 gm. ciascuno di filo di ferro accuratamente pulito, il cui contenuto di ferro è noto. Trasferire in una beuta da 100 c.c. e aggiungere a ciascuna 40 c.c. 8E. H2SO4. Quando sciolto, far bollire 5 minuti; diluire a 150 c.c., e passare attraverso il riduttore e lavare, portando il volume a 200 c.c., come indicato nell’analisi. Titolare ogni lotto con K2Mn2O8. I risultati dovrebbero concordare per il ferro metallico a 1/100 di milligrammo. Fare la tolleranza necessaria per le impurità nel filo preso. Supponiamo che 1 c.c. K2Mn2O8 = .0034923 gm, Fe, poi moltiplicare questo valore in Fe per il rapporto di MoO3 a Fe, vale a dire, .9076, e il prodotto per rapporto del P
presente al MoO3 vale a dire, .019, abbiamo
1 c.c. K2Mn2O8 = .0000602 gm. P
Analisi
Pesare i fori da 1 gm. Trasferire in una beuta da 200 c.c. Aggiungere 70 c.c. 5E. HNO3. Quando la soluzione è completa, far bollire un minuto, e aggiungere 10 c.c. della soluzione ‘ossidante’ di K2Mn2O8. Far bollire fino a quando il colore rosa scompare e MnO2 si separa. Rimuovere, e aggiungere gradualmente con l’agitazione cristalli di FeSO4 puro (senza fosforo) fino a quando il contenuto si chiarisce. Riscaldare la soluzione a 80° C. (se è presente As, a 35° C.). Aggiungere 75 c.c. della soluzione di molibdato alla temperatura di 27° C. Chiudere il pallone con un tappo di gomma e agitare per 5 minuti. Lasciare riposare per 5 minuti. Poi filtrare attraverso un filtro di 9 cm e lavare con la soluzione acida di solfato di ammonio fino a quando alcune gocce dei lavaggi non danno colore con solfuro di ammonio.
Dissolvere il precipitato sulla carta con 5 c.cs. NH4HO (S.G. 0.90) e 25 c.c. di acqua, facendo rifluire la soluzione nel pallone originale, sciogliendo così il precipitato che aderisce alle pareti. Lavare fino a che il filtrato e i lavaggi ammontino a 150 c.c. Aggiungere 10 c.c. di H2SO4 forte (S.G. 1.84), e diluire a 200 c.c. La soluzione è ora pronta per la riduzione.
Versare 100 c.c. di ~E/2 H2SO4 caldo nell’imbuto. Collegare il pallone alla pompa filtro e aprire il morsetto, in modo che la soluzione esca quasi, ma non del tutto, dall’imbuto. Poi nell’imbuto aggiungi il seguente bianco-5 c.c. NH4HO (S.G. 0.90), 10 c.c. H2SO4 (S.G. 1.84), e 50 c.c. di acqua, mescolati insieme. Apri di nuovo il morsetto, in modo da far quasi uscire questa miscela dall’imbuto. Ora aggiungi 200 c.c., E/2 H2SO4 all’imbuto, e fallo quasi scorrere.
Scollega il pallone, chiudendo prima il rubinetto dell’imbuto. Titolare il contenuto del pallone con K2Mn2O8. Generalmente circa 0,1 c.c. permanganato sono così consumati, e questa quantità deve essere dedotta dalle letture future.
Trasferire ora la soluzione da ridurre all’imbuto. Collegare un pallone pulito. Collegare e avviare la pompa del filtro. Aprire il rubinetto e la pinza, in modo da far scorrere quasi tutta la soluzione. Lavare il pallone che conteneva la soluzione con 100 c.c. E/2 H2SO4. Aggiungere questo all’imbuto, e trattare come prima.
Finalmente, aggiungere e quasi correre attraverso un altro 100 c.c. dell’acido.
La soluzione ridotta nel pallone filtro dovrebbe ora essere verde brillante.
Rimuovere come prima e titolare con la soluzione di permanganato. Il verde cambia in marrone rosato, poi giallo rosato, poi incolore, e infine si ottiene un rosa permanente (dopo un minuto di permanenza). Dalla lettura ottenuta dedurre la lettura in bianco, e calcolare la percentuale di P presente dai dati forniti sopra.
Invece di questo metodo volumetrico, alcuni chimici preferiscono pesare direttamente il precipitato giallo fosfo-molibdato. Per i dettagli vedi Blair’s Analysis of Iron, p. 108.
Nota.-Lo studente dovrebbe, ove possibile, approfittare dei riferimenti ad autorità speciali. A questo punto dovrebbe essere in grado di consultare, confrontare e, in una certa misura, utilizzare con giudizio tali materiali. Nessun libro di testo può dare un trattamento comunque completo di ‘Ferro e acciai,’ o, per quella materia, di uno qualsiasi degli argomenti trattati in questa sezione; quindi tali riferimenti come sono dati, insieme con la letteratura corrente, deve essere attentamente esaminato dall’analista che vuole eccellere nel lavoro tecnico. La determinazione colorimetrica del carbonio combinato con il metodo di Eggertz è stata data; il manganese può essere determinato in modo simile con il metodo colorimetrico di Peter, o con il metodo dell’acetato (vedi Blair, ecc.).