1 – Definizione
La ARVD è una malattia del muscolo cardiaco associata ad aritmie ventricolari e morte improvvisa. È caratterizzata da anomalie strutturali e funzionali del ventricolo destro causate dalla sostituzione del miocardio con tessuto grasso e fibroso. I siti di coinvolgimento delle anomalie anatomiche si trovano nel cosiddetto triangolo della displasia (le aree subtricuspidee del ventricolo destro, l’apice e l’infundibolo)(4).
La displasia aritmogena del ventricolo destro (ARVD) è una malattia ereditaria, tipicamente ereditata come un tratto autosomico dominante con penetranza variabile ed espressione incompleta(1). Esiste una variante autosomica recessiva associata a cheratosi palmoplantare e capelli a caschetto chiamata malattia di Naxos.
2 – Prevalenza
La prevalenza nella popolazione generale è approssimativamente da 1:2500 a 1:5000
Tuttavia, dipende dalle circostanze geografiche, per esempio in certe regioni d’Italia (Padova, Venezia) e Grecia (isola di Naxos), la prevalenza è maggiore(2). Rappresenta dal 5% al 10% delle morti cardiache improvvise inspiegabili negli individui sotto i 65 anni(3).
Si verifica nei giovani adulti con un rapporto maschio/femmina di 2,7/1. Dopo la cardiopatia ipertrofica, è la prima causa di morte cardiaca improvvisa nei giovani.
3 – Diagnosi
La diagnosi di ARVD è spesso difficile perché non esiste un test unico. La diagnosi si basa sulla presenza di fattori strutturali, istologici, elettrocardiografici e genetici secondo il rapporto della Task Force del 1994 di McKenna et al (5) (tabella 1) e una modifica della Task Force di Homid et al (6) (tabella 2) per aumentare la sensibilità diagnostica dei familiari di primo grado per la diagnosi precoce della malattia.
A) Storia clinica
Prima di tutto, inizieremo con lo strumento più facile, cioè la storia clinica.
La presentazione clinica varia da forme asintomatiche a palpitazioni, affaticamento, sincope o anche arresto cardiaco di solito durante l’esercizio. Questi sintomi sono dovuti a battiti ectopici ventricolari, tachicardia ventricolare sostenuta con configurazione di blocco di branca sinistra o insufficienza ventricolare destra (4).
Possiamo identificare quattro fasi nella storia naturale di questa malattia(7):
a) la fase iniziale o silenziosa, è una fase subclinica con anomalie strutturali nascoste
b) la fase instabile con disturbi elettrici
c) la fase di insufficienza ventricolare destra
d) la fase finale con insufficienza biventricolare progressiva, che imita la cardiomiopatia dilatativa
B) Test diagnostici
1.- Elettrocardiogramma
Ci sono diverse caratteristiche ECG nei criteri di diagnosi di ARVD:
a) inversioni dell’onda T in V1 attraverso V3 (criterio diagnostico minore, ma una delle anomalie ECG più comuni presente nell’85% dei pazienti (8)
b) durata QRS = 110 ms in V1 attraverso V3
c) onda Epsilon (potenziali elettrici dopo la fine del complesso QRS). È un importante criterio diagnostico che si trova fino al 30% dei casi di ARVD.
Sono stati riportati altri marcatori ECG di ARVD: Dispersione QRS e QT, blocco parietale definito come una durata del QRS nelle derivazioni da V1 a V3 che supera la durata del QRS nella derivazione V6 di > 25 ms, un prolungamento della salita dell’onda S da V1 a V3 = 55 ms (è stato visto come la caratteristica ECG più prevalente nel 95% dell’ARVD8
2.- Imaging miocardico
2.1 Ecocardiografia
È la tecnica di imaging non invasiva più utilizzata, ma non è sempre la tecnica di imaging ottimale nei pazienti obesi e nei pazienti con enfisema polmonare.
L’ecocardiografia è l’approccio diagnostico iniziale nei pazienti con sospetto di ARVD. I risultati principali sono (9):
– dilatazione del ventricolo destro e ipocinesia
– dilatazione isolata del tratto di efflusso ventricolare destro
– aumento della riflettività della banda moderatrice
– aneurismi end-diastolici
– acinesia-discinesia del segmento inferobasale e dell’apice ventricolare destro
– trabecole apicali prominenti
2.2 Angiografia con contrasto del ventricolo destro
Questa tecnica è considerata lo standard di riferimento per la diagnosi di ARVD (10). Consiste in aree acinetiche-discinetiche localizzate nel triangolo anatomico della displasia. Tuttavia, a causa di una tecnica invasiva, l’esposizione ai raggi X, la variabilità interosservatore, questo metodo non è ampiamente utilizzato (9).
2.3 Tomografia computerizzata
La tomografia computerizzata è in grado di diagnosticare i pazienti con ARVD. Dery et al11, sono stati i primi a dimostrare un ventricolo destro ipocinetico dilatato in un paziente con ARVD.
I risultati dell’ARVD sulla tomografia computerizzata a fascio di elettroni sono7:
– la presenza di grasso epicardico o di depositi di grasso intramiocardico
– trabecole cospicue con bassa attenuazione
– ventricolo destro ipocinetico dilatato
– aspetto smerlato della parete ventricolare destra
Oggi la tomografia computerizzata non è la modalità di imaging opzionale per lo screening iniziale a causa dell’elevato carico di radiazioni.
2.4 Risonanza magnetica cardiovascolare
La risonanza magnetica (RM) è uno strumento eccellente per la visualizzazione del ventricolo destro, permette una valutazione tridimensionale dell’anatomia ventricolare, dei volumi e, rispetto ad altre tecniche, può riconoscere meglio la sostituzione del tessuto miocardico grasso e fibroso, anche se l’infiltrazione grassa del ventricolo destro non è esclusiva dell’ARVD, poiché si presenta in più del 50% dei cuori normali negli anziani. Tuttavia la presenza di sostituzione grassa transmurale o l’assottigliamento diffuso del miocardio del ventricolo destro dovrebbe essere considerato un criterio importante per la diagnosi di ARVD.
La RM può essere utilizzata anche per valutare la funzione sistolica e diastolica. Diversi studi hanno affrontato la presenza di disfunzione diastolica del ventricolo destro come un marker precoce della malattia (12)
I criteri tipici che possono essere dimostrati con la RM sono:
– presenza di aree ad alta intensità di segnale che indicano la sostituzione del miocardio con il grasso (criterio principale)
– sostituzione fibrosa che porta all’assottigliamento diffuso del miocardio ventricolare destro (criterio principale)
– aneurisma del ventricolo destro e del tratto di efflusso ventricolare destro (criterio principale)
– dilatazione del ventricolo destro e del tratto di efflusso ventricolare destro (quando grave, criterio principale; se lieve, criterio minore)
– anomalie di contrazione regionale (criterio minore)
– disfunzione sistolica globale (criterio maggiore) e disfunzione diastolica globale (criterio minore)
La risonanza magnetica cardiovascolare fornisce importanti criteri anatomici, morfologici, funzionali e fluidodinamici per la diagnosi di ARVD anche se la diagnosi di ARVD deve essere fatta in base ai criteri della Task Force e non solo alle anomalie strutturali.
2.5 Biopsia endomiocardica
La diagnosi istologica è definitiva, tuttavia la biopsia endomiocardica è controversa a causa della natura segmentale della malattia e i campioni sono solitamente ottenuti dal setto (13). Possono verificarsi complicazioni come tamponamento e perforazione.
4 – Gestione dei pazienti con ARVD
Prima del trattamento, dobbiamo conoscere i predittori di mortalità e la stratificazione del rischio. Lo studio di Hulot et al (14) ha trovato che almeno 1 episodio di tachicardia ventricolare con blocco di fascio sinistro, segni clinici di insufficienza ventricolare destra e disfunzione ventricolare sinistra sono associati a morti cardiovascolari.
Il problema è che la comparsa della morte improvvisa non è legata alla progressione della malattia e la morte improvvisa potrebbe essere la prima manifestazione della malattia.
1.- Farmaci antiaritmici
I farmaci antiaritmici sono la terapia iniziale e più comunemente usata. Gli agenti bloccanti beta-adrenergici sono raccomandati per ridurre l’aritmia stimolata dagli adrenergici.
Il farmaco di maggior successo è il sotalolo. Il sotalolo è stato più efficace degli agenti beta-bloccanti o dell’amiodarone in pazienti con tachicardia ventricolare (VT) inducibile e non inducibile, somministrato in dosaggi che vanno da 320 a 480 mg/giorno (il sotalolo ha impedito la VT durante la stimolazione ventricolare programmata nel 68%, mentre l’amiodarone nel 26% e le classi Ia e Ib nel 5,6% e la classe Ic solo nel 3% dei pazienti) (15).
2.- Ablazione con catetere
L’ablazione a radiofrequenza (RF) è usata nei casi di refrattarietà/intolleranza ai farmaci o tachicardia ventricolare incessante. L’obiettivo dell’ablazione RF è di eliminare le vie di conduzione. È associato a un successo completo solo nel 30-65% dei casi. A causa della natura progressiva e diffusa della malattia, è difficile abolire più focolai aritmogeni16.
Il substrato patologico è registrato durante lo studio elettrofisiologico come una bassa ampiezza, segnale endocardico frazionato che riflette una diminuzione della velocità di conduzione endocardica locale7.
3.- Terapia con cardioverter-defibrillatore impiantabile
I pazienti considerati ad alto rischio di morte cardiaca improvvisa dovrebbero ricevere un cardioverter-defibrillatore impiantabile (ICD). Sono quelli che 1) sono stati rianimati da un arresto cardiaco con una storia di sincope, 2) hanno aritmie minacciose che non sono completamente soppresse dalla terapia farmacologica antiaritmica e 3) con una storia familiare di arresto cardiaco in parenti di primo grado (prevenzione primaria).
Gli ICD funzionano fornendo pacing antitachicardico e shock di defibrillazione quando si verificano aritmie.
La terapia con ICD è fattibile e sicura nei pazienti con ARVD con una bassa incidenza di complicazioni a breve e lungo termine. Questo strumento ha un ruolo importante nel trattamento delle aritmie ventricolari, più di tre quarti dei pazienti ARVD hanno ricevuto una terapia ICD appropriata durante una media di 3,5 anni di follow-up (17)
Tuttavia, ci possono essere complicazioni della terapia ICD come risultato della sostituzione del miocardio del ventricolo destro con tessuto grasso e fibrotico. Queste includono la perforazione causata dall’assottigliamento della parete del ventricolo destro, la difficoltà nel posizionamento dell’elettrocatetere a causa di ampiezze inadeguate dell’onda R o soglie di stimolazione elevate, il rilevamento inadeguato o la stimolazione durante il follow-up risultante dalla progressione della malattia e la mancata terminazione delle aritmie ventricolari a soglie di defibrillazione in aumento (18).
4.- Trattamento dell’insufficienza cardiaca
Quando compare l’insufficienza ventricolare destra o biventricolare, il trattamento consiste nella terapia corrente per l’insufficienza cardiaca, compresi diuretici, agenti beta bloccanti, inibitori dell’enzima di conversione dell’angiotensina e anticoagulanti.
La terapia curativa in caso di insufficienza cardiaca congestizia refrattaria e/o aritmie è il trapianto cardiaco.
Figura 1. Registrazione di un’onda epsilon post-eccitazione (frecce) nelle derivazioni precordiali di destra.
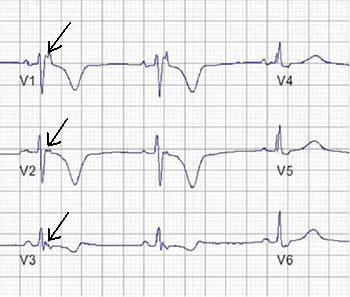
Figura 2. Registrazione ECG a 12 derivazioni di VT con morfologia di blocco di branca sinistra
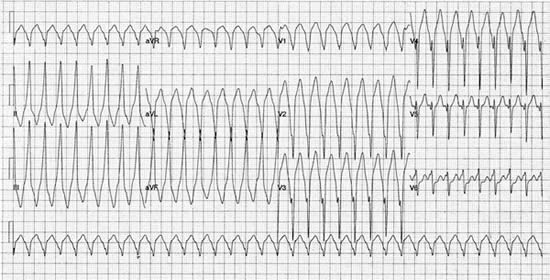
Tabella 1. Criteri per la diagnosi di displasia ventricolare destraI Disfunzione globale e/o regionale e alterazioni strutturali
| Maggiore | Dilatazione grave e riduzione della frazione di eiezione ventricolare destra senza (o solo lieve) compromissione del LV |
| Aneurismi localizzati del ventricolo destro (aree acinetiche o discinetiche con rigonfiamento diastolico) | |
| Dilatazione segmentale grave del ventricolo destro | |
| Minore | Dilatazione globale lieve del ventricolo destro e/o riduzione della frazione di eiezione con ventricolo sinistro normale |
| Lieve dilatazione segmentale del ventricolo destro | |
| Ipocinesia regionale del ventricolo destro |
II Caratterizzazione tessutale delle pareti
| Maggiore | Sostituzione fibrosa del miocardio su biopsia endomiocardica |
III Anomalie di ripolarizzazione
| Minore | Onde T invertite nelle derivazioni precordiali destre (V2 e V3) persone con più di 12 anni; in assenza di blocco di branca destro |
IV Anomalie di depolarizzazione/conduzione
| Maggiore | Onde Epsilon o prolungamento localizzato (>110 ms) del complesso QRS nelle derivazioni precordiali destra (V1-V3) |
| Minori | Potenziali tardivi (media del segnale ECG) |
V Aritmie
| Minori | Tachicardia ventricolare tipo blocco del fascio sinistro (sostenuta e non sostenuta) (ECG, Holter, test da sforzo). |
| Frequenti extrasistoli ventricolari (più di 1000/24h) |
VI Storia familiare
| Maggiore | Malattia familiare confermata alla necroscopia o all’intervento chirurgico |
| Minore | Storia familiare di morte improvvisa prematura (< 35 anni) dovuta a sospetta displasia ventricolare destra. |
| Anamnesi familiare (diagnosi clinica basata sui criteri attuali) |
Tabella 2. Proposta di modifica della Task Force per la diagnosi di ARVD familiare
ARVD in un parente di primo grado più uno dei seguenti:
| 1.- ECG | Inversione dell’onda T nelle derivazioni precordiali destra (V2 e V3) |
| 2.- SAECG | Potenziali tardivi visti su ECG a media di segnale (SAECG) |
| 3.- Aritmia | VT di tipo LBBB su ECG, monitoraggio Holter o durante test da sforzo. Extrasistoli > 200 in un periodo di 24 ore |
| 4.- Anomalia strutturale o funzionale del RV | Dilatazione globale lieve del RV e/o riduzione dell’EF con LV normale Dilatazione segmentale lieve del RV Ipocinesia regionale del RV |
Il contenuto di questo articolo riflette l’opinione personale dell’autore/i e non è necessariamente la posizione ufficiale della Società Europea di Cardiologia
.