In questo post introduciamo i carbammati come un utile gruppo di protezione per le ammine, in particolare nel contesto di fare peptidi.
Qui c’è una rapida immagine riassuntiva di ciò che approfondiremo in questo post, con maggiori dettagli di seguito.
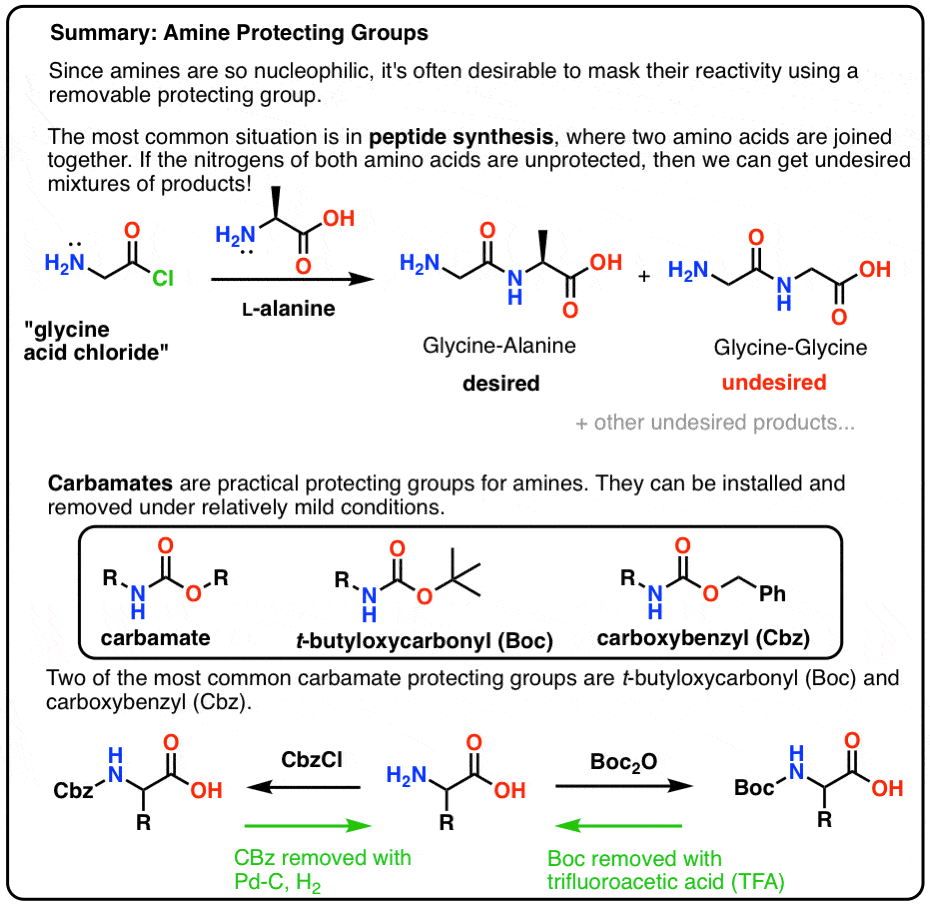
Tabella del contenuto
- Un’introduzione alla sintesi peptidica semplice
- Misceliamo una partita di Gly-Ala
- Un pessimo piano iniziale
- “Hark! Che merda è questo?”
- Un cappello protettivo per NH2
- Amico! Usa un carbammato, amico!
- Boc e CBz sono le ginocchia delle api
- Installazione e rimozione del gruppo di protezione “Boc”
- Installazione e rimozione del gruppo di protezione CBz (o “Z”) Carbamate
- Una semplice sintesi peptidica usando gruppi di protezione Carbamate
- Continua…
- Note
- (Avanzate) Riferimenti e ulteriori letture
Un’introduzione alla sintesi peptidica semplice
In un post recente abbiamo esaminato 3 modi comuni di fare ammidi:
- Addizione di ammine ad alogenuri acilici / anidridi
- Idrolisi parziale di nitrili
- Accoppiamento di acidi carbossilici con ammine usando un agente disidratante come il DCC (N,N’-dicicloesilcarbodiimide).
Quello che mancava in quel post era qualsiasi menzione di sintetizzare il bisnonno dei più utili legami ammidici conosciuti dall’umanità, e con questo intendo i peptidi.
Un legame peptidico è il nome che diamo al legame ammidico che unisce due amminoacidi.
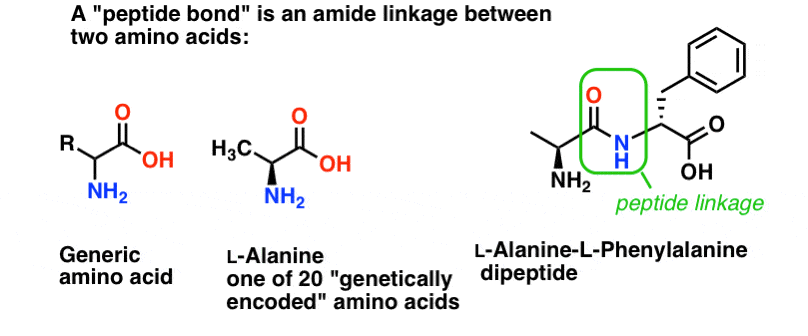
E gli amminoacidi sono importanti perché… aspetta. Sai già perché gli aminoacidi sono importanti, giusto? Se non lo sai adesso, torna dopo aver letto questo.
Misceliamo una partita di Gly-Ala
Proviamoci ad applicare alcune delle nostre ritrovate abilità di sintesi amidica per provare a costruire un dipeptide molto semplice, glicina-alanina. Se riusciamo a costruire un semplice dipeptide ora, possiamo usare ciò che abbiamo imparato per mostrare come sono fatti peptidi ancora più complessi in un post successivo. Sapevate che il premio Nobel Bruce Merrifield ha sintetizzato l’insulina unendo un aminoacido alla volta? Sì, davvero.
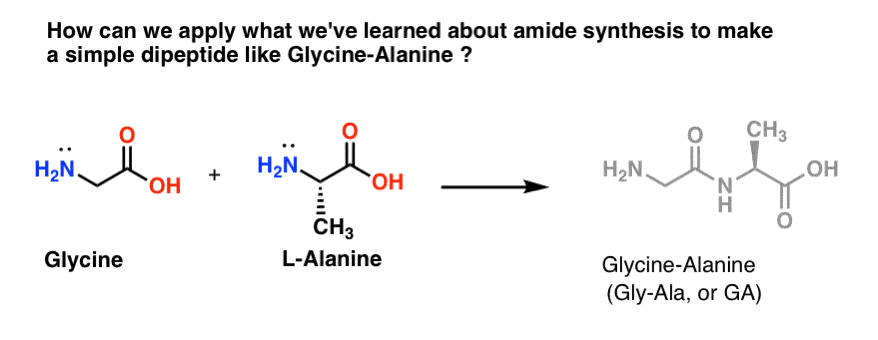
Dei tre metodi che abbiamo elencato per fare ammidi, solo due sono potenzialmente utili per formare legami peptidici: 1) il metodo del cloruro acido, o 2) la sintesi tramite un agente di accoppiamento come il DCC. .
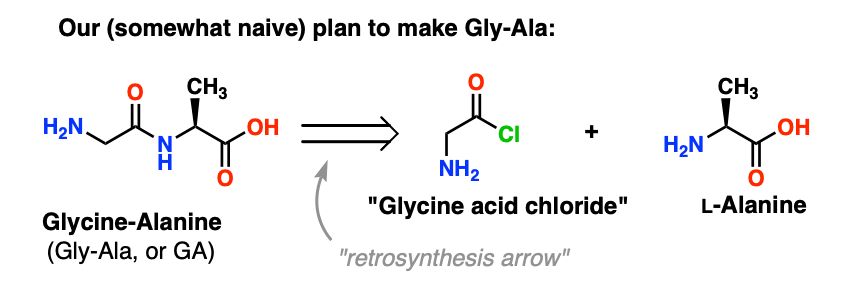
3. Un pessimo piano iniziale
Il nostro primo tentativo di sintesi peptidica comporterà l’andare avanti con un piano di attacco molto ingenuo e sperare che tutto funzioni alla fine. Tenetevi forte gente, perché sta per diventare un casino.
Iniziamo proponendo il metodo del cloruro acido per la sintesi di Gly-Ala.
Guardando all’indietro dal dipeptide Gly-Ala, il nostro piano ci farebbe sintetizzare il legame peptidico attraverso la reazione dell’alanina con il cloruro acido derivato dalla glicina:
C’è un piccolo problema con questo piano. Può essere un po’ difficile da individuare all’inizio.
Immaginiamo di aver fatto il cloruro acido della glicina* , e di avere il “cloruro acido di glicina” e l’alanina insieme nella stessa beuta, insieme a un po’ di base in eccesso per accelerare le cose.
Disegneremo la reazione in avanti:
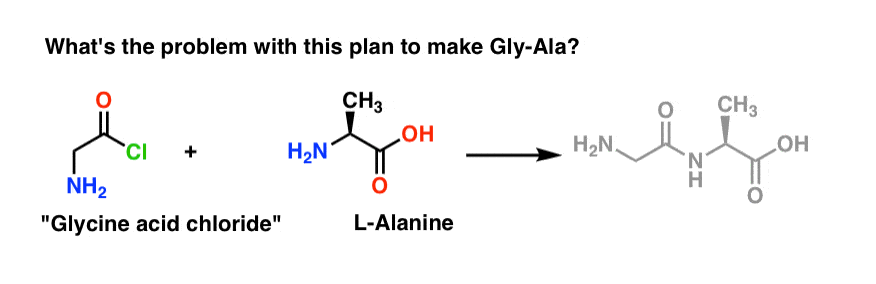
Cosa potrebbe andare storto?
“Hark! What Crap Is This? “
Il nostro piano è di fare una soluzione del cloruro acido di glicina (1 molare equivalente), e poi farlo aspettare pazientemente nel pallone fino a quando abbiamo aggiunto un equivalente molare di alanina, dove avrebbe reagito con il gruppo nucleofilo NH2 dell’alanina.
Il problema con il nostro piano è che non abbiamo a che fare con una singola molecola di “cloruro acido di glicina” – abbiamo a che fare con qualcosa come una mole (6,02 x 1023 molecole) di esso. E il cloruro acido di glicina ha già un gruppo NH2 nucleofilo!
“Il cloruro acido di glicina” come disegnato, non è una molecola stabile, perché può reagire con se stessa.
Questo significa che una soluzione di cloruro acido di glicina lasciata a se stessa formerebbe un polimero di glicina, con la struttura Gly-Gly-Gly-Gly…
Anche una soluzione di cloruro acido di glicina in presenza di alanina non solo formerebbe il desiderato Gly-Ala, ma anche Gly-Gly (con un alogenuro acilico attaccato) che può andare a fare più male con un altro nucleofilo, sia esso Gly o Ala:
(e no, non c’è molto da distinguere l’NH2 del “cloruro acido di glicina” dall’NH2 dell’alanina. Sono ugualmente reattivi.)
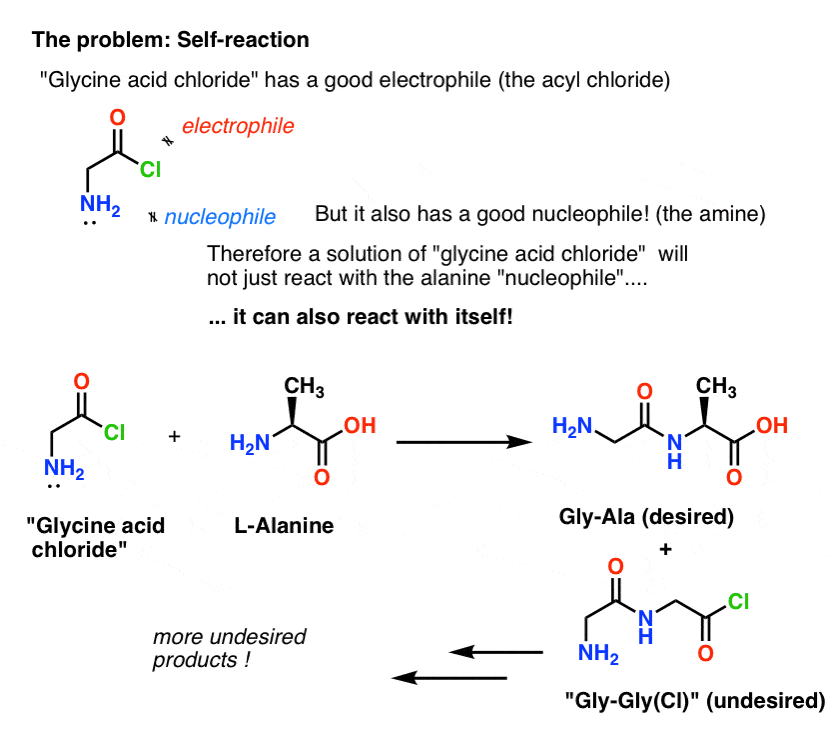
La lezione qui è che quando hai una soluzione di una molecola contenente sia un nucleofilo che un elettrofilo, può auto-reagire. C’è un nome per questo processo che potrebbe suonare familiare: polimerizzazione.
Quindi come possiamo impedire che questo accada?
Un cappello protettivo per NH2
Il modo migliore è quello di “coprire” l’azoto in qualche modo con un gruppo protettivo (PG) che rende il gruppo NH2 non nucleofilo. Dovrebbe anche avere le seguenti proprietà:
- facilmente e selettivamente installato
- inerte alle condizioni di reazione desiderate (es. SOCl2 per fare il cloruro acido dall’acido carbossilico)
- facilmente e selettivamente rimosso senza influenzare il prodotto finale
Abbiamo visto strategie di gruppi protettivi prima, in particolare con gli alcoli e l’uso di reagenti di Grignard.
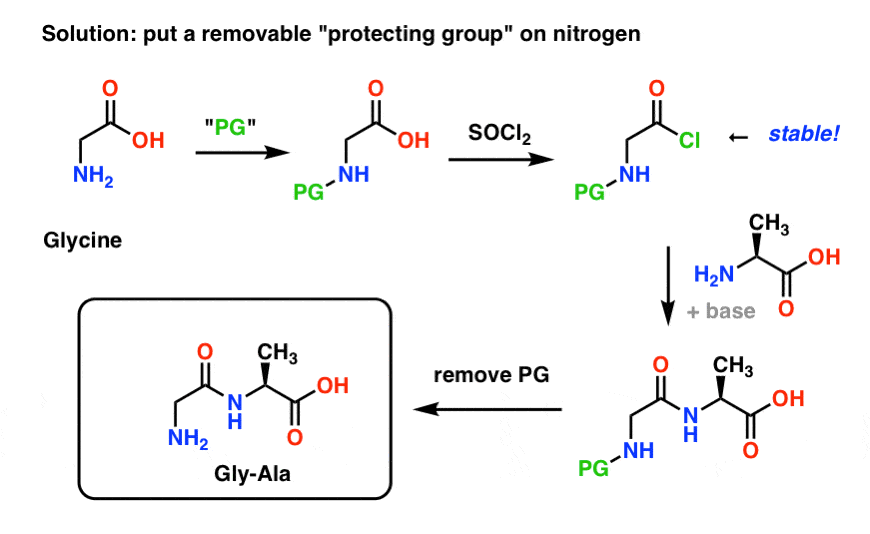
Ecco come potrebbe essere una strategia di gruppo protettivo per la nostra sintesi di “Gly-Gly”. Installiamo un gruppo di protezione (“PG”) sulla glicina, poi facciamo il cloruro acido. Il PG dovrebbe essere scelto in modo da rendere l’azoto non nucleofilo (cioè non reagirà con il cloruro acido).
Possiamo quindi formare il nostro legame peptidico con l’alanina non protetta e poi rimuovere il PG in condizioni delicate.
Una strategia di gruppo protettivo per l’azoto che abbiamo già esplorato è la sintesi Gabriel, che usa la ftalimmide (si può pensare a una ftalimmide come a un azoto protetto). Questo è stato effettivamente utilizzato per sintetizzare Gly-Gly (“glicilglicina”)! Uno dei problemi, tuttavia, è che sono necessarie condizioni relativamente dure (ampio calore) sia per installare e rimuovere il gruppo ftalimmide, e questo non è un ambiente molto sano per la sopravvivenza di sensibili, amminoacidi chirali, che possono facilmente racemizzare.
Un’altra scelta potenziale è quella di proteggere l’azoto come un ammide, ma gli ammidi di scissione possono richiedere condizioni troppo dure. Inoltre, dal momento che stiamo cercando di forgiare un legame ammidico (peptide) qui comunque, potremmo avere problemi di selettività con la sua rimozione – distruggendo il villaggio per salvarlo.
Mate! Usa un carbammato, amico!
La scelta più popolare di gruppo di protezione per l’azoto amminico è il gruppo funzionale carbammato. Un carbammato sembra il figlio bastardo di un estere e un’ammide, con N e O che affiancano un carbonile.
L’azoto di un carbammato è relativamente non nucleofilo, e inoltre, i carbammati sono:
- facilmente installati sull’azoto
- inerti ad un’ampia varietà di condizioni di reazione
- facilmente rimossi senza influenzare i gruppi ammidici esistenti
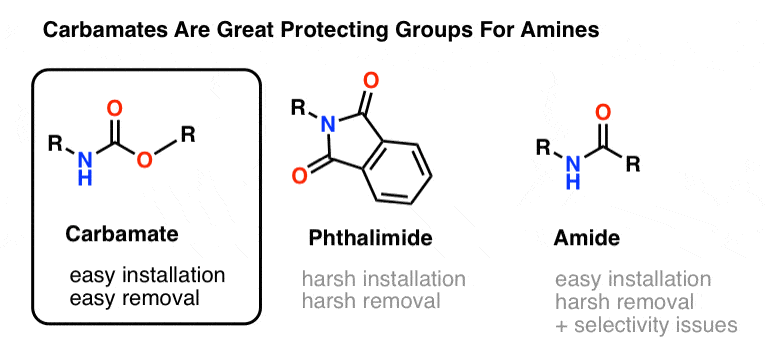
Questo li rende perfetti per i nostri scopi.
Boc e CBz sono le ginocchia delle api
Due gruppi di protezione dei carbammati popolari sono Boc (t-Butyloxycarbonyl) e CBz (carboxybenzyl).
Per i nostri scopi, questi due gruppi di protezione possono essere pensati come più o meno equivalenti, in quanto entrambi possono essere utilizzati efficacemente per la sintesi peptidica.
La differenza chiave è davvero in come vengono rimossi (cioè il passo di “deprotezione”). Scegliere tra l’uno e l’altro diventa cruciale quando si ha una molecola complessa con più gruppi di protezione; questo rientra nella categoria della “strategia sintetica avanzata”, che è più un argomento per Org 3.
Installazione e rimozione del gruppo di protezione “Boc”
Il gruppo Boc è solitamente installato con “Boc2O” (a volte indicato come “Boc anidride”), e viene rimosso con l’acido. La scelta usuale è l’acido trifluoroacetico (TFA) “puro” (cioè non diluito), che toglie i gruppi Boc in modo molto pulito, liberando CO2 e alcol t-butilico.
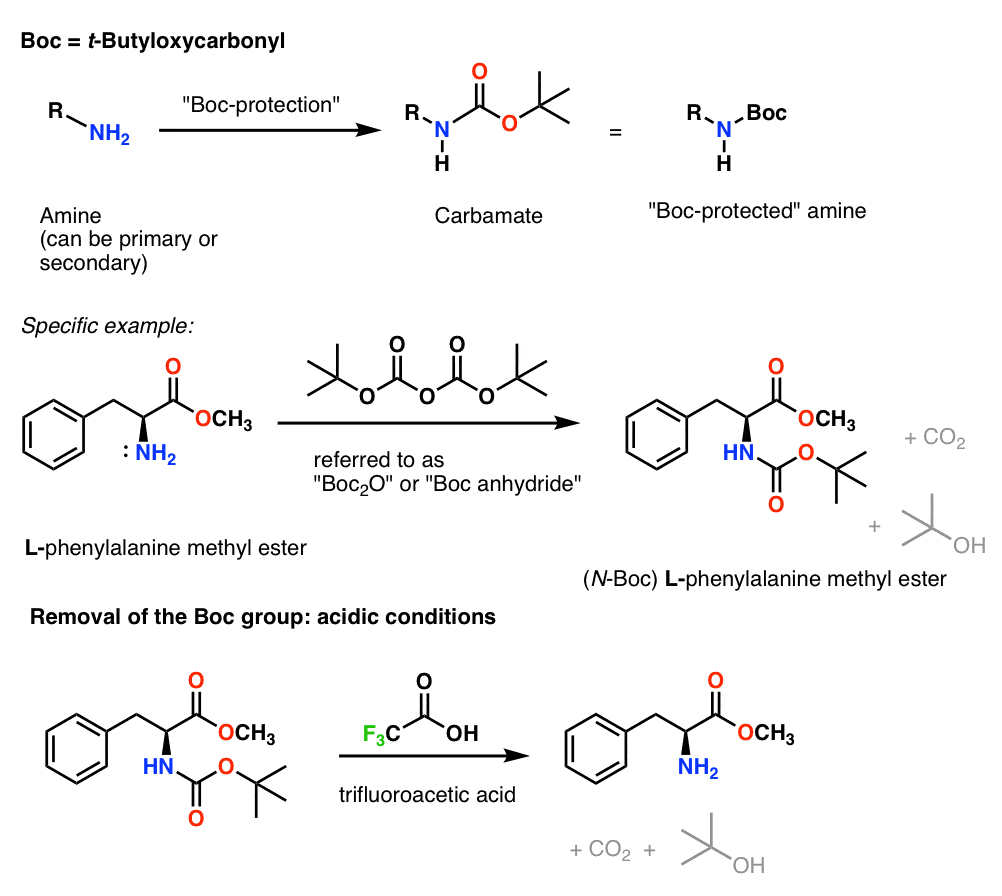
Installazione e rimozione del gruppo protettivo CBz (o “Z”) Carbamato
Il gruppo Cbz (a volte ulteriormente abbreviato come “Z”) può essere installato con CbzCl e base leggera, e viene solitamente rimosso tramite idrogenazione catalitica (Pd-C/H2). Questo è estremamente delicato e ha il vantaggio di avvenire a pH neutro, lasciando i gruppi funzionali sensibili all’acido o alla base da soli.
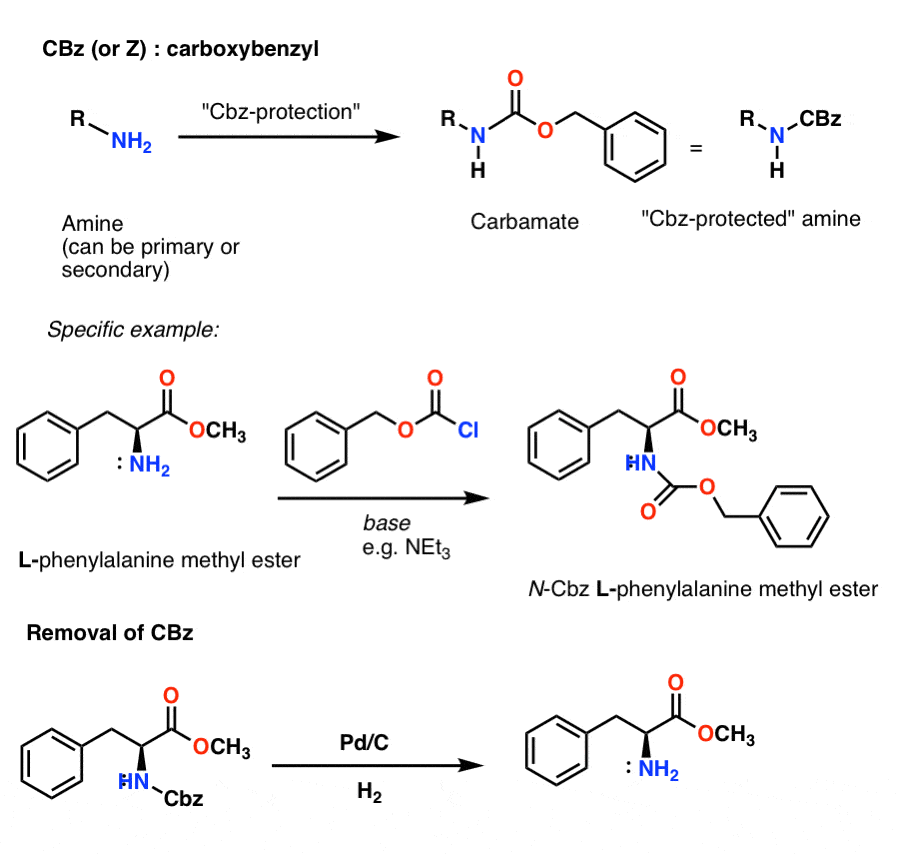
Una semplice sintesi peptidica usando gruppi di protezione carbammati
Torniamo alla sintesi peptidica e applichiamo questa strategia del gruppo di protezione per fare Gly-Ala.
Partiamo con un aminoacido come la L-alanina. Trattando l’alanina con Boc2O, otteniamo la L-alanina protetta da N-Boc. Il passo successivo è quello di formare un cloruro acido utilizzando SOCl2. Una volta formato, aggiungiamo la nostra ammina (per esempio la L-valina) in presenza di una base in eccesso, formando il nostro legame ammidico chiave. Il passo finale per dare il dipeptide è quello di deproteggere l’ammina protetta da Boc con acido trifluoroacetico (TFA), e voilà, abbiamo il nostro dipeptide.
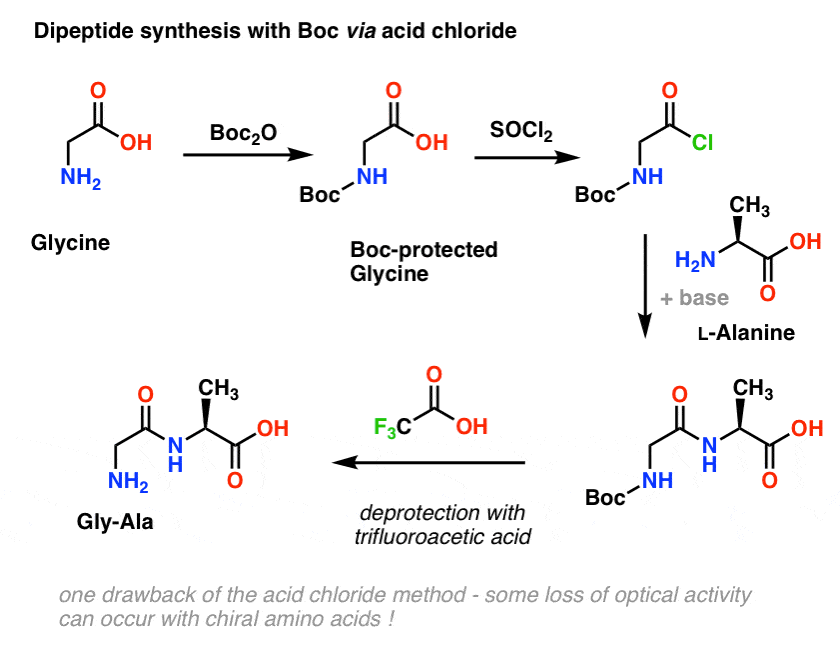
Anche se questo metodo potrebbe essere buono sulla carta, un problema dell’uso dei cloruri acidi in pratica è che gli amminoacidi chirali spesso perdono la loro purezza ottica attraverso questo metodo, un processo talvolta indicato come “racemizzazione”, ma più correttamente chiamato “epimerizzazione” (tecnicamente più corretto, perché un idrogeno su un centro chirale è invertito)
Siccome la chiralità degli aminoacidi è essenziale per la loro funzione biologica, un protocollo leggermente più mite è generalmente utilizzato che impiega DCC o un reagente di accoppiamento simile.
Qui, trattiamo la glicina protetta da Boc con DCC per attivare l’acido carbossilico. Poi aggiungiamo il nostro amminoacido nucleofilo (L-alanina) che forma il dipeptide. Se vogliamo isolare il dipeptide Gly-Ala a questo punto, possiamo rimuovere il gruppo Boc con TFA.
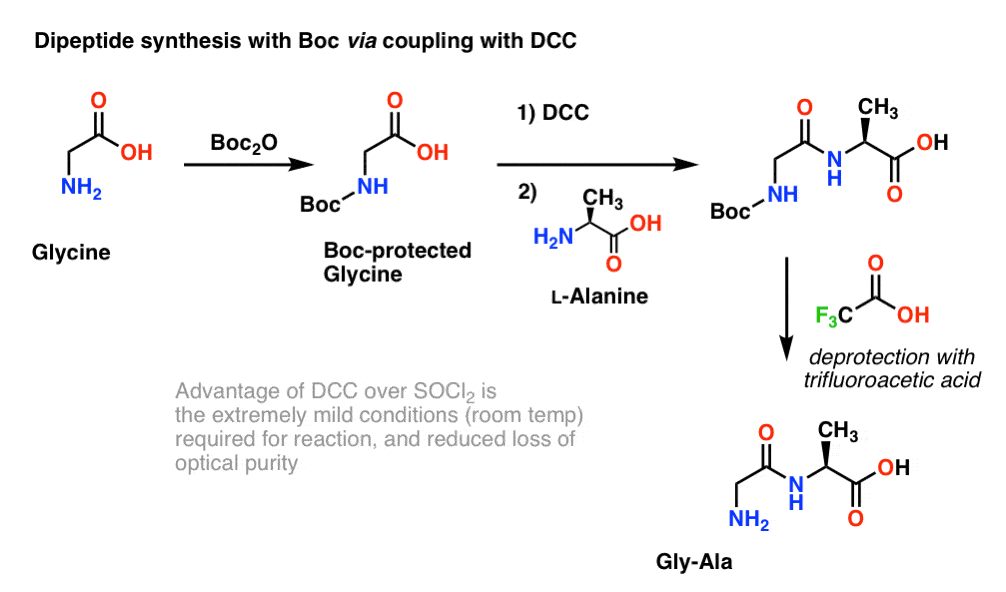
(nota su questo schema)
It Keeps Going…
Nota che se volessimo fare un tri-peptide, possiamo continuare ad eseguire cicli di aggiunta di DCC (per attivare l’acido carbossilico) seguito dall’aggiunta di nuovi aminoacidi, costruendo il peptide una unità alla volta!
C’è un metodo particolarmente efficace per costruire peptidi più lunghi sperimentato da Bruce Merrifield (e applicato nella sintesi dell’insulina, tra gli altri) chiamato sintesi peptidica in fase solida, che copriremo la prossima volta che saremo su questo argomento.
Note
Nota 1. Simile alla vecchia barzelletta sull’economista che propone un piano per uscire da un’isola deserta:
“Supponiamo di avere una barca”.
La glicina (come tutti gli aminoacidi) è essa stessa uno zwitterione. Il trattamento della glicina con SOCl2 dovrebbe produrre il cloruro acido con un’ammina protonata. Questo dovrebbe essere relativamente stabile in soluzione finché non viene aggiunta nessuna base.
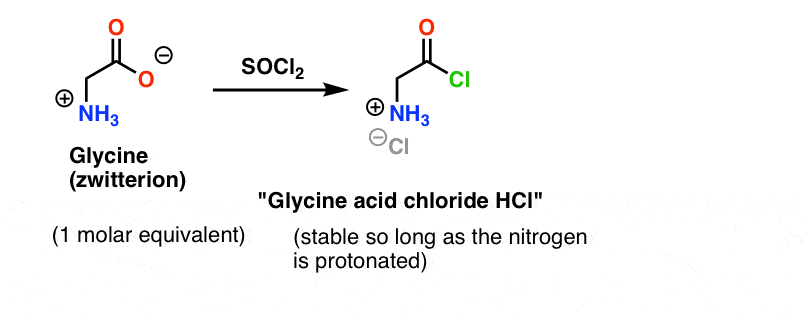
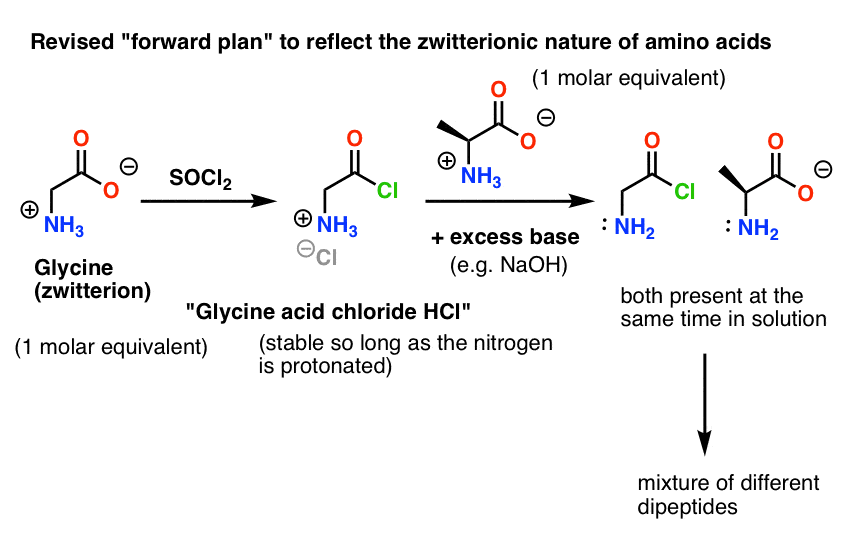
Ecco il problema. Poiché il nucleofilo del nostro aminoacido (l’alanina) è anche zwitterionico, nessuna reazione può avvenire finché non si aggiunge una base in eccesso per liberare una coppia solitaria sull’azoto dell’alanina. Dopo l’aggiunta della base, abbiamo il “cloruro acido di glicina” e l’alanina insieme in soluzione. Non c’è una differenza apprezzabile nella nucleofilia tra i nitrogeni di queste due specie, e ognuno di loro competerà per reagire con il nucleofilo cloruro acido, portando a una miscela di Gly-Ala e Gly-GlyCl, e il Gly-GlyCl può poi reagire ulteriormente con i vari nucleofili preimpostati in soluzione per dare tri-, tetra- e peptidi superiori.
Nota 2. John Sheehan, che abbiamo incontrato prima come l’inventore di DCC sulla strada per il primo a sintetizzare la penicillina, anche fatto ftalil-protetto Gly-Gly attraverso una sintesi Gabriel:
Riferimento qui (JACS, 1949, 71, 1856)
Nota 3. Un altro problema con l’uso di gruppi di protezione ammide è la formazione di azlactone, che può portare a epimerizzazione di amminoacidi chirali. Vedi anche questo problema impostato.
Nota 4. “Gruppi protettivi ortogonali”. Nella pianificazione sintetica è spesso di fondamentale importanza avere gruppi di protezione che sono rimovibili in condizioni nettamente diverse. Questa proprietà è spesso indicata come “ortogonalità”
Per esempio nel seguente dipeptide abbiamo due diversi gruppi protettivi sull’azoto – uno Boc e uno CBz. Selezionando gruppi di protezione “ortogonali”, ogni azoto è indirizzabile – possiamo scegliere quale gruppo di protezione rimuovere, e la nostra sintesi può procedere da lì. Questo evita di trovarci in una situazione in cui abbiamo due ammine non protette e dobbiamo contare sul fatto che una sia più reattiva dell’altra. Questi approcci funzionano molto raramente!
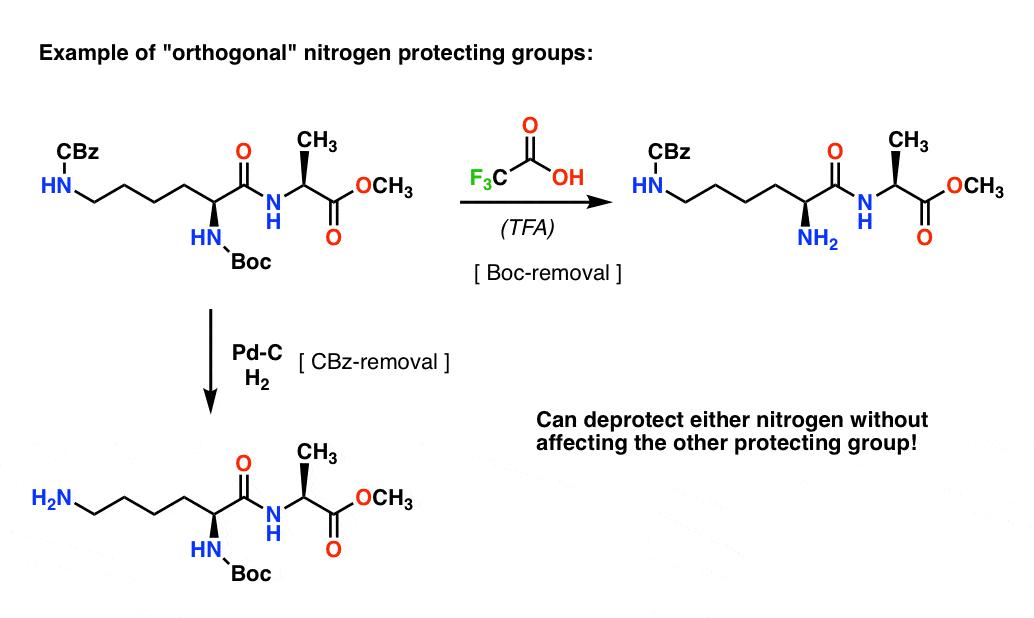
Una nota – per semplicità qui l’alanina è rappresentata con un acido carbossilico libero, ma un approccio leggermente migliore sarebbe quello di usare l’estere metilico dell’alanina per evitare qualsiasi auto-accoppiamento tra l’ammina libera dell’alanina e l’acido carbossilico libero.
Mate…
(Avanzato) Riferimenti e ulteriori letture
I carbammati sono utili come gruppi protettivi per le ammine, e i più comunemente usati sono -Boc, -Cbz, e -Fmoc.
- Über ein allgemeines Verfahren der Peptid-Synthese
Max Bergmann e Leonidas Zervas
Ber. 1932, 65 (7), 1192-1201
DOI: 10.1002/cber.19320650722
Il gruppo di protezione -Cbz (carbossibenzile) fu usato per la prima volta da Max Bergmann e Leonidas Zervas nel 1932 per la sintesi dei peptidi, ed è talvolta abbreviato “-Z” in onore di Zervas. - RIMOZIONE DI GRUPPI PROTETTIVI DI t-BUTILE E t-BUTOSSICARBONILE CON ACIDO TRIFLUOROACETICO
Meccanismi, formazione di biprodotti e valutazione degli scavenger
Behrend F. Lundt, Nils L. Johansen, Aage Vølund, e Jan Markussen
J. Pept. Prot. Res. 1978, 12 (5), 258-268
DOI: 10.1111/j.1399-3011.1978.tb02896.x
In pratica, gli spazzini nucleofili (per esempio i tioli) sono solitamente aggiunti al cocktail acido (TFA) quando si deproteggia, poiché la deprotezione di Boc darà specie t-butiliche elettrofile (per esempio t-butil trifluoroacetato) che possono reagire con residui sensibili (per esempio Trp o Cys). - Un metodo di sintesi di lunghe catene peptidiche usando una sintesi di ossitocina come esempio
Miklos Bodanszky e Vincent du Vigneaud
Journal of the American Chemical Society 1959, 81 (21), 5688-5691
DOI: 1021/ja01530a040
Nella prima metà del XX secolo, la sintesi dei peptidi veniva fatta usando tecniche standard di chimica organica in fase di soluzione. Questo è ora conosciuto come LPPS (sintesi peptidica in fase liquida). du Vigneaud ha ricevuto il premio Nobel per la chimica nel 1955 per il suo lavoro nel mostrare che la sintesi peptidica poteva essere realizzata, usando la scelta corretta dei gruppi protettivi e delle strategie sintetiche. - LA FORMAZIONE TEMPORANEA DELL’ANELLO DI AZLATTONE NELLA RACEMIZZAZIONE DI DERIVATI ACILICI DI AMINOACIDI CON ANIDRIDE ACETICA
Vincent du Vigneaud e Curtis E. Meyer
Biol. Chem. 1932, 99:143-151
http://www.jbc.org/content/99/1/143.citation
Un altro problema con l’uso di gruppi protettivi ammidici è la formazione di azlattoni, che può portare all’epimerizzazione di amminoacidi chirali. - Un nuovo percorso sintetico per i peptidi
John C. Sheehan e Victor S. Frank
Journal of the American Chemical Society 1949, 71 (5), 1856-1861
DOI: 10.1021/ja01173a095
John Sheehan, l’inventore del DCC sulla via della prima sintesi della penicillina, realizzò anche il Gly-Gly protetto da ftalile attraverso una sintesi Gabriel. - Un nuovo metodo di formazione dei legami peptidici
John C. Sheehan e George P. Hess
Journal of the American Chemical Society 1955, 77 (4), 1067-1068
DOI: 1021/ja01609a099
Uno scritto originale sulla sintesi di legami peptidici/amidici usando il DCC. - Funzione 9-Fluorenylmethoxycarbonyl, un nuovo gruppo amino-protettivo sensibile alla base
Louis A. Carpino and Grace Y. Han
Journal of the American Chemical Society 1970, 92 (19), 5748-5749
DOI: 10.1021/ja00722a043 - 9-Fluorenylmethoxycarbonyl gruppo amino-protettivo
Louis A. Carpino and Grace Y. Han
The Journal of Organic Chemistry 1972 37 (22), 3404-3409
DOI: 10.1021/jo00795a005
La scoperta e lo sviluppo del gruppo di protezione -Fmoc per le ammine aggiunge un altro strato di ortogonalità alle strategie di protezione/deprotezione delle ammine. Il gruppo -Fmoc è base labile, e nella sintesi peptidica è tipicamente rimosso con il 20% di piperidina in DMF. Cbz viene rimosso per idrogenazione, -Boc rimosso con acido, e -Fmoc con base.