Le cellule T-regolatorie (Tregs), precedentemente note come cellule T suppressor, sono un sottoinsieme di cellule T con ruoli diretti sia nell’autoimmunità che nelle risposte agli agenti patogeni.
Le Tregs diminuiscono l’infiammazione attraverso la secrezione di citochine immunosoppressive (IL-10, TGF-b) e anche attraverso la soppressione diretta delle cellule T effettrici dell’infiammazione (come le cellule Th1 e Th17).
Le Tregs controllano e probabilmente prevengono le malattie autoimmuni contribuendo al mantenimento della tolleranza agli autoantigeni. Il beneficio terapeutico del trasferimento di Treg è ben stabilito nei modelli animali e gli sforzi per iniziare terapie Treg umane sono in corso per il trapianto e per i pazienti con diabete di tipo 1.
Data l’importanza di questo sottoinsieme unico di cellule T in così tante risposte immunitarie, molti ricercatori si sentono negligenti se immunofenotipizzano le loro popolazioni di cellule di interesse senza includere una misurazione Treg nel mix. Ma quantificare le Treg può essere complicato.
Per esempio: quali sono i migliori marcatori da usare? Come si fa a sapere con certezza che si stanno misurando vere cellule T soppressorie?
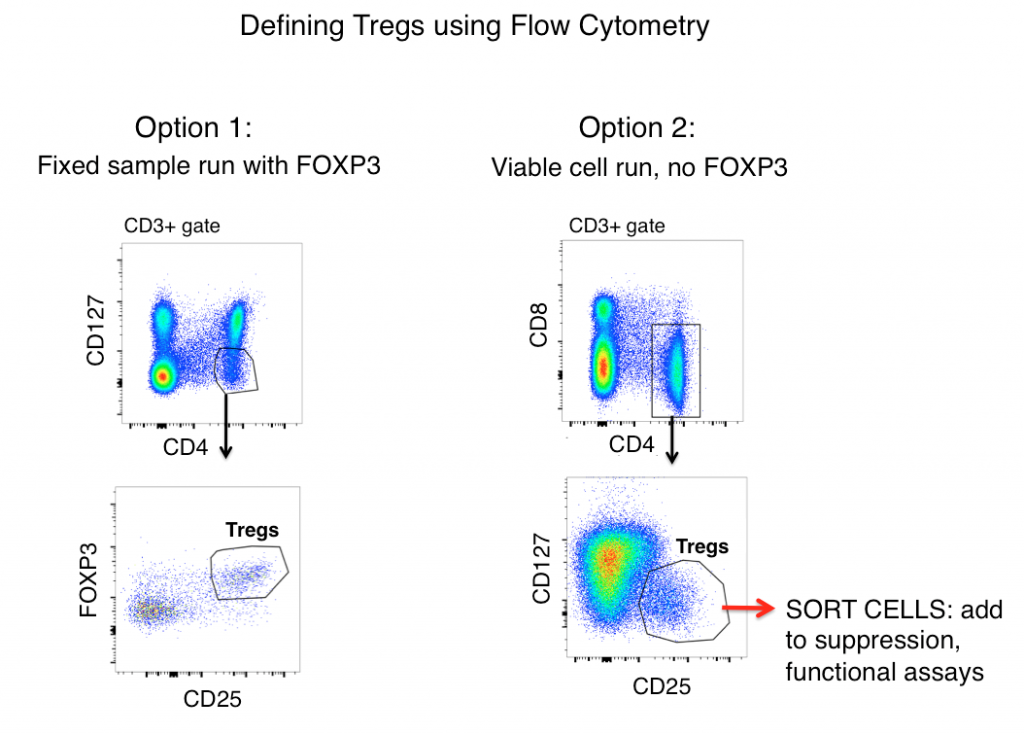
Strategie di gating per definire i Tregs con la citometria a flusso
La strategia standard di gating dei Treg per campioni sia murini che umani (dopo aver prima gating fuori i doppietti e gating su cellule vive) include gli antigeni CD3, CD4, CD25, FOXP3, e CD127.
Quando si guarda solo all’espressione dell’antigene, i Tregs sono spesso definiti come CD3+, CD4+, CD25hi, FOXP3+ e CD127lo (mostrato nella figura sottostante come opzione 1). Usando questi marcatori, una popolazione chiara è spesso visibile da campioni come splenociti di topo e PBMC umani.
Tuttavia, le cellule T attivate spesso up-regolano CD25, e l’espressione di FOXP3 è stata trovata su linee di cellule T ‘effettrici’ (non soppressive). Pertanto, quando ci si basa solo sulla fenotipizzazione in citometria di flusso per definire i Tregs, le cellule T infiammatorie potrebbero essere un lupo travestito da pecora (Treg) e portare a un’interpretazione errata dei dati.
Una cellula può sembrare un’anatra, ma fa il verso? La misurazione delle funzioni effettrici della tua possibile popolazione Treg aiuterà notevolmente a chiarire l’accuratezza della tua strategia di gating del flusso. Per determinare se le cellule che stai definendo come Tregs gli assomigliano funzionalmente, l’opzione 2 (vedi sotto) comprende l’omissione di FOXP3 dal tuo pannello, l’ordinamento delle cellule CD3+, CD4+, CD25hi, CD127lo, quindi la determinazione delle funzioni della tua popolazione ‘Treg’ tramite analisi delle citochine e/o saggi di co-cultura di soppressione con cellule T non-Treg (CD3+ CD4+ CD25-, CD127hi). Tipicamente FOXP3 non può essere incluso in pannelli in cui sono richieste cellule vitali dopo la selezione, in quanto è richiesta la colorazione intracellulare.
Definizione della crescente varietà di sottoinsiemi Treg
Ci sono molti tipi di Treg, inclusi tTregs, pTregs, e iTregs.
Per esempio, le tTreg (note anche come nTreg) sono generate nel timo e hanno un repertorio TcR che è orientato verso gli auto-peptidi. Un altro sapore, noto come pTregs, sono generati nella periferia, e iTregs sono indotti in cultura tramite TGF-b.
Ci sono creatori associati con questi vari sottoinsiemi Treg e dovrebbero essere considerati per l’inclusione in un pannello Treg anti-corpo se il subsetting è di interesse. Per esempio, negli esseri umani, CD39 è considerato un marcatore tTreg affidabile. Inoltre, sia nei topi che negli esseri umani, Helios è stato trovato per distinguere in modo affidabile i tTreg dai sottogruppi p e iTreg.
Definire una singola cellula come Treg – è possibile?
Una grande limitazione nel campo dei Treg è la mancanza di un saggio di soppressione della singola cellula.
Definire una singola cellula T come membro di un lignaggio di memoria distinto, come Th1, Th2 o Th17, può essere realizzato tramite l’analisi analitica con risoluzione della singola cellula, come la colorazione intracellulare delle citochine, poiché queste cellule sono definite principalmente, se non esclusivamente, da quali citochine producono.
Tuttavia, per dimostrare che una singola cellula è una Treg vogliamo idealmente essere in grado di quantificare che questa cellula scelta può sopprimere la funzione delle cellule T effettrici (o altri sottoinsiemi cellulari) in co-cultura. Attualmente l’unico modo per testare la funzione soppressiva dei Treg è in una coltura di massa, dove si può concludere che alcune (ma non tutte, forse nemmeno la maggior parte) delle cellule designate come Tregs sono soppressive.
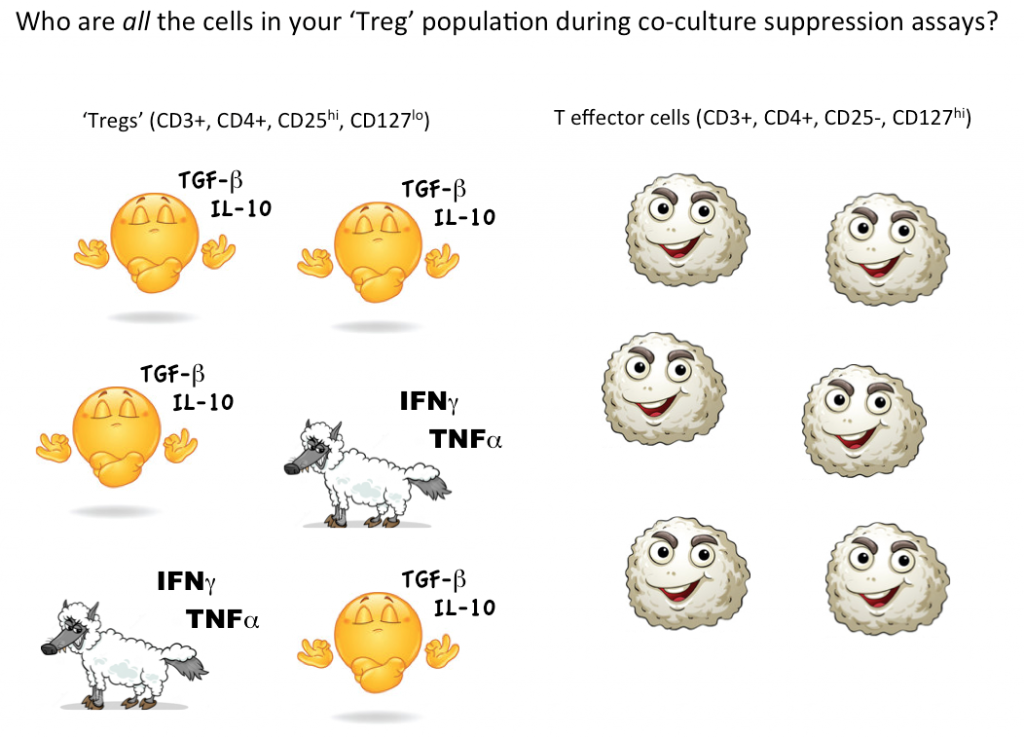
Pensando ancora ai potenziali lupi “cellule T effettrici” travestiti da pecore, non sappiamo quante cellule non soppressive, anche infiammatorie, si nascondono nella nostra strategia di gating dei Treg. L’utilizzo della citometria a flusso per la selezione di cellule vitali con marcatori coerenti con le Tregs, quindi il test funzionale per vedere se, come gruppo, le cellule definite dalla tua strategia di gating si comportano effettivamente come Tregs, è attualmente il modo migliore per quantificare le Tregs nel tuo campione.
Eseguendo le giuste strategie di gating per definire le Tregs mediante citometria a flusso e tenendo conto del crescente numero di sottopopolazioni Treg, è possibile individuare le popolazioni Treg di interesse. La chiave è testare funzionalmente queste popolazioni dopo averle identificate perché attualmente è difficile se non impossibile definire una singola cellula come Treg. Tuttavia, si stanno facendo progressi ogni giorno e alla fine sarà possibile etichettare correttamente le singole cellule Treg.
Per saperne di più sull’analisi delle cellule T e di altri tipi di cellule con la citometria a flusso, e per avere accesso a tutti i nostri materiali avanzati tra cui 20 video di formazione, presentazioni, libri di lavoro e l’iscrizione al gruppo privato, mettiti in lista d’attesa della Flow Cytometry Mastery Class.
