Nome generico: naftifine hydrochloride
Forma farmaceutica: crema
Medicamente rivisto da Drugs.com. Ultimo aggiornamento il 1 gennaio 2021.
- Panoramica
- Effetti collaterali
- Dosaggio
- Professionale
- Gravidanza
- Più
Indicazioni e uso per Naftifine crema
Naftifine cloridrato crema è indicato per il trattamento di tinea pedis interdigitale, tinea cruris, e tinea corporis causata dall’organismo Trichophyton rubrum.
Dosaggio e amministrazione della crema Naftifine
Solo per uso topico. Naftifine cloridrato crema non è per uso oftalmico, orale o intravaginale. Applicare un sottile strato di naftifina cloridrato crema una volta al giorno per le aree colpite più un margine di ½ pollice di pelle sana circostante per 2 settimane.
Forme di dosaggio e forza
Ogni grammo contiene 20 mg di naftifina cloridrato (2%) in un bianco a base bianco sporco.
Contraindicazioni
Nessuno
Avvertenze e precauzioni
Reazioni avverse locali
Interrompere il trattamento se si sviluppa irritazione o sensibilità con l’uso di naftifina cloridrato crema. Dirigere i pazienti a contattare il loro medico se queste condizioni si sviluppano dopo l’uso di naftifina cloridrato crema.
Reazioni avverse
Esperienza negli studi clinici
Perché gli studi clinici sono condotti in condizioni molto diverse, i tassi di reazione avversa osservati negli studi clinici di un farmaco non possono essere direttamente comparati ai tassi negli studi clinici di un altro farmaco e possono non riflettere i tassi osservati nella pratica clinica.
Durante gli studi clinici, 903 soggetti sono stati esposti a naftifina 1% e 2% crema. Un totale di 564 soggetti con tinea pedis interdigitale, tinea cruris, o tinea corporis sono stati trattati con naftifina cloridrato crema.
In due studi randomizzati, controllati con veicolo (400 soggetti sono stati trattati con naftifina cloridrato crema). La popolazione aveva da 12 a 88 anni, principalmente maschi (79%), 48% caucasici, 36% neri o afroamericani, 40% ispanici o latini e aveva prevalentemente tinea pedis interdigitale o tinea cruris. La maggior parte dei soggetti ha ricevuto dosi una volta al giorno, per via topica, per 2 settimane per coprire le aree cutanee colpite più un margine di mezzo pollice di pelle sana circostante. Nei due studi controllati con veicolo, il 17,5% dei soggetti trattati con naftifina cloridrato crema ha sperimentato una reazione avversa rispetto al 19,3% dei soggetti trattati con veicolo. La reazione avversa più comune (maggiore o uguale all’1%) è il prurito. La maggior parte delle reazioni avverse erano di gravità lieve. L’incidenza delle reazioni avverse nella popolazione trattata con naftifina cloridrato crema non era significativamente diversa dalla popolazione trattata con il veicolo.
In un terzo studio randomizzato, controllato con il veicolo, 116 soggetti pediatrici con tinea corporis sono stati trattati con naftifina cloridrato crema. La popolazione era di età superiore o uguale a 2 a meno di 18 anni (età media di 9 anni), prevalentemente maschi (61%), 47% bianchi, 51% neri o afroamericani, 92% ispanici o latini, e infetti da tinea corporis. La crema Naftifine hydrochloride è stata applicata topicamente una volta al giorno per 2 settimane su tutte le aree del corpo colpite dalla tinea corporis più un margine di mezzo pollice di pelle sana che circonda le lesioni colpite. L’incidenza di reazioni avverse nella popolazione trattata con naftifina cloridrato crema non era significativamente diversa da quella della popolazione trattata con il veicolo.
In due studi di farmacocinetica e sicurezza pediatrici in aperto, 49 soggetti pediatrici da 2 a meno di 18 anni di età con tinea pedis interdigitale, tinea cruris e tinea corporis hanno ricevuto naftifina cloridrato crema. L’incidenza delle reazioni avverse nella popolazione pediatrica era simile a quella osservata nella popolazione adulta.
Esperienza post-marketing
Le seguenti reazioni avverse sono state identificate durante l’uso post-approvazione di naftifina cloridrato: arrossamento/irritazione, infiammazione, macerazione, gonfiore, bruciore, vesciche, drenaggio sieroso, croste, mal di testa, vertigini, leucopenia, agranulocitosi.
Perché queste reazioni sono riportate volontariamente da una popolazione di dimensioni incerte, non è sempre possibile stimare in modo affidabile la loro frequenza o stabilire una relazione causale all’esposizione al farmaco.
USO IN POPOLAZIONI SPECIFICHE
Gravidanza
Riassunto del rischio
Non ci sono dati disponibili con la naftifina cloridrato crema in donne incinte per informare il rischio associato al farmaco per difetti di nascita maggiori e aborto spontaneo. Negli studi sulla riproduzione animale, non sono stati osservati effetti avversi sullo sviluppo embriofetale a dosi orali somministrate durante il periodo di organogenesi fino a 18 volte la dose massima raccomandata per l’uomo (MRHD) nei ratti gravidi o a dosi sottocutanee somministrate durante il periodo di organogenesi fino a 2 volte la MRHD nei ratti gravidi o 4 volte la MRHD nei conigli gravidi.
Il rischio di fondo stimato di difetti di nascita maggiori e aborto spontaneo per la popolazione indicata è sconosciuto. Tutte le gravidanze hanno un rischio di fondo di difetti alla nascita, perdita o altri esiti avversi. Nella popolazione generale degli Stati Uniti, il rischio di fondo stimato di difetti di nascita maggiori e di aborto spontaneo nelle gravidanze clinicamente riconosciute è dal 2% al 4% e dal 15% al 20%, rispettivamente.
Dati
Dati sugli animali
Studi sullo sviluppo embriofetale sistemico sono stati condotti su ratti e conigli. Per il confronto delle dosi animali con quelle umane basato sul confronto della superficie corporea (mg/m2), l’MRHD è fissato a 8 g di crema al 2% al giorno (2,67 mg/kg/giorno per un individuo di 60 kg).
Dosi orali di 30, 100 e 300 mg/kg/giorno di naftifina cloridrato sono state somministrate durante il periodo di organogenesi a ratti femmina gravidi. Nessun effetto legato al trattamento sullo sviluppo embriofetale è stato notato a dosi fino a 300 mg/kg/giorno (18 volte l’MRHD). Dosi sottocutanee di 10 e 30 mg/kg/giorno di naftifina cloridrato sono state somministrate durante il periodo dell’organogenesi a ratti femmine gravide. Nessun effetto legato al trattamento sullo sviluppo embriofetale è stato notato a 30 mg/kg/giorno (2 volte l’MRHD). Dosi sottocutanee di 3, 10 e 30 mg/kg/giorno di naftifina cloridrato sono state somministrate durante il periodo dell’organogenesi a conigli femmine gravide. Nessun effetto legato al trattamento sullo sviluppo embriofetale è stato notato a 30 mg/kg/giorno (4 volte l’MRHD).
È stato condotto uno studio sullo sviluppo peri- e post-natale nei ratti. Dosi orali di 30, 100 e 300 mg/kg/giorno di cloridrato di naftifina sono state somministrate a ratti femmina dal 14° giorno di gestazione al 21° giorno di lattazione. A 300 mg/kg/giorno (18 volte l’MRHD) è stato osservato un ridotto aumento del peso corporeo delle femmine durante la gestazione e della prole durante l’allattamento. Nessuna tossicità per lo sviluppo è stata notata a 100 mg/kg/giorno (6 volte l’MRHD).
Allattamento
Riassunto del rischio
Non ci sono informazioni disponibili sulla presenza di naftifina cloridrato crema nel latte umano, sugli effetti del farmaco sul bambino allattato al seno o sugli effetti del farmaco sulla produzione di latte. La mancanza di dati clinici durante l’allattamento preclude una chiara determinazione del rischio della naftifina cloridrato crema per un bambino durante l’allattamento; pertanto, lo sviluppo e i benefici per la salute dell’allattamento al seno devono essere considerati insieme al bisogno clinico della madre per la naftifina cloridrato crema e qualsiasi potenziale effetto avverso sul bambino allattato al seno dalla naftifina cloridrato crema o dalla condizione materna sottostante.
Uso pediatrico
La sicurezza e l’efficacia di naftifina cloridrato crema sono state stabilite in pazienti pediatrici dai 12 anni in su con tinea pedis interdigitale e tinea cruris e dai 2 anni in su con tinea corporis.
L’uso di naftifina cloridrato crema in questi gruppi di età è supportato da prove da studi adeguati e ben controllati negli adulti e nei bambini, con ulteriori dati di sicurezza e PK da due studi in aperto condotti su 49 soggetti pediatrici esposti a naftifina cloridrato crema.
Sicurezza ed efficacia di naftifina cloridrato crema nel trattamento di tinea cruris e tinea pedis interdigitale in pazienti pediatrici di età inferiore ai 12 anni non sono stati stabiliti. La sicurezza e l’efficacia di naftifina cloridrato crema nel trattamento della tinea corporis in pazienti pediatrici di età inferiore ai 2 anni non sono state stabilite.
Uso geriatrico
Gli studi clinici sulla naftifina cloridrato crema non hanno incluso un numero sufficiente di soggetti dai 65 anni in su per determinare se essi rispondono diversamente dai soggetti più giovani.
Naftifina crema Descrizione
Naftifina cloridrato crema, USP è una crema da bianca a biancastra solo per uso topico. Ogni grammo contiene 20 mg di naftifina cloridrato, USP, (2%), un composto antifungino sintetico di allilamina.
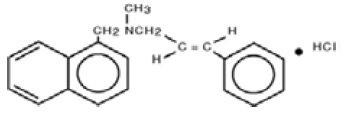
Chimicamente, la naftifina HCl è (E)-N-Cinnamyl-N-methyl-1-napthalenemethylamine idrocloride.
La formula molecolare è C21H21N-HCl con un peso molecolare di 323,86.
La formula strutturale della naftifina cloridrato, USP è:
Naftifina cloridrato crema, USP contiene i seguenti ingredienti inattivi: alcool benzilico, alcool cetilico, cera di esteri cetilici, isopropil miristato, polisorbato 60, acqua purificata, idrossido di sodio, sorbitan monostearato, e alcool stearilico. L’acido cloridrico può essere aggiunto per regolare il pH.
Naftifina crema – Farmacologia clinica
Meccanismo d’azione
Naftifina cloridrato crema è un farmaco topico antifungino.
Farmacodinamica
La farmacodinamica di naftifina cloridrato crema non è stata stabilita.
Farmacocinetica
Studi di biodisponibilità in vitro e in vivo hanno dimostrato che la naftifina penetra nello strato corneo in concentrazione sufficiente per inibire la crescita dei dermatofiti.
La farmacocinetica della naftifina cloridrato crema è stata valutata dopo l’applicazione topica una volta al giorno per 2 settimane a 21 soggetti adulti, sia maschi che femmine, con tinea pedis e tinea cruris. La quantità totale mediana di crema applicata è stata di 6,4 g (da 5,3 g a 7,5 g) al giorno. I risultati hanno mostrato che l’esposizione sistemica (cioè la concentrazione massima (Cmax) e l’area sotto la curva dal tempo 0 a 24 ore (AUC0-24) alla naftifina è aumentata durante le 2 settimane di trattamento in tutti i 21 soggetti. La media geometrica (coefficiente di variazione o CV%) dell’AUC0-24 era 117 (41,2) ng*hr/mL il giorno 1, e 204 (28,5) ng*hr/mL il giorno 14. La media geometrica (CV%) Cmax era 7 ng/mL (55,6) il giorno 1 e 11 ng/mL (29,3) il giorno 14. Il tempo mediano alla Cmax (Tmax) è stato di 8 ore (da 4 a 24 ore) il giorno 1 e di 6 ore (da 0 a 16 ore) il giorno 14. L’accumulo dopo 14 giorni di applicazione topica è stato inferiore a due volte. Le concentrazioni di base sono generalmente aumentate durante il periodo di studio di 14 giorni. La naftifina ha continuato ad essere rilevata nel plasma in 13/21 (62%) soggetti il giorno 28, le concentrazioni plasmatiche medie (deviazione standard o SD) erano 1,6 ± 0,5 ng/mL (range sotto il limite di quantificazione (BLQ) a 3 ng/mL). Nello stesso studio farmacocinetico condotto su pazienti con tinea pedis e tinea cruris, la frazione mediana della dose escreta nelle urine durante il periodo di trattamento è stata dello 0,0016% al giorno 1 contro lo 0,0020% al giorno 14.
In un secondo studio che ha arruolato 22 soggetti, la farmacocinetica della naftifina cloridrato crema è stata valutata in 20 soggetti pediatrici di età compresa tra 13 e meno di 18 anni con tinea pedis e tinea cruris. I soggetti sono stati trattati con una dose mediana di 8,1 g (range da 6,6 g a 10,1 g) applicata sulle aree interessate una volta al giorno per 2 settimane. I risultati hanno mostrato che l’esposizione sistemica è aumentata durante il periodo di trattamento. La media geometrica (CV%) AUC0-24 era 138 (50,2) ng*hr/mL il giorno 1, e 192 (74,9) ng*hr/mL il giorno 14. La media geometrica (CV%) Cmax era 9,21 ng/mL (48,4) il giorno 1 e 12,7 ng/mL (67,2) il giorno 14. La frazione mediana della dose escreta nelle urine durante il periodo di trattamento è stata dello 0,0030% il giorno 1 e dello 0,0033% il giorno 14.
Un terzo studio ha valutato la farmacocinetica della naftifina cloridrato crema in 27 soggetti pediatrici da 2 a meno di 12 anni di età con tinea corporis almeno moderata. I soggetti sono stati divisi in gruppi più giovani (da 2 a meno di 6 anni, 17 soggetti) e più grandi (da 6 a meno di 12 anni, 10 soggetti). Dosi mediane di 1,3 g (da 1 g a 3,1 g) e 2,3 g (da 2,2 g a 4,2 g) sono state applicate una volta al giorno per 2 settimane nei gruppi più giovani e più anziani, rispettivamente, sull’area interessata più un margine di mezzo pollice. Le valutazioni farmacocinetiche del plasma e delle urine sono state condotte il giorno 1 solo nel gruppo più anziano e il giorno 14 in entrambi i gruppi. Tutti i soggetti hanno mostrato livelli misurabili di naftifina nel plasma dopo l’applicazione topica di naftifina cloridrato crema. A seguito di una singola dose il giorno 1 nei soggetti da 6 a meno di 12 anni di età, i valori medi geometrici (CV%) di Cmax e AUC0-24 sono stati rispettivamente 3,60 (76,6) ng/mL e 49,8 (64,4) ng*h/mL. Il giorno 14 in questo gruppo, la Cmax e l’AUC0-24 erano 3,31 (51,2) ng/mL e 52,4 (49,2) ng*h/mL, rispettivamente. Nei soggetti da 2 a meno di 6 anni di età il giorno 14, la Cmax e l’AUC0-24 erano 3,98 (186) ng/mL e 54,8 (150) ng*h/mL, rispettivamente. Nel gruppo più anziano di soggetti dai 6 ai 12 anni di età, le esposizioni sistemiche (sia Cmax che AUC0-24) nei giorni 1 e 14 erano comparabili. La frazione mediana della dose escreta nelle urine nelle 24 ore successive alle applicazioni del farmaco il giorno 1 e il giorno 14 è stata rispettivamente dello 0,0029% e dello 0,0014%.
Microbiologia
Anche se l’esatto meccanismo di azione contro i funghi non è noto, la naftifina cloridrato sembra interferire con la biosintesi degli steroli inibendo l’enzima squalene2, 3-epossidasi.Questa inibizione dell’attività enzimatica si traduce in una diminuzione della quantità di steroli, soprattutto ergosterolo, e un corrispondente accumulo di squalene nelle cellule.
Meccanismo di resistenza
Ad oggi, un meccanismo di resistenza alla naftifina non è stato identificato.
La naftifina ha dimostrato di essere attiva contro la maggior parte degli isolati dei seguenti funghi, sia in vitro che in infezioni cliniche, come descritto nella sezione INDICAZIONI E USO:
Trichophyton rubrum
Tossicologia non clinica
Carcinogenesi, mutagenesi, compromissione della fertilità
In uno studio di carcinogenicità dermica di 2 anni, la naftifina cloridrato crema è stata somministrata a ratti Sprague-Dawley a dosi topiche di 1%, 2% e 3% (10, 20, e 30 mg/kg/giorno di naftifina cloridrato). Non sono stati osservati tumori correlati al farmaco in questo studio fino alla dose più alta valutata in questo studio di 30 mg/kg/giorno (12 volte l’MRHD basata sul confronto dell’AUC).
Il cloridrato di naftifina non ha rivelato alcuna prova di potenziale mutageno o clastogenico sulla base dei risultati di due test di genotossicità in vitro (test di Ames e test di aberrazione cromosomica su cellule ovariche di criceto cinese) e un test di genotossicità in vivo (test del micronucleo del midollo osseo di topo).
La somministrazione orale di cloridrato di naftifina ai ratti, durante l’accoppiamento, la gestazione, il parto e l’allattamento, non ha dimostrato effetti sulla crescita, la fertilità o la riproduzione, a dosi fino a 100 mg/kg/giorno (6 volte il MRHD).
Studi clinici
Tinea Cruris
La naftifina cloridrato crema è stata studiata per la sicurezza e l’efficacia in uno studio multicentrico randomizzato, in doppio cieco, controllato con veicolo, in 146 soggetti con tinea cruris sintomatica e positiva alla coltura dei dermatofiti. I soggetti sono stati randomizzati a ricevere naftifina cloridrato crema o veicolo. I soggetti hanno applicato la crema al cloridrato di naftifina o il veicolo sull’area interessata più un margine di mezzo pollice di pelle sana che circonda l’area interessata una volta al giorno per 2 settimane. Segni e sintomi della tinea cruris (presenza o assenza di eritema, prurito e desquamazione) sono stati valutati, e l’esame KOH e la coltura dei dermatofiti sono stati eseguiti all’endpoint primario di efficacia alla settimana 4.
L’età media della popolazione dello studio era di 47 anni e l’87% erano maschi e il 43% erano bianchi. Al basale, è stato confermato che i soggetti avevano segni e sintomi di tinea cruris, esame KOH positivo e presenza confermata di dermatofiti in base ai risultati della coltura da un laboratorio micologico centrale. L’analisi della popolazione intention-to-treat era un confronto delle proporzioni di soggetti con una cura completa alla visita della settimana 4 (vedi tabella 1). La cura completa è stata definita come cura clinica (assenza di eritema, prurito e desquamazione) e cura micologica (KOH negativo e coltura di dermatofiti).
La percentuale di soggetti con cura clinica e la percentuale di soggetti con cura micologica alla settimana 4 sono presentati individualmente nella tabella 1 qui sotto.
|
Endpoint |
Naftifine Hydrochloride Cream, 2% |
Veicolo |
| N=75 | N=71 | |
|
Curea completa |
19 (25%) |
2 (3%) |
|
Trattamento efficaceb |
45 (60%) |
7 (10%) |
|
Cura micologica |
54 (72%) |
11 (16%) |
| a. La cura completa è un endpoint composito di cura micologica e clinica. La cura clinica è definita come l’assenza di eritema, prurito e desquamazione (grado 0). | ||
| b. Un trattamento efficace è una preparazione KOH negativa e una coltura di dermatofiti negativa, eritema, desquamazione e prurito di grado 0 o 1 (assente o quasi assente). | ||
| c. La cura micologica è definita come una coltura KOH e dermatofita negativa. | ||
Tinea Pedis interdigitale
La crema Naftifine hydrochloride è stata studiata per l’efficacia in uno studio multicentrico randomizzato, in doppio cieco, controllato con veicolo, in 217 soggetti con tinea pedis interdigitale sintomatica e positiva alla coltura dermatofita. I soggetti sono stati randomizzati a ricevere naftifina cloridrato crema o veicolo. I soggetti hanno applicato la crema al cloridrato di naftifina o il veicolo sull’area interessata del piede più un margine di mezzo pollice di pelle sana che circonda l’area interessata una volta al giorno per 2 settimane. Segni e sintomi della tinea pedis interdigitale (presenza o assenza di eritema, prurito e desquamazione) sono stati valutati e l’esame KOH e la coltura dei dermatofiti sono stati eseguiti all’endpoint primario di efficacia alla settimana 6.
L’età media della popolazione dello studio era di 42 anni e il 71% era maschio e il 57% bianco. Al basale, è stato confermato che i soggetti avevano segni e sintomi di tinea pedis interdigitale, un esame KOH positivo e una coltura di dermatofiti confermata. L’endpoint primario di efficacia era la proporzione di soggetti con una cura completa alla visita della settimana 6 (vedi tabella 2). La cura completa è stata definita come una cura clinica (assenza di eritema, prurito e desquamazione) e micologica (KOH negativo e coltura di dermatofiti).
I risultati di efficacia alla settimana 6, quattro settimane dopo la fine del trattamento, sono presentati nella seguente tabella 2. La crema al cloridrato di naftifina ha dimostrato una cura completa nei soggetti con tinea pedis interdigitale, ma la cura completa nei soggetti con solo tinea pedis di tipo mocassino non è stata dimostrata.
|
Endpoint |
Naftifine cloridrato crema, 2% |
Veicolo |
| N=147 | N=70 | |
|
Curea completa |
26 (18%) |
5 (7%) |
|
Trattamento efficaceb |
83 (57%) |
14 (20%) |
|
Cura micologica |
99 (67%) |
15 (21%) |
| a. La cura completa è un endpoint composito di cura micologica e clinica. La cura clinica è definita come assenza di eritema, prurito e desquamazione (grado 0). |
||
| b. Un trattamento efficace è una preparazione KOH negativa e una coltura di dermatofiti negativa, eritema, desquamazione e prurito di grado 0 o 1 (assente o quasi assente). | ||
| c. La cura micologica è definita come KOH e coltura di dermatofiti negativa. | ||
Tinea corporis
La naftifina cloridrato crema è stata studiata per la sicurezza e l’efficacia in uno studio multicentrico randomizzato, in doppio cieco, controllato con veicolo, in 184 soggetti con tinea corporis sintomatica e dermatofiti positivi alla coltura. I soggetti sono stati randomizzati a ricevere naftifina cloridrato crema o veicolo. I soggetti hanno applicato l’agente di studio su tutte le aree del corpo colpite da tinea corporis più un margine di mezzo pollice di pelle sana che circonda le lesioni colpite per due settimane. Segni e sintomi della tinea corporis (presenza o assenza di eritema, indurimento e prurito) sono stati valutati e l’esame KOH e la cultura dei dermatofiti sono stati eseguiti per la valutazione dell’endpoint primario di efficacia al giorno 21.
La popolazione dello studio era pediatrica (maggiore o uguale a 2 a meno di 18 anni di età) con un’età mediana di 9 anni (naftifina cloridrato crema) o 8 anni (veicolo); 61% dei soggetti erano maschi e 45% erano bianchi. Al basale, i soggetti sono stati confermati per avere segni e sintomi di tinea corporis, esame KOH positivo, e cultura dermatofita confermata. L’endpoint primario di efficacia era la proporzione di soggetti con una cura completa alla visita del giorno 21. La cura completa è stata definita come una cura clinica (assenza di eritema, indurimento e prurito su tutte le lesioni presenti al basale) e la cura micologica (KOH negativo e cultura dermatofita).
I risultati di efficacia al giorno 21, una settimana dopo la fine del trattamento, sono presentati nella tabella 3 di seguito.
|
Naftifine Hydrochloride Cream, 2% |
Veicolo |
|
|
Endpoint |
N=91 |
N=93 |
|
Curea completa |
42 (46%) | 26 (28%) |
|
Trattamento efficaceb |
53 (58%) |
32 (34%) |
|
Cura micologica |
57 (63%) | 36 (39%) |
| a. La cura completa è un endpoint composito di cura micologica e clinica. La cura clinica è definita come assenza di eritema, prurito e desquamazione (grado 0). |
||
| b. Una cura efficace è una preparazione KOH negativa e una coltura di dermatofiti negativa, eritema, indurimento e prurito di grado 0 o 1 (assente o lieve). | ||
| c. La cura micologica è definita come KOH negativo e coltura di dermatofiti. | ||
Come viene fornito/conservazione e manipolazione
Naftifine cloridrato crema, USP 2%, è una crema da bianca a biancastra fornita nel seguente formato:
Tubi da 45 grammi – NDC 70700-161-18
Tubi da 60 grammi – NDC 70700-161-17
Conservare la naftifina cloridrato crema a 25°C (77°F); sono consentite escursioni da 15° a 30°C (59° a 86°F).
Informazioni per il paziente
- Informare i pazienti che la naftifina cloridrato crema è solo per uso topico. La naftifina cloridrato crema non è destinata all’uso orale, intravaginale o oftalmico.
- Se si sviluppa irritazione o sensibilità con l’uso di naftifina cloridrato crema il trattamento deve essere interrotto e deve essere istituita una terapia appropriata. I pazienti devono essere indirizzati a contattare il loro medico se queste condizioni si sviluppano dopo l’uso di naftifina cloridrato crema.
Distribuito da:
Xiromed, LLC,
Florham Park, NJ 07932
Rev. 09/2020
PI-161-00
ETICHETTA DELLA CONFEZIONE SEZIONE PRINCIPALE DEL PANNELLO DI VISUALIZZAZIONE – Tubo da 45g

NDC 70700-161-18
Naftifine Crema, 2%
Xiromed, LLC
Solo per uso topico
Non per uso oftalmico, Uso orale o intravaginale
45 g
Solo per uso medico
ETICHETTA DELLA CONFEZIONE ETICHETTA PRINCIPALE SEZIONE PANORAMICA – Tubo da 60 g

NDC 70700-161-17
Naftifina Crema, 2%
Xiromed, LLC
Solo per uso topico
Non per uso oftalmico, Oral or Intravaginal Use
60 g
Rx Only
| NAFTIFINE HYDROCHLORIDE naftifine hydrochloride cream |
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
|
||||||||||||||||||||||||
Etichettatore – Xiromed, LLC (080228637)
Registrant – Xiromed Pharma España, S.L. (468835741)
Più informazioni su naftifine topical
- Effetti collaterali
- Durante la gravidanza o l’allattamento
- Informazioni sul dosaggio
- Prezzi & Buoni sconto
- En Español
- 7 recensioni
- Classe del farmaco: Antimicotici topici
Risorse per i consumatori
- Informazioni per i pazienti
- Naftifine Topical (lettura avanzata)
Risorse professionali
- Informazioni per la prescrizione
- Naftifine (Consigli professionali per i pazienti)
- Naftifine Gel (FDA)
Altre marche Naftin
Guide ai trattamenti correlati
- Tinea Pedis
- Tinea Corporis
- Tinea Cruris
Discorso medico