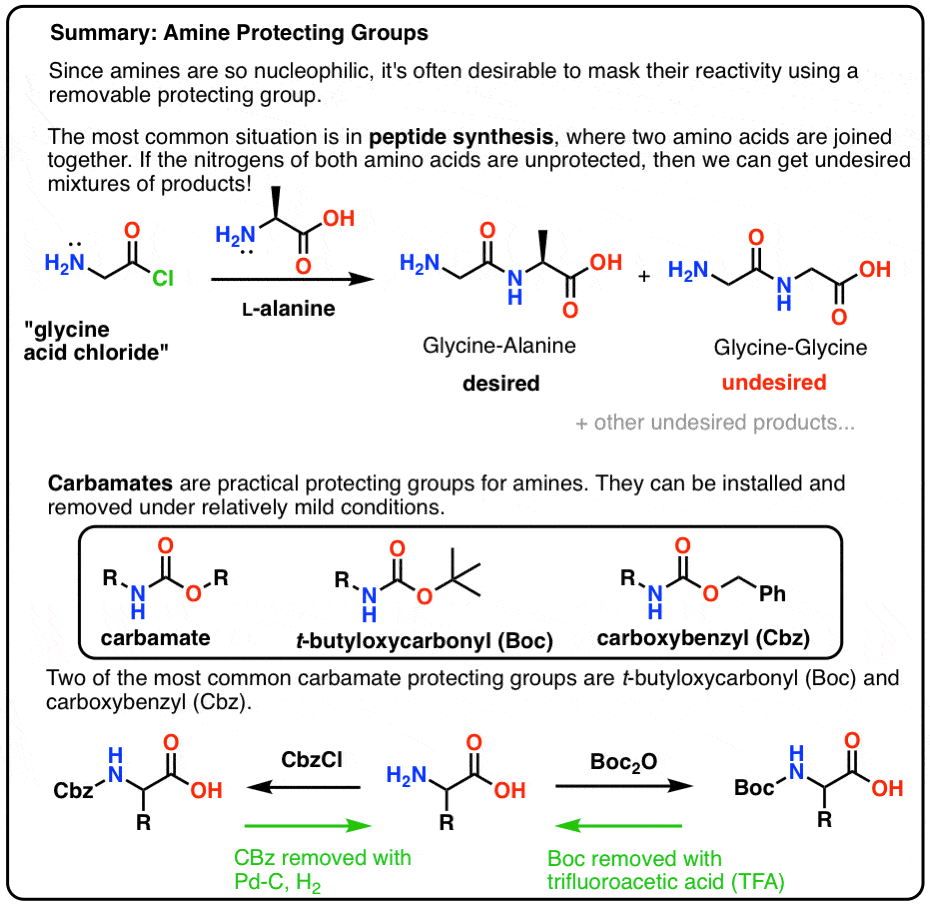
この記事では、アミンに対する有用な保護基として、特にペプチドを作るという文脈でカルバメートを紹介します。
この記事で入ることを簡単にまとめた画像を以下に紹介します。
目次
- An Introduction To Simple Peptide Synthesis
- Let’s Mix Up A Batch of Gly-Ala
- A Very Bad Initial Plan
- “Hark!Hard!”Gly-Ala
- Batch of Gly-Ala
- Let’s Mix Up A Batch of Gly-Ala
- A Protective Hat For NH2
- Mate! カーバメートを使え、メイト!
- Boc と CBz は蜂の爪
- Boc 保護基の導入と除去
- CBz (or “Z”) カルバミン酸保護基の導入と除去
- カルバミン酸保護基による簡単なペプチド合成
- It Keeps Going….
- Notes
- (Advanced) References and Further Reading
Let’s Mix Up A Batch of Gly-Ala
An Introduction To Simple Peptide Synthesis
最近の投稿で、アミドを作る3つの一般的な方法について見てみました。
- アシルハライド/無水物にアミンを加える
- ニトリルの部分加水分解
- カルボン酸とアミンのカップリングをDCC (N,N’-dicyclohexylcarbodiimide) などの脱水剤で行う方法です。
その投稿に欠けていたのは、人類が知る最も有用なアミド結合の偉大な祖父、つまりペプチドの合成についての言及でした。
ペプチド結合とは、2 つのアミノ酸を結合させるアミド結合につける名前です。
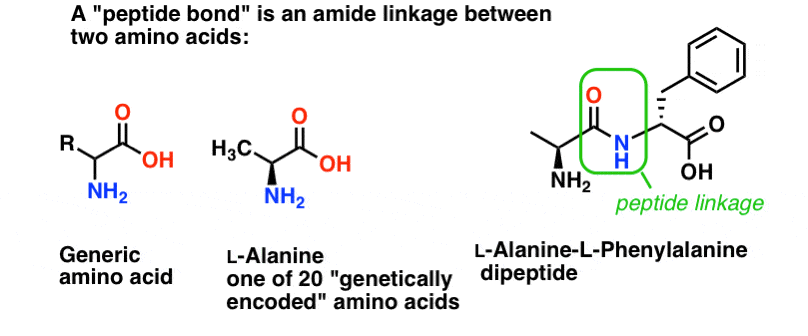
そしてアミノ酸は重要です、なぜなら…待ってください。 アミノ酸が重要な理由はもうお分かりですね? 1069>
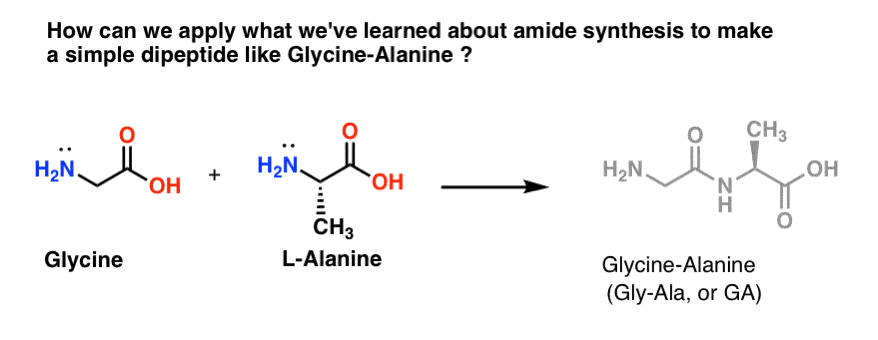
Let’s Mix Up A Batch of Gly-Ala
Let’s try to apply some of our new found amide synthesis skillz to build a really simple dipeptide, glycine-alanine.Now! 今、簡単なジペプチドを作ることができれば、後の投稿で、さらに複雑なペプチドがどのように作られるかを示すために、私たちが学んだことを使うことができます。 ノーベル賞受賞者のブルース・メリフィールドは、アミノ酸を1つずつ結合させてインスリンを合成したことをご存知だろうか? そうです。
私たちが挙げたアミドの作り方のうち、ペプチド結合の形成に役立つと思われるのは 2 つだけです。 1) 酸塩化法、または 2) DCCのようなカップリング剤を介した合成。
3. 非常にまずい最初の計画
ペプチド合成の最初の刺客は、非常に素朴な攻撃計画で突進し、最終的にすべてがうまくいくことを期待することになります。
Gly-Ala ジペプチドから逆算して、私たちの計画では、アラニンとグリシン由来の酸塩化物の反応によってペプチド結合を合成することになります。 1069>
グリシン*の酸塩化物を作ったと仮定して、「グリシン酸塩化物」とアラニンを同じフラスコに入れ、物事を早く進めるために余分な塩基も一緒に入れておくとしましょう。
反応を順方向に描きます:
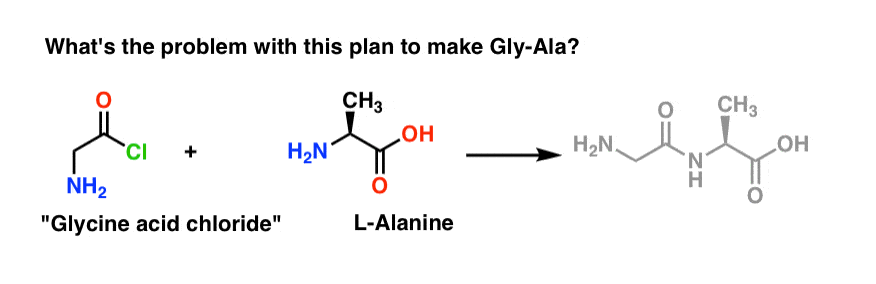
What can be wrong?
“Hark! What Crap Is This? “
私たちの計画は、グリシンの酸塩化物の溶液(1モル当量)を作り、モル当量のアラニンを加えるまでフラスコの中で辛抱強く待機させ、そこでアラニンの求核性NH2基と反応させることでした。
この計画の問題は、私たちが「グリシン酸クロリド」1分子を扱っているのではなく、1モル(6.02 x 1023分子)ほどのものを扱っていることです。 そして、グリシンの酸クロライドはすでに求核性のNH2基を持っています!
描かれた「グリシン酸クロライド」は、それ自身と反応することができるので、安定した分子ではありません。
つまり、グリシン酸クロライドの溶液をそのままにしておくと、Gly-Gly-Gly-Glyという構造を持つグリシンのポリマーが形成される。
さらに、アラニンの存在下でのグリシン酸クロライドの溶液は望ましいGly-Alaだけでなく、Gly-Gly(結合したアシルハライド付き)も形成し、それがGlyまたはAlaであるかどうかにかかわらず別の求核者とさらに悪さをすることが可能になる。
(そして、「グリシン酸クロリド」のNH2とアラニンのNH2を区別することはあまりありません。
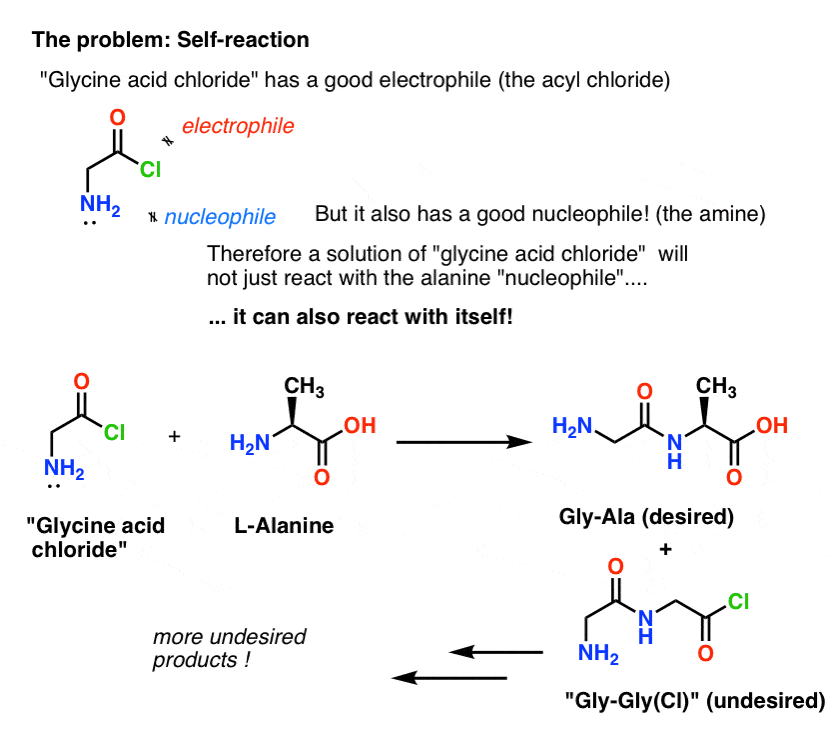
ここでの教訓は、求核剤と求電子剤の両方を含む分子の溶液があると、自己反応することがあるということです。
では、どのようにしてこの現象を防ぐのでしょうか。
A Protective Hat For NH2
最良の方法は、NH2 基を非求核性にする保護基 (PG) で窒素に何らかの「キャップ」をすることです。 また、次のような特性を持つ必要がある:
- 簡単かつ選択的に設置できる
- 目的の反応条件に対して不活性(例:………………………)。 SOCl2でカルボン酸から酸クロリドを作る)
- 最終生成物に影響を与えずに簡単かつ選択的に除去できる
保護基戦略は以前にも、特にアルコールとグリニャール試薬の使用で見たことがあります
ここでは、「Gly-Gly」の合成に対する保護基戦略がどのようなものになるかを示します。 グリシンに保護基(PG)をつけてから、酸クロライドを作る。 保護基は窒素が非求核性(酸クロリドと反応しない)になるように選ぶ。
そして、保護されていないアラニンでペプチド結合を形成し、穏やかな条件で保護基を外す。
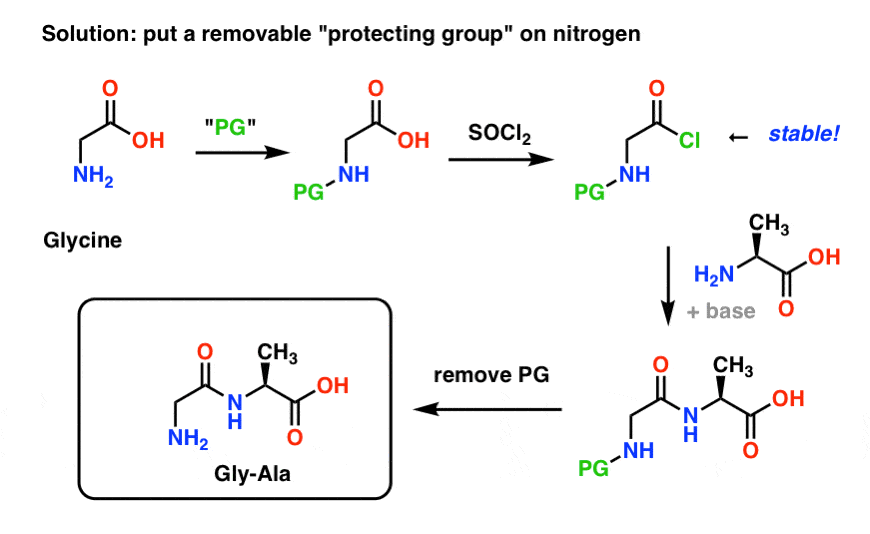
我々がすでに探求した窒素の保護基戦略のひとつに、フタルイミドを使用する Gabriel synthesis があります (フタルイミドを保護窒素と考えることができます)。 これは実際にGly-Gly(「グリシルグリシン」)を合成するのに使われました
もうひとつの可能性は、窒素をアミドとして保護することですが、開裂アミドも厳しい条件を必要とします。 さらに、ここではとにかくアミド結合(ペプチド)を作ろうとしているので、その除去には選択性の問題があるかもしれません。つまり、村を救うために村を破壊してしまうのです。
Mate! カーバメートを使え、メイト!
アミン窒素の保護基として最も一般的なのはカルバメート官能基です。 カルバミン酸は、カルボニルを挟んでNとOを持つ、エステルとアミドの落とし子のようなものです。
カルバミン酸の窒素は比較的非求核性であり、さらに、カルバミン酸は
- 窒素に容易に設置できる
- 幅広い反応条件に不活性
- 既存のアミド基に影響を与えずに容易に除去できる
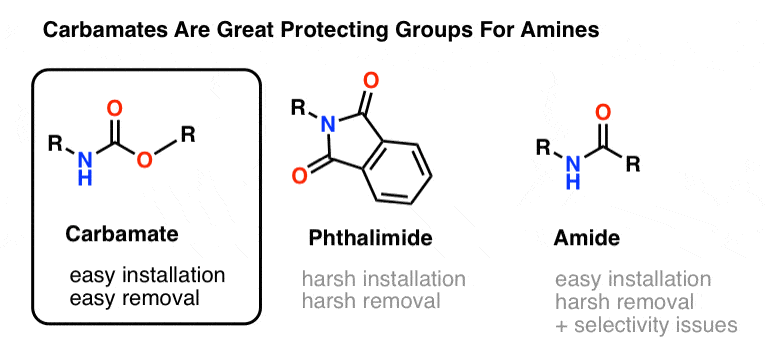
このため我々の目的のために完璧であると言えるでしょう。
Boc and CBz Are The Bees Knees
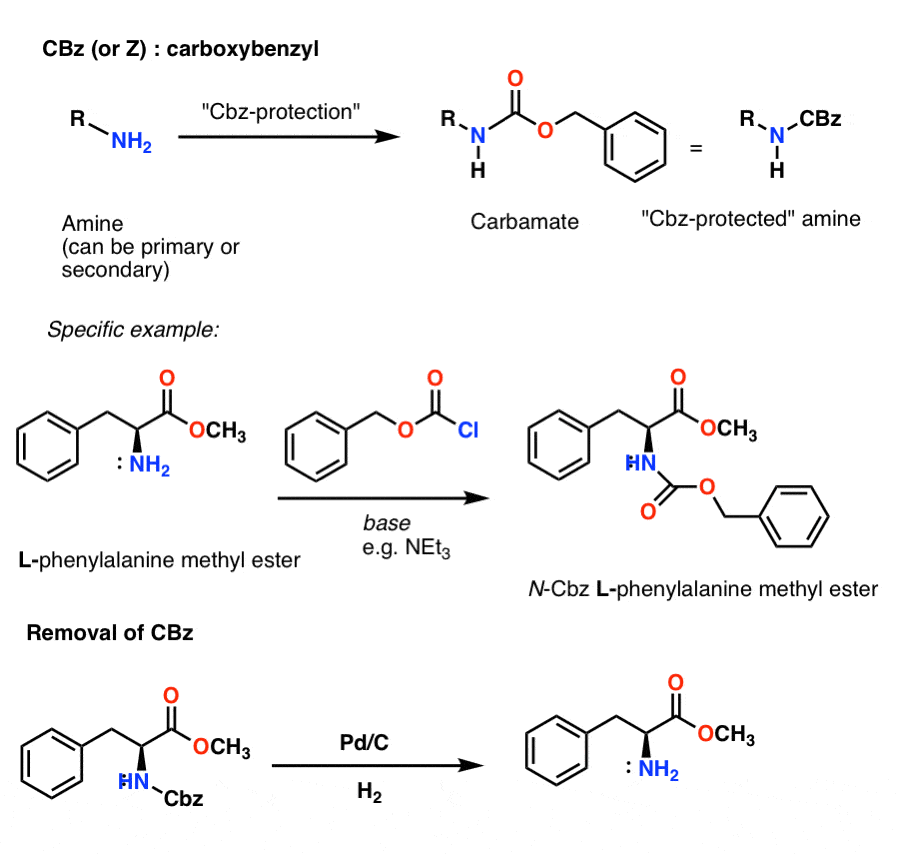
カルバメート保護基としてよく知られているのは、Boc (t-Butyloxycarbonyl) と CBz (carboxybenzyl) です。
我々の目的では、これら2つの保護基は多かれ少なかれ同等と考えることができ、どちらもペプチド合成に効果的に使用することができます。 複数の保護基を持つ複雑な分子では、どちらかを選択することが重要になる。これは「高度な合成戦略」のカテゴリーに入るが、それはOrg 3の主題である。
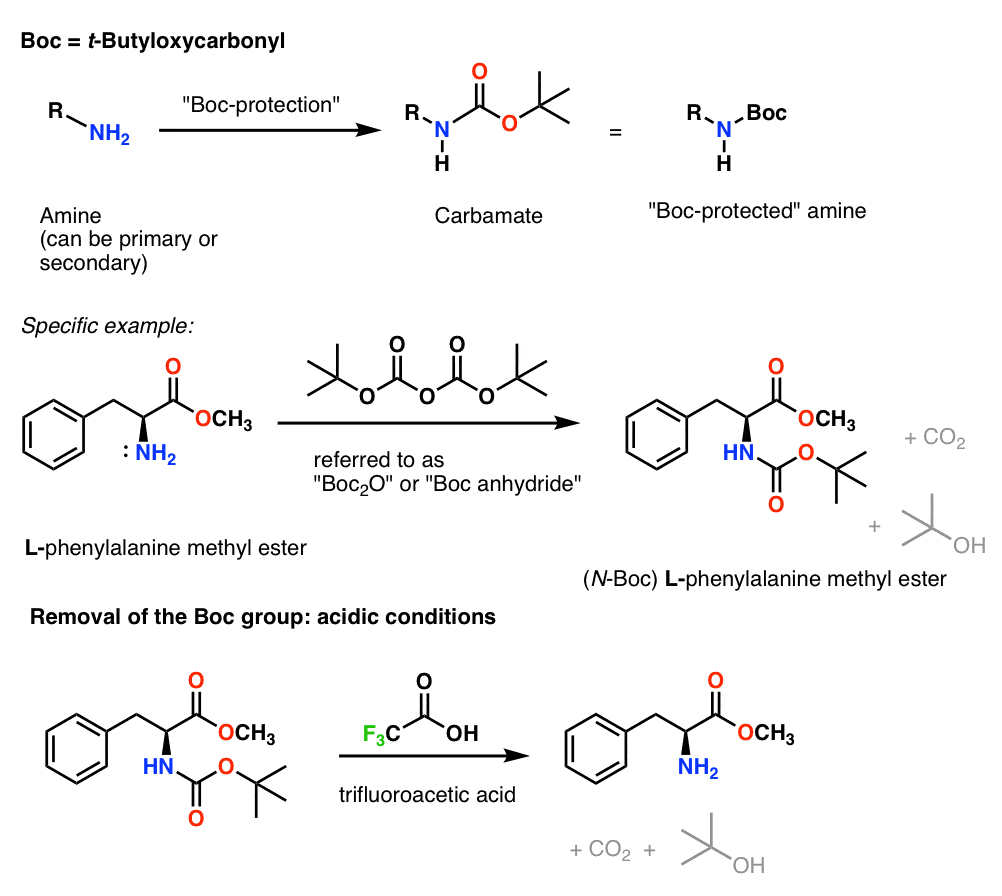
「Boc」保護基の導入と除去
Boc基は通常「Boc2O」(「Boc anhydride」とも呼ばれる)で導入し、酸で除去する。 通常、トリフルオロ酢酸(TFA)を使用し、CO2とt-ブチルアルコールを生成してBoc基をきれいに除去することができます。
CBz (or “Z”) カルバメート保護基の導入と除去
Cbz 基(時にはさらに “Z” と省略)は CbzCl と穏やかな塩基で導入でき、通常は触媒的水素添加 (Pd-C/H2) で除去される。 これは極めて温和であり、酸または塩基に敏感な官能基を残して中性pHで起こるという利点がある。
A simple Peptide Synthesis Using Carbamate Protecting Groups
ペプチド合成に戻って、この保護基戦略を適用して Gly-Ala…
まず L-アラニンなどのアミノ酸で始めます。 アラニンをBoc2Oで処理すると、N-Bocで保護されたL-アラニンが得られる。 次にSOCl2を用いて酸クロライドを形成する。 生成した酸クロリドに、過剰な塩基の存在下でアミン(L-バリンなど)を加え、鍵となるアミド結合を形成させる。 最後に、Bocで保護されたアミンをトリフルオロ酢酸(TFA)で脱保護すると、ジペプチドが完成する。
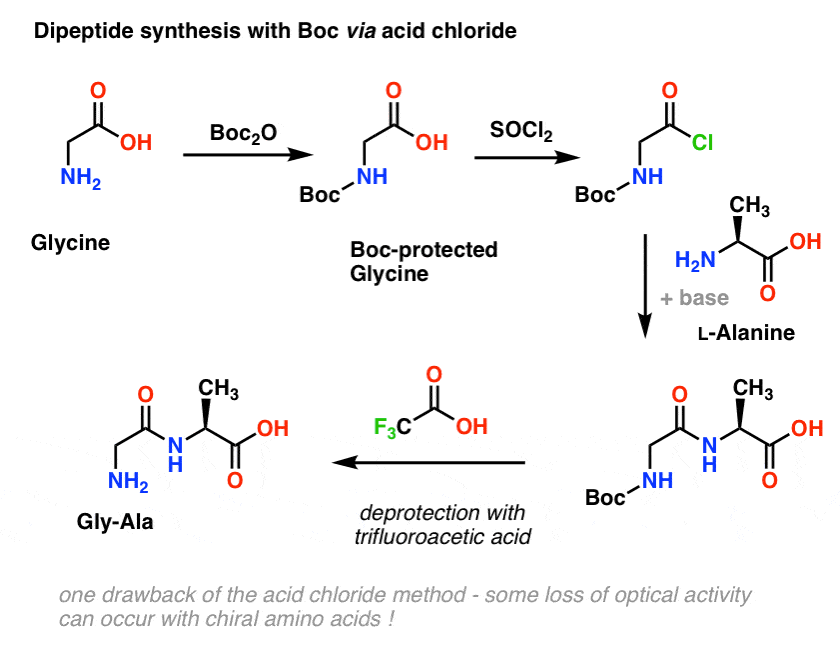
この方法は紙の上ではよいのですが、実際に酸塩化物を使うと、この方法ではキラルアミノ酸がしばしば光学純度を失い、「ラセミ化」と呼ばれる過程が起こることが問題になっています。 1069>
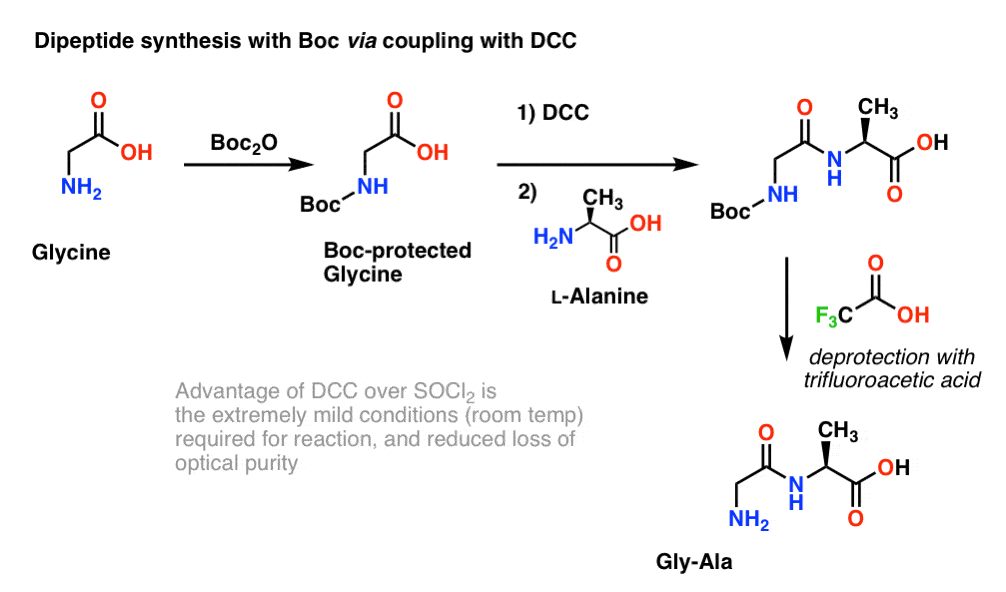
アミノ酸のキラリティーは生物学的機能に不可欠であるため、DCCまたは同様のカップリング試薬を用いた、ややマイルドなプロトコルが一般的である。
ここでは、Bocで保護されたグリシンをDCCで処理し、カルボン酸を活性化する。 次にアミノ酸の求核剤(L-アラニン)を加え、ジペプチドを形成させる。 この時点でGly-Alaジペプチドを単離したい場合は、TFAでBoc基を除去すればよい。
(Note about this scheme)
It Keeps Going…
トリペプチドを作るには、DCC(カルボン酸の活性化)の添加と新しいアミノ酸を加えるサイクルを続けて、一度に一単位のペプチドを作っていけばよいことに注意しましょう!
ブルース・メリフィールドが開拓した(そしてインスリンの合成などに応用された)固相ペプチド合成という、長いペプチドを作るのに特に有効な方法がありますが、この話題は次回に取り上げます。 無人島から脱出する計画を提案する経済学者についての古いジョークに似ている:
「ボートを持っていると仮定する」
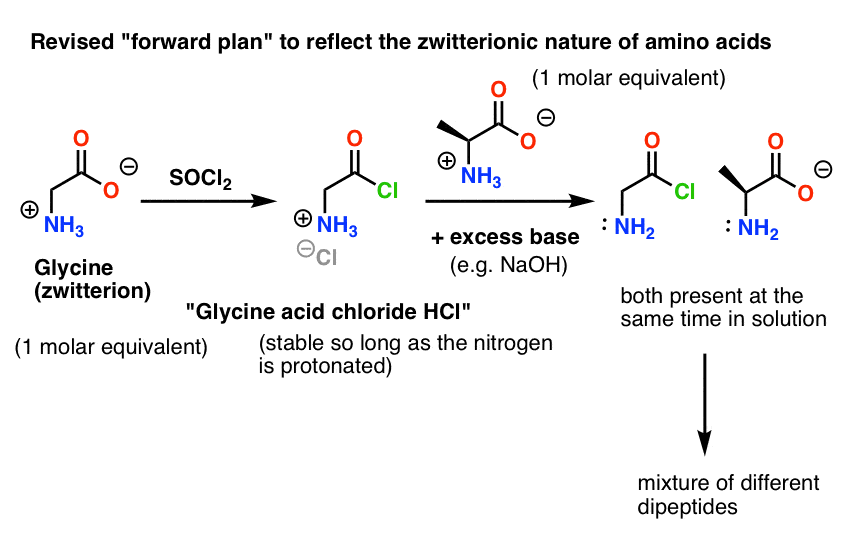
グリシン (すべてのアミノ酸のように) それ自体は双性イオンである。 グリシンをSOCl2で処理すると、プロトン化されたアミンを持つ酸クロライドが得られるはずです。
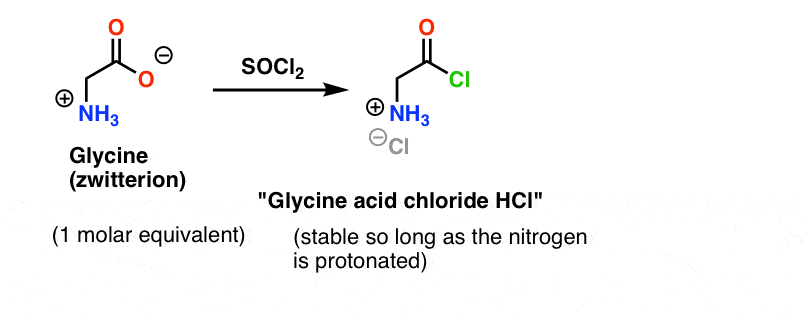
ここで問題があります。 我々のアミノ酸求核剤(アラニン)も双性イオンであるため、過剰な塩基を加えてアラニン窒素上の孤立対を解放するまで、反応は起こりません。 塩基を加えた後の溶液には、「グリシン酸クロリド」と「アラニン」が一緒に存在している。 この2つの種の窒素の間に求核性の顕著な差はなく、それぞれが酸塩化物の求核剤と反応してGly-AlaとGly-GlyClの混合物となり、Gly-GlyClはさらに溶液中に予め用意されている様々な求核剤と反応してトリ、テトラ以上のペプチドを与えることが可能である。
注2. 以前、ペニシリンを初めて合成する過程でDCCの発明者として出会ったJohn SheehanもGabriel合成でフタリルで保護したGly-Glyを作っている:
Reference here (JACS, 1949, 71, 1856)
Note 3.にあるように、Gly-GlyはGabriel合成では保護されてない。 アミド保護基を用いる場合のもう一つの問題は、アズラクトンの生成で、これはキラルアミノ酸のエピメリ化につながる可能性がある。 この問題集も参照されたい。
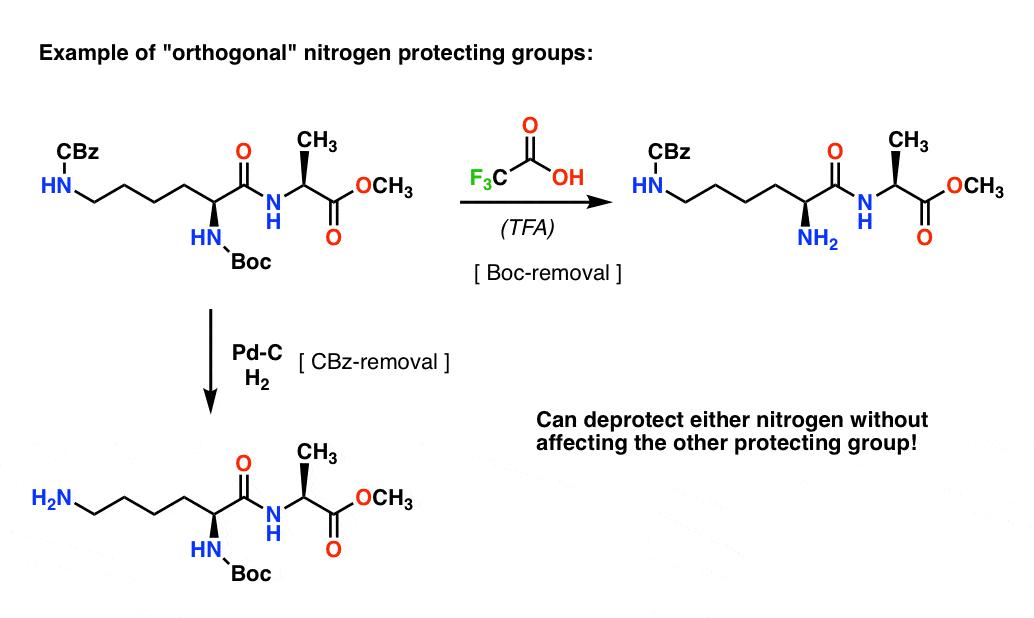
注4. “Orthogonal Protecting Groups”(直交保護基)の略。 合成計画では、明確に異なる条件で除去可能な保護基を持つことが、しばしば決定的に重要である。 この特性はしばしば「直交性」
と呼ばれる。例えば、次のジペプチドでは、窒素上に2種類の保護基(1つはBoc、もう1つはCBz)を持っている。 直交する」保護基を選択することで、それぞれの窒素に対応できるようになり、どちらの保護基を外すか選択でき、そこから合成を進めることができる。 これにより、保護されていない2つのアミンがあり、一方が他方よりも反応性に優れていることに頼らなければならないような状況を回避することができるのです。 このようなアプローチは非常に稀です!
One note – ここでは簡単のためにアラニンを遊離カルボン酸で描いていますが、アラニンのメチルエステルを使用して、アラニンの遊離アミンと遊離カルボン酸間の自己カップリングを避ける方が少し良いアプローチでしょう。
Mate…
(Advanced) References and Further Readings
カルバメートはアミンの保護基として有用であり、最もよく採用されるのは-Boc、-Cbz、-Fmocです。
- Uber ein allgemeines Verfahren der Peptid-Synthese
Max Bergmann and Leonidas Zervas
Ber.Ber.Bernd. 1932, 65 (7), 1192-1201
DOI: 10.1002/cber.19320650722
-Cbz (carboxybenzyl) 保護基は、1932年に Max Bergmann と Leonidas Zervas によって初めてペプチド合成に使われ、Zervasに敬意を表して「-Z」と略されることもあります。 - トリフルオロ酢酸によるt-ブチルおよびt-ブトキシカルボニル保護基の除去
メカニズム、二重生成物形成およびスカベンジャーの評価
Behrend F. Lundt, Nils L. Johansen, Aage Vølund, and Jan Markussen
J. Pept. Prot. Res. 1978, 12 (5), 258-268
DOI: 10.1111/j.1399-3011.1978.tb02896.x
実際には、Bocの脱保護により親電子性のt-ブチル種(例えばトリフルオロ酢酸t-ブチル)が生成し、敏感な残基(例えばTrpまたはCys)と反応しうるので、脱保護の際には通常求核剤(例えばチオール)が酸カクテル(TFA)に添加される。 - オキシトシンの合成を例とする長鎖ペプチド合成法
Miklos Bodanszky and Vincent du Vigneaud
Journal of the American Chemical Society 1959, 81 (21), 5688-5691
DOI: 1021/ja01530a040
20 世紀の前半、ペプチド合成は標準有機化学溶液相技術を用いて行われた。 これは現在ではLPPS(液相ペプチド合成)と呼ばれています。デュ・ヴィニョーは、保護基の正しい選択と合成戦略を用いて、ペプチド合成が達成できることを示した業績により、1955年にノーベル化学賞を受賞しています。 - アミノ酸のアシル誘導体のアセチックアンヒドリドとの反応におけるアズラクトン環の一時的な形成
Vincent du Vigneaud and Curtis E. Meyer
Biol. Chem. 1932, 99:143-151
http://www.jbc.org/content/99/1/143.citation
アミド保護基を使用した場合のもう一つの問題は、アズラクトンの生成で、これはキラルアミノ酸のエピマー化を引き起こすことがあります。 - ペプチドへの新しい合成ルート
John C. Sheehan and Victor S. Frank
Journal of the American Chemical Society 1949, 71 (5), 1856-1861
DOI:10.Biol.Chem.誌(1994) No.1021/ja01173a095
ペニシリンの最初の合成に至る過程でDCCを発明したJohn Sheehanは、Gabriel合成によってフタル酸で保護されたGly-Glyも作った。 - A New Method of Forming Peptide Bonds
John C. Sheehan and George P. Hess
Journal of the American Chemical Society 1955, 77 (4), 1067-1068
DOI: 1021/ja01609a099
DCC を用いたペプチド結合/アミド結合の合成に関するオリジナルな論文です。 - 9-フルオレニルメトキシカルボニル機能、新しい塩基感受性アミノ保護基
Louis A. Carpino and Grace Y. Han
Journal of the American Chemical Society 1970, 92 (19), 5748-5749
DOI: 10.1021/ja00722a043 - 9-Fluorenylmethoxycarbonylアミノ保護基
Louis A. Carpino and Grace Y. Han
The Journal of Organic Chemistry 1972 37 (22), 3404-3409
DOI: 10.1021/jo00795a005
アミンの保護基-Fmocの発見と開発でアミン保護/保護解除戦略にも直交性の層を追加することができた。 Fmoc基は塩基に不安定であり、ペプチド合成では通常DMF中20%のピペリジンで除去される。 Cbzは水素添加で、-Bocは酸で、-Fmocは塩基で除去される
。