US Pharm. 2009;34(11):26-39.
大うつ病性障害(MDD)と診断された患者さんに適切な抗うつ薬を選択することは不確実性が高く、薬剤間の効果に差がないという研究報告があるだけでなく、初期治療で1年後でも寛解に至るのは11%~30%にすぎないからです1、2この結果、臨床家はうつ病の治療に対してトライ&エラーの方法で実践しているのです3。 さらに、精神疾患の診断と統計マニュアル(DSM-IV-TR)の最後の大きな改訂は2000年に行われました4。2005年には、ネファゾドンなどのいくつかの薬剤について浮上した安全性に関する重要な懸念を再検討し、また、その年に承認された2つの新しい抗うつ剤、エスシタロプラムとデュロキセチンを再検討するガイドラインが発表されました5。 したがって、臨床医が個々の患者を治療するために適切な薬剤を決定するのに役立つ最新のレビューが必要である。
2007年のSequenced Treatment Alternatives to Relieve Depression(STAR*D)研究は,現在の大うつ病エピソードが確認された治療抵抗性うつ病患者の臨床転帰を改善するための実行可能な治療戦略の開発と評価を試みた。6 特に,STAR*Dでは,初回またはその後の治療で寛解に達しない患者,あるいは治療に耐えられない患者に対して,いくつかの治療のうちどの方法が「次のステップ」としては最も有効であるかを明らかにしようとするものである。 この研究の全体的な結果、向精神薬間の薬理学的な違いは、忍容性には差があるものの、実質的な臨床的な差にはならないことが示されました6
この論文の目的は、副作用、薬物相互作用、薬の安全性と患者の特徴を考慮し、臨床家が適切な薬を決定するための迅速な参考資料を提供するために文献で利用できる治療証拠をレビューすることである。
うつ病とは
うつ病は、抑うつ気分、興味や喜びの喪失、罪悪感、睡眠障害や食欲不振、エネルギー低下、思考困難などの症状を示す慢性または再発性の精神障害です。 7
有病率とリスクのある集団
世界中で推定1億2100万人がうつ病に罹患しています。 2000年,うつ病はすべての疾患の中で世界的な疾病負担の第4位であったが,2020年までには心臓病に次ぐ第2位に上昇すると予想されている7。 女性は50代までうつ病のリスクが高く、その生涯リスクは男性の2倍である。 24歳から45歳の人は、うつ病になる割合が最も高い。 最後に、うつ病患者の第一度近親者は、他の人に比べて1.5~3倍うつ病を経験しやすい。4,8
病態生理と薬物療法の根拠
生物学的および心理社会的原因は、うつ病の病態を説明しようと仮定されたものである。 薬物療法は、神経伝達物質の調節障害に関連した生物学的な原因をターゲットとする。 この調節障害は、しばしば脳内神経伝達物質レベルの欠乏と表現される。 ノルエピネフリン、セロトニン、ドーパミンのレベルは、うつ病患者において低下している可能性があり、したがって、神経伝達物質の量の減少がこの障害に関連している。8 薬理療法の根拠は、抗うつ薬を介して神経伝達物質の再取り込みを阻害したり、酵素による代謝を防ぐことによってこれらの欠乏を高めることであった。 全体として、これらのメカニズムは、神経細胞がより頻繁に発火し、より多くの神経伝達物質を生成することを強制するか、神経伝達物質自体の分解を防ぐことによって、神経伝達物質のレベルを増加させることを目的としています。
薬物療法
現在、うつ病の治療にはいくつかの種類の薬剤が利用可能である。 それらは、選択的セロトニン再取り込み阻害剤(SSRI)、三環系抗うつ剤(TCA)、モノアミン酸化酵素阻害剤(MAOI)、およびセロトニン-ノルエピネフリン再取り込み阻害剤(SNRI)などを含んでいる。
抗うつ薬は、MDDの短期プラセボ対照試験において、小児、青年、若年成人における自殺思考および自殺傾向のリスク上昇と関連づけられてきた。 小児,青年,若年成人に対する抗うつ薬の使用を考慮する者は,このリスクと臨床的必要性のバランスをとる必要がある。 短期間の研究では、24歳以上の成人ではプラセボと比較して抗うつ薬による自殺のリスクの増加は示されず、65歳以上の成人ではプラセボと比較して抗うつ薬によるリスクの減少がみられた。 うつ病やその他の精神疾患は、それ自体が自殺のリスク上昇と関連しています。 抗うつ薬治療を開始したすべての年齢の患者を適切にモニターし、臨床的な悪化、自殺傾向、または行動の異常な変化について注意深く観察すべきである9
Selective Serotonin Reuptake Inhibitors4,10: SSRIは、うつ患者の治療に関して第一選択の薬剤と考えられている。 これらの薬剤には、citalopram、escitalopram、fluoxetine、fluvoxamine、paroxetine、sertralineが含まれる(表1)。 このクラスの主な副作用には、吐き気、嘔吐、下痢があるが、これらは用量依存的な作用であり、治療開始後数週間で消失する傾向がある。 患者によっては、SSRIは激越と睡眠障害を引き起こすことがあるが、これも時間とともに消失する。 性的機能不全はすべての抗うつ薬にみられる副作用であるが、SSRIで最も一般的であると思われる。
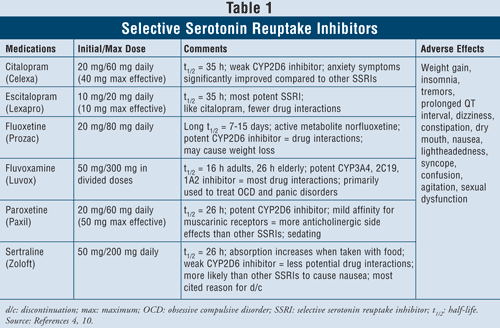
セロトニン症候群(すなわち、腹痛、下痢、発汗、精神状態の変化、腎不全、心血管ショック、そしておそらく死)はSSRIのまれな副作用である。 セロトニン症候群は、SSRIの用量を増やしたり、SSRIとセント・ジョーンズ・ワートなどの生薬や違法薬物との併用で起こる可能性がある。 最後に、SSRIとMAOIの併用は、セロトニン症候群の発症を伴う致死的な薬物相互作用につながる可能性もある。 このクラスの薬剤の中では、フルボキサミンがCYP450 1A2、2C19、2C9、2D6、3A4などのいくつかの肝酵素を阻害するため、薬物相互作用の割合が最も高くなります。 フルオキセチンは、CYP 2C9、2D6、3A4を阻害するため、フルボキサミンの薬物相互作用率に密接に追随します。 最後に、citalopramとescitalopramは、2D6酵素を阻害する程度が低いので、薬物相互作用が最も少ない。
患者の特性と安全性を考慮すると、SSRIは既存の心疾患、喘息、認知症、高血圧を含むほとんどの患者群で安全に使用できる。 特に起立性低血圧や体重減少を起こしやすい高齢者は、SSRIが体重増加をもたらし、抗コリン作用がないため、SSRIの使用が最も有益であると考えられる。
三環系抗うつ薬4,10:TCAはノルエピネフリンとセロトニンの再取り込みを阻害するが、α1、H1、ムスカリン受容体にも親和性があり、抗コリン性の副作用が生じる。 このクラスの薬剤には、第三級アミンTCAと第二級アミンTCAの2つのサブクラスがある(表2)。 第二級アミンTCA(デシプラミン、マプロティリン、ノルトリプチリン)は、α1、H1、ムスカリン受容体への親和性が低く、第三級アミンTCA(例:アミトリプチリン、アモキサピン、クロミプラミン、ドキセピン、イミプラミン)よりも抗コリン性の副作用が少ないと言われています。
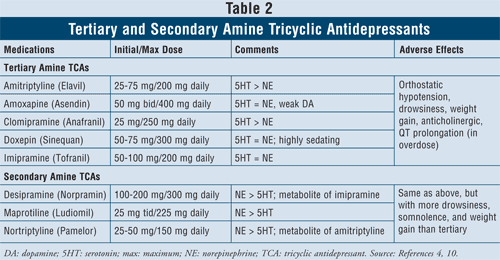
このクラスの薬剤の主な副作用は、起立性低血圧、QT延長、眠気、口渇、かすみ目、便秘、体重増加である。 一般に、ノルエピネフリン活性の高い第二級アミンTCAに対し、第三級アミンTCAはセロトニン活性が高いため、眠気、傾眠、体重増加などが少ない。
患者の特徴と安全性を考慮すると、TCAは不整脈、洞結節機能障害、伝導障害の既往のある患者など、いくつかの特定の心疾患では禁忌とされています。 高齢者では、コリン作動性遮断や起立性低血圧に対してより敏感であるため、注意が必要です。 さらに、認知症を患っている人は、ムスカリン遮断の記憶と注意力に対する毒性作用の影響を特に受けやすく、一般に抗コリン作用の程度が最も低い抗うつ薬を投与すれば、最も効果的であるだろう。 最後に、過量投与による致死リスクが高いため、自殺願望のある患者に対してTCAの投与を開始することを検討する際には注意が必要である。 致死量は治療量の8倍に過ぎないため、TCAを過量に摂取した場合、心臓の洞房結節を遮断する可能性があります。
モノアミン酸化酵素阻害薬4,10:MAOIとして、イソカルボキサジド、フェネルジン、セレギリン、トラニルシプロミンがある(TABLE 3)。 セレギリンは選択的MAO B阻害剤であるが、それ以外の薬剤は脳内のセロトニン、ノルエピネフリン、ドーパミンの代謝に関与するMAO AとBの両方の酵素を阻害するものである。 重篤な副作用と必要な食事制限のため、MAOIは一般に、他の抗うつ薬が無効な患者にのみ使用されます。
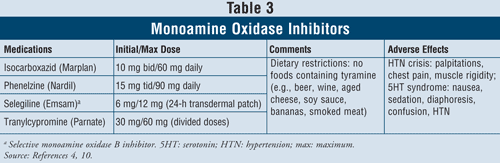
MAOIを服用中の患者が、ビール、ワイン、熟成チーズ、スモーク肉などのチラミンを含む食品を摂取すると、高血圧性危機が起こる可能性がある。 この反応は、激しい頭痛、吐き気、首のこわばり、動悸、胸痛、錯乱の急性発症として現れる。 MAOIはまた、セロトニン症候群を引き起こすことがあります。 前述のように、この症候群は、MAOIとSSRIなどの他のセロトニン作動性薬剤を併用した場合、またはMAOI投与後すぐにSNRIであるベンラファキシンを投与した場合に最もよく発生します。 患者が半減期の短いSSRIからMAOIに変更された場合、SSRIの中止とMAOIの開始の間に2週間のウォッシュアウト期間を尊重することが重要である。 半減期の長いフルオキセチンがSSRIである場合、ウォッシュアウト期間は5週間であるべきです。4 その他の副作用として、起立性低血圧、体重増加、性的機能障害、不眠などがMAOIで発生することがあります。
これらの薬剤は薬物相互作用が高いため、交感神経刺激性の気管支拡張剤を使用している喘息患者に処方する場合は注意が必要である。 高血圧の患者では、MAOIは、特に利尿剤治療と同時に起立性低血圧を誘発する可能性がある。
セロトニン・ノルエピネフリン再取り込み阻害薬4,10:デスベンラファキシン、デュロキセチン、ベンラファキシンなどのSNRIも第一選択薬として使用できる(TABLE 4)。 これらの薬はTCAよりも安全性が高く、副作用は吐き気、嘔吐、性機能障害、血圧上昇などSSRIと同様である。
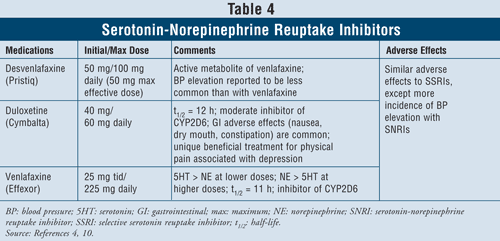
ベンラファキシンは3%~13%の症例で血圧上昇を引き起こすことが示されているが、デスベンラファキシンは1%~2%しか血圧上昇を引き起こさないと報告されている10。したがって、本剤は状態を悪化させるため、高血圧をコントロールしていない患者への使用を避けることが推奨されている。 デュロキセチンは、前述の両剤よりもノルエピネフリン活性が高いため、筋肉痛、頭痛、胃腸障害、全身疼痛など、重度のうつ病患者にしばしば見られる身体症状に有用です。 最後に、3剤とも低用量ではノルエピネフリンよりセロトニンの活性が高く、高用量ではセロトニンよりノルエピネフリンの活性が高いため、用量依存的な副作用があります。
その他の抗うつ薬4,10:その他の抗うつ薬は、先に述べたクラスの薬とは作用機序が異なるものがいくつか利用できる。
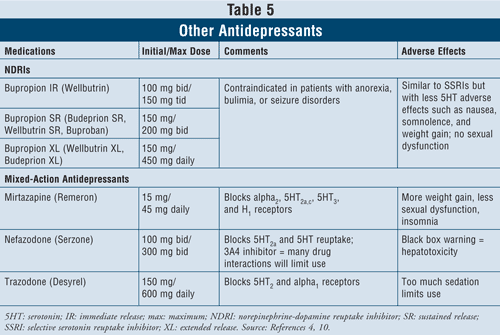
ブプロピオン即時放出(IR)ブランドのウェルブトリン(ウェルブトリンXL、ウェルブトリンSR、ブデプリオンSR、ブデプリオンXL、ブプロバンなどの長時間作用型もある)などのノルエピネフリンドーパミン再取込阻害剤(NDRI)はうつ病治療の第一選択の薬剤として使用できる(TABLE 5)。 その副作用はSSRIと同様であり、吐き気や体重増加などのセロトニン作用は少なく、性的機能障害はほとんどない。 ブプロピオンは、一部の患者ではパーキンソン病の症状に対して有益な効果を発揮することが示されているが、ドパミン作動性システムに対するアゴニスト作用のためか、いくつかの精神病症状を誘発することもある16
最後に、混合作用を持つ抗うつ薬がさらに3種類ある:ミルタザピン、ネファゾドン、トラゾドン(TABLE 5)である。 この3剤はすべて異なるセロトニン受容体を遮断するため、異なる作用を持つ。 Mirtazapineは食欲を増進させることにより、より多くの体重増加を引き起こす。 ネファゾドンは、肝毒性とCYP3A4酵素阻害のため、薬物相互作用の原因となり、用途が限定されている。 Trazodoneはセロトニン受容体を大きく遮断し、ムスカリン受容体への結合は弱い。 鎮静、頭痛、記憶障害、口渇、便秘などの副作用が起こることがあります。 また、男性におけるトラゾドンの使用は、先天性異常のリスクがあるため、注意が必要です。
結論
一般に、抗うつ薬は同等の効果があることが示されている。 したがって、薬物の選択は、副作用、薬物相互作用、安全性、および患者の嗜好に基づいて行う必要があります。 患者の治療中に臨床家の指針となるいくつかのアルゴリズムがあり、特に最近更新されたMDD治療のためのテキサス州保健サービス省のアルゴリズム(2008年7月更新)17。患者が部分的に反応を示した場合、臨床家は増量、代替薬への変更、抗うつ薬の併用投与を選択することができる。 逆に、患者が反応しない、あるいは薬に耐えられない場合は、代替薬に変更することも適切である。また、副作用は治療開始1週間後に現れるかもしれないが、治療効果は通常4〜6週間の間に現れることを考慮すると、2〜3週間後に消失する。4、17 それでも、患者の改善と安全を最も確実にする抗うつ薬は、少なくとも部分的には、試行錯誤によって決定することができるだろう。 個々の患者にとって、どの薬が有効で、どの薬が耐えられるかを予測することが難しいことを考えると、幅広い抗うつ薬に精通していることは、賢明かつ有用である。
1. 選択的セロトニン再取り込み阻害薬:有効性と忍容性のメタ分析。 BMJ. Geddes JR, Freemantle N, Mason J, et al.うつ病性障害に対するSSRI対その他の抗うつ薬。 このような場合、「躁鬱病の治療法として、SSRIと他の抗鬱剤を比較する」という方法があります。 Arch Gen Psychiatry。 2008;65:870-881.
4. 米国精神医学会. を、「精神障害の診断と統計マニュアル」第4版、テキスト改訂版(DSM-IV-TR)。 ワシントン DC。 アメリカ精神医学会;2000.
5. 大うつ病性障害に関する作業部会。 ガイドラインウォッチ。 大うつ病性障害患者の治療のための実践ガイドライン。 第2版 ワシントンDC: を参照。 プリムケアクリニックオフィスプラクティス。 2007;34:505-519.
7. Depression. 世界保健機関(WHO)www.who.int/mental_health/management/depression/definition/en。 Dipiro JT, Talbert RL, Yee GC, et al.Pharmacotherapy。 Dipiro JT, Talbert RL, Yee GC, etc. Pharmacotherapy: A Pathophysiologic Approach. 6th ed. New York, NY: 9339>9. 製品ラベルの改訂。 自殺傾向および抗うつ薬。 FDA。www.fda.gov/downloads/Drugs/DrugSafety/InformationbyDrugClass/UCM173233.pdf。 2009年10月5日アクセス。
10. 医薬品情報。 マイクロメデックス・ヘルスケアシリーズ。 グリーンウッドビレッジ、CO。 Thomson Micromedex. www.micromedex.com. 2009 年 10 月 5 日アクセス。
11. また、このような場合にも、「鍼灸師が鍼を刺すと、鍼灸師が鍼を刺すと、鍼灸師が鍼を刺すと、鍼灸師が鍼を刺すと、鍼灸師が鍼を刺すと、鍼灸師が鍼を刺すと、鍼灸師が鍼を刺すと、鍼灸師が鍼を刺すと。 Drug Metab Dispos. 2002;30:1102-1107.
12. ブラウンCH. SSRIの薬物-薬物相互作用の概要。 US Pharm. 2008;33(1):HS3-HS19.
13. Spina E, Scordo MG, D’Arrigo C. 新しい向精神薬による代謝性薬物相互作用. Fundam Clin Pharmacol. 2003;17:517-538.
14. Bergstrom RF, Peyton AL, Lemberger L. fluoxetine and tricyclic antidepressant interactionの定量化とメカニズム。 Clin Pharmacol Ther. 1992;51:239-248.
15. Cymbalta (duloxetine hydrochloride)の添付文書。 Indianapolis, IN: Eli Lilly and Company; February 2009. http://pi.lilly.com/us/cymbalta-pi.pdf. 2009年10月5日アクセス)
16. Goetz CG、Tanner CM、Klawans HL. パーキンソン病におけるブプロピオン。 Neurology. 1984;34:1092-1094.
17. Suehs B, Argo TR, Bendele SD, et al. Texas Medication Algorithm Project Procedural Manual.テキサス薬物療法アルゴリズムプロジェクト手続きマニュアル. 大うつ病性障害アルゴリズム。 Texas Department of State Health Services; July 2008. www.dshs.state.tx.us/mhprograms/pdf/TIMA_MDD_Manual_080608.pdf. 2009年10月5日アクセス。
この記事へのコメントは、[email protected].
までお願いします。