素粒子
すべての元素は原子という極めて小さな物質の粒子で構成されています。 原子を、ある元素の化学的性質をもつ最も単純な粒子と定義することができる。 化学的性質には、元素の物理的状態 (気体、液体、または固体)、元素が形成できる結合の種類、他の元素との反応方法などが含まれます。 したがって、炭素という元素を構成する原子はすべて同じ化学的性質を持っています。
物理学者は原子を爆発させて何十種類もの素粒子にすることに成功しましたが、そのうち安定しているのは3つだけです。 陽子、中性子、電子である。 陽子は正電荷を帯びた粒子で、質量を持ち、原子の中心、つまり原子核に位置している。 中性子は電荷を持たず、質量を持ち、同じく原子核に位置しています。 中性子は陽子と結合し、原子核を安定させる働きをします。 中性子が多すぎても少なすぎても原子核が不安定になり、崩壊して他の元素を形成することがあります。 このような原子を私たちは「放射性物質である」と呼んでいます。 中性子の質量は陽子の質量よりわずかに大きいが、我々は両者を1(1原子質量単位またはamu)の相対質量に割り当てることができる。 原子の質量は、中性子と陽子でほぼ占められています。 3番目の安定粒子は電子です。 電子は負の電荷を持っているが、非常に小さく、質量は陽子や中性子の1850分の1しかない。 あまりに小さいので、実用上は原子の質量に寄与しない。 電子は原子核の周りを非常に速い速度で移動しており、実際には光速に近い速度で移動している。 電子は、太陽の周りを回る惑星のように、原子核の周りを回る軌道を描いているとよく言われますが、現代の物理学では、このモデルは間違っていることが分かっています。 この「軌道」とは、原子核の周囲にある、電子が最も多く存在する空間のことである。 この領域は、しばしば電子の “雲 “と呼ばれる。 確かに特定の領域であることに変わりはないのですが、球状の軌道に比べるともう少し非定形なのです。 しかし、簡単のために、私たちはしばしばこれを衛星のような円軌道と考えます。 下の図は、私たちが現在考えている窒素原子のモデルです。 原子核の周りの斜線部分は、電子軌道(雲)を表しています。 電子(青)はこの軌道のどこかに存在することになる。 (注:画像は縮尺を合わせて描いていません。 もし原子核がバスケットボールほどの大きさであれば、電子は約6キロメートル、3¾マイル離れていると言われています!)
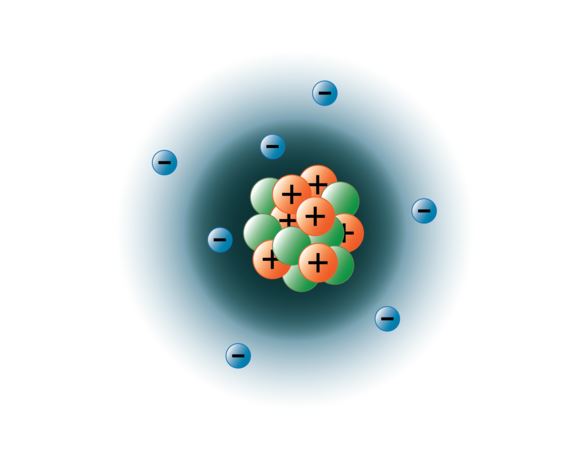
image created by BYU-I student Hannah Crowder Fall 2013
原子番号
もう一度周期表を見て、各ボックス上部にある番号に注目してください。 この数字はその元素の原子番号で、異なる元素ごとに一意である。 例えば、水素の原子番号は 1 であり、原子番号が 1 の元素は他にありません。炭素の原子番号は 6 であり、やはり原子番号が 6 の元素は他にありません。 したがって、すべての水素原子は1個の陽子を持ち、すべての炭素原子は6個の陽子を持つ。 また、原子は中性の電荷を持っているので、原子番号は原子に含まれる電子の数も示している。 化学表記では、元素の原子番号は元素記号の前の添え字で表されます。 例えば、炭素は6Cと表されます。
質量数(原子質量)
原子の質量数は、その名の通り、原子の総質量を表しています。 電子の質量は非常に小さい(無視できる)ので、質量数の計算には使われません。 また、陽子と中性子の質量はそれぞれ1原子質量単位であることを思い出してください。 したがって、質量数は原子に含まれる陽子と中性子の和になります。 質量数は陽子の数+中性子の数で、原子番号は陽子の数ですから、質量数から原子番号を引くだけで中性子の数がわかります。 例として、原子番号8、質量数17の元素があるとします。 この情報から、この元素は陽子8個、電子8個、中性子9個(17-8=9)であることが推論されます。 さて、ここで一転します。 前述のように、ある元素の原子はすべて同じ数の陽子(原子番号)を持っていますが、ある元素の異なる原子は異なる数の中性子を持っている場合があります。 これを元素の同位体の違いと言います。 例えば、水素には3つの同位体があります。 全水素原子の99.98%を占める最も一般的な同位体は質量数1で、陽子1個、中性子1個、電子1個で構成されています。 その他の少ない水素の同位体は、それぞれ質量数2と3です。 これらの同位体は原子核に含まれる中性子の数が異なりますが、3つとも1個の陽子と1個の電子を持っています。 実際には、どの元素にも自然界に存在する同位体があり、それぞれ固有の質量数を持っています。 化学表記では、同位体の質量数は元素記号の前に上付き文字で表されます。 水素の3つの同位体は、1H、2H、3Hと表現される。 各元素はいくつかの同位体から構成されているので、”ある元素の実際の質量はどのくらいなのだろう?”という疑問が生じます。 もう一度、上の周期表を見てみると、各ボックスの底に数字が書かれていることに気づくだろう。 これはその元素の原子量です。 例えば、水素の原子量は1.00794amuです。 この数字は、水素の3つの同位体の平均質量を計算することによって導き出されたものです。 例えば、クラスに男の子が10人いたとします。 男子生徒の平均体重を知りたければ、それぞれの体重を足して、その合計を10で割ればよい。 そうすると、男子生徒の平均的な重さがわかります。 このようにして、原子量は決定されるのです。 1H は最も豊富な水素の同位体なので、水素の原子量が 1H の原子量に非常に近いことは理にかなっています。
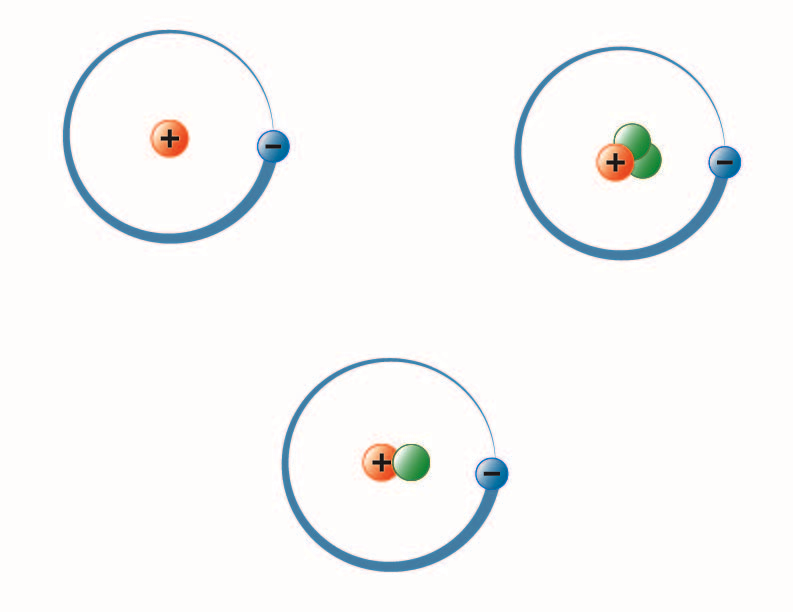
image created by BYU-I student Hannah Crowder Fall 2013
上の画像は水素の 3 つの同位体を表します。 最も一般的なもの(左上)は、原子核に陽子1個と中性子1個を持ちます。 重水素(下)は陽子1個と中性子1個、トリチウム(右上)は陽子1個と中性子2個です。
** 下のボタンを使って、このモジュールで次または前の読み物に進むことができます**

