この章では、鉄と鋼の技術的検査に使用される分析方法について、学生にある程度の洞察を与えるような事柄が提示されます。 炭素(遊離および結合)、硫黄、シリコン、リン、マンガン、チタン、銅、ニッケル、コバルト、クロム、アルミニウム、ヒ素、アンチモン、錫、タングステン、バナジウム、窒素、鉄などである。 一般的に最も必要とされるのは、炭素、硫黄、ケイ素、リンの推定値である。 その他の元素や化合物のうち、特殊鋼の場合は1種類以上の定量が必要である。 これらの測定に関する情報は、Crobaugh著「Chemical Analysis and Foundry Chemistry」、「The.Chemical Analysis and Foundry Chemistry」を参照してください。 Chemical Analysis of Iron, by Blair; “Carbon in Steel by Direct Combustion” by Blount, in The Analyst, Jan 1902; “Sulphur in Wrought Iron and Steel” by Auchy, in the Jour. Amer. Chem. Soc., March 1901に掲載されたAuchyの “Sulphur in Wrought Iron and Steel “や、同じ雑誌に掲載された他の記事もあります。 さらに詳しく知りたい学生は、可能であれば、様々な化学・冶金雑誌に随時掲載されるCampbellやDrownなどの論文や記事を入手するとよいでしょう。
学生の時間は限られているので、珪素と燐の推定は当分先送りしてもよいが、これらは冶金学者と鋳物師双方にとって重要であるため、この問題をより完全に把握するために、考察する物質の組成と性質について少し述べても差しつかえないだろう。 様々な元素が鋼に及ぼす影響については、H. H. Campbell著「The Manufacture and Properties of Structural Steel」を参照してください。
炭素は鉄の中に3つの状態-グラファイト、溶解、結合で存在します。
燐は鉄の燐化物として存在し、これは溶けた鉄に完全に溶ける。
珪素は鉄の珪化物として存在し、これも溶けた鉄に溶ける。 この4元素のうち、自由状態で存在できるのは炭素だけで、その比率はほぼ無限ですが、次の簡単な表は銑鉄、錬鉄、鋼のおおよその成分を示しています。
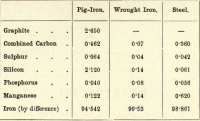
生徒は以下を推定する必要がある:
(1) Carbon,
(a) Total.
(b) Graphitic.
(c) Combined.
(2) Sulphur.
(3) Silicon.
(1)は、炭素、(2)グラファイト、(3)は硫黄、(4)は珪素を含む。 (時間が許せば)
(4)燐。 (時間が許せば)
CARBON Total
この推定では、炭素はCO2に変換され、苛性カリに吸収される。 このようにして得られたCO2の重量から炭素が計算されます。
一見すると、最も簡単な方法は、鉄または鋼のボーリングを酸素の流れの中で直接点火し、こうしてできたCO2をKHOに吸収させることであるように見えます。 残念ながらこの方法は、これまでのところ、不正確であることが証明されているか、あるいは完全燃焼が得られたとしても、高温やその他の処理の変化に耐えるのに必要な装置が技術的な作業に適していなかったのです(The AnalystのBlountの記事参照)。 ここで紹介した方法は、利便性と迅速性という点では技術的な観点から決して理想的なものではなく、近い将来、より迅速な直接酸化法に取って代わられる可能性があることがわかるだろう。 しかし、この方法は、通常の注意を払えば、正確な結果を得ることができる。 354>
鉄を塩化カリウムと銅の二重塩化物の溶液に溶かし、塩酸で酸性にする。 金属銅は沈殿して再溶解し、鉄は溶解し、炭素は懸濁液中に残される。 354>
鉄の溶解-銑鉄のボーリング1gを秤量する。 300ccのビーカーに移す。 100 c.c.s.を加えます。 CuCl2,2KCl,2H2O溶液は次のように作る。 149.1部のKClと170.3部の結晶化したCuCl2,2H2Oを水に溶かします。 蒸発させて複塩化物を結晶化させる。 この複塩300gを蒸留水に溶かす。 着火したアスベストでろ過し、ガラス栓付きビンに保存する。 HClを加えて溶液を酸性にします。 鉄が溶けるまで断続的にかき混ぜます。 ビーカーと内容物を溶液の終点に向けて、約60℃の水槽に置きます。次の反応が起こります-Fe + CuCl2 = FeCl2 + Cu と Cu + CuCl2 = 2CuCl. KClは、沈殿した銅の溶解を助けるだけである。 二塩化物を加えてから約 40 分で、溶液はほぼ完全になり、ほとんどの銅が溶けているはずです。 ビーカーの側面を少量の酸性塩化第二剤で洗い流します。 354>
ろ過には、グーチるつぼの原理を応用した白金製の特殊なボートが非常に便利で、このボートを使ってろ過する。 しかし、学生は人工的な吸引力を利用したグーチ・ルーシブルで炭素質物質を濾過し、液体がフィルターを通過した後に炭素質物質を水の噴射で洗浄することもできる。 フィルター上のカーボンを湯で注意深く洗う。 354>
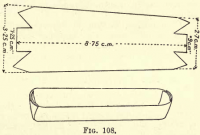
炭素の酸化-図108のように白金箔を切り、側面と端を折り返して谷を作り、白金ボートを用意する。 354>
燃焼炉、付属品、継ぎ手を整え、グーチから炭素質物質とアスベストをボートに移し替える。 酸素精製装置を再び使用するが、今回は三方管を設け、貯蔵庫と精製装置の間にタップを挿入する。 これによって、空気の流れが装置内に取り込まれる。 燃焼管は、硬質イエナガラス、磁器、プラチナなどが用いられる。 炉とポタッシュバルブの間には2本のU字管を使用する。 炉に近い方の管には無水硫酸銅を、もう一方の管には無水塩化銅を入れる。 2本目のU字管には乾燥したCaCl2が入っている。 この2本の管で「精製列車」を構成する。 CuClはあらゆるClを吸収し、他の物質はあらゆるH2Oを吸収する。 このセットは、多くの測定に役立つだろう。 ポタッシュバルブとガードチューブがこれに続き、必要なときに装置内に空気を流すためのアスピレーターが手元にあるとよい。 ポタッシュバルブには、8E.を充填する。 KHOを、ガードチューブにはCaCl2を入れる。 炉と球根のテストは前述(石炭とコークスの項参照)の通り、管は図のようにチャージし、ボートは当面100℃の空気炉に入れておく
すべての準備ができたら、バーナーをしばらく止めてから、ボートと中身を挿入する。 バーナーは前方端から点火され、徐々に後方に作業し、チューブが酸素でいっぱいになるまで、あらかじめ1秒間に約2泡の酸素の緩やかな流れがオンになっている。 ボートが鈍い赤になるまで温度を調整し、電球の溶液は、炉に逆流する兆候を示している場合は、3つまたは4つの気泡/秒に酸素の電流を増加させる
完全燃焼のために約 50 分ボートを入れたときから十分です。 (b)黒鉛質炭素-鉄は、ある者は塩酸で、ある者は硝酸で溶解し、黒鉛質炭素が残渣として残ります。 銑鉄の場合、どちらの方法でも注意すれば良い結果が得られるが、黒鉛を含む鋼鉄の場合、Blairは硝酸での溶解を勧めている。 (この方法はBlairに相談)
5gmsの銑鉄のボーリングを秤量する。 50c.cs.で溶かす。 SE. 穏やかに加熱してHClに溶かす。 数分間沸騰させます。 100c.cs.に希釈します。 (ほぼ). グーチ製ルツボでろ過する。 湯でよく洗い、次に沸騰したE.KHOで洗う。 (このとき、SiO2は溶解される。 (c)差分による複合炭素:全炭素と黒鉛質炭素がわかっている場合、全炭素から黒鉛質炭素を差し引いて複合炭素を求める。
For direct methods of estimation mentioned the authorities.
ESTIMATION OF SULPHUR IN IRON & STEEL
鉄や鋼中の硫黄を推定する最善の方法については、かなり意見の相違があるようである。 しかし、HNO3にゆっくり溶かし、HClはほとんど、あるいは全く存在させず、その後、一定量のHClの存在下でBaCl2により注意深く沈殿させ、沈殿の時間と条件に十分注意し、沈殿物の鉄による汚染に注意すれば、良い結果を得ることができる。 一方ブレアは,SをHClに溶解してH2Sとし,これをPb(NO3)2の溶液(アルカリ性)に吸収させてPbSとし,これをHCl+KClO3に溶解してSをBaSO4として沈殿させることを推奨している。 その他の方法については、Blair, Stillman, Auchy, Crobaugh, and Drownを参照のこと。 もう一つの一般的な方法は、硫黄をH2Sとして発生させ、塩化カドミウム溶液に吸収させる方法である。 沈殿した硫化カドミウムを塩酸に溶かし、ヨウ素溶液で滴定して硫黄を推定する方法や、H2Sを塩水で吸収し、BaSO4として沈殿させる方法やNaOHで吸収し、ヨウ素で滴定する方法などがあり、後者が好まれている方法である。 (Blair参照)ここでは次の方法を示す。
硝酸による酸化(いわゆるアクア・レジア法)-5 gmsのホウ素を計量して200 ccの深ビーカーに移す。 約40 c.c.s.を注意深く加えます。 16E. 16E. HNO3 を一度に約 10 c.cs のロットで、ビーカーを大きな時計ガラスで覆い、作用があまり激しくならないように注意しながら、慎重に加える。 作用が停止したように見えたら,すべての粒子(カーボンを除く)が溶解しているかどうか観察する。 溶解していなければ,砂浴で加熱し,16E.を3,4滴加える。
溶液が完全になったら、少量のNa2CO3を加えて、H2SO4を蒸発時に不揮発性であるNa2SO4に変換します。 SiO2を濾過し、C.よく洗浄する。 蒸発乾固して、SiO2 を不溶化する。 HCl を加え、Fe2Cl6 が結晶化し始めるまで蒸発させる。 その後、5 c.cs. を加え、残渣があれば濾過する。 (残渣がなければ,SiO2 は溶液中に存在しないので,蒸発は省略できる。) 析出物をろ過し、グーチで丁寧に洗い、液と洗い物を100c.cs程度にする
沸騰するまで加熱する。 BaCl2飽和溶液10 c.csを加える。 30分ほど煮沸する。 一晩静置します。 グーチでろ過します。 少量のE.HCl.と水で洗浄します。 乾燥させ、点火し、通常通りBaSO4を秤量する。これは白色で、鉄塩に汚染されていないものでなければならない。 使用する試薬の中には硫黄を含むものがあるので、実際の分析と同じ量を用いて空試験を行い、見つかった硫黄は前の結果から差し引かなければならない。 鉄を硝酸に溶かし、次いで硫酸を加え、蒸発乾固させる。
詳細-2gmsのホウ素を秤量し、白金または磁器の皿に移す。 30c.cs.を加えます。 8E. HNO3 明らかに作用が停止したら、20c.cs.を加える。 18E. H2SO4 を加え、蒸発させる。 (ブレアのお勧めは、液面に優しく熱風を当てることである。 ブンゼンで熱した小さな銅パイプの螺旋の中に空気を通すことによって熱するのである。 こうして蒸発を早め、渦巻きを防ぐのである) SO3 の煙が大量に出るまで蒸発を続ける。 冷却後、蒸留水で130 c.cs.まで慎重に希釈する。 FeSO4がすべて溶けるまで加熱する。 濾過し、まず少量の塩酸で、次に温水で洗浄する。 このろ過は,7 cm の無灰ろ紙で行うとよい(2~3枚のろ紙に点火して,灰分を確認する)。 乾燥後,白金るつぼに移し,常法により点火し,重量を測定する。 このるつぼに,5 c.cs. の強酸化水素と 5 c.cs. の強アルカリ性フッ化水素を加える。 蒸発を早めるために熱風を吹きつけながら,注意深く蒸発させて乾燥させる。 着火し,再び重量を測定する。 H2SO4 と HF が純物質であれば,重量の差は SiO2 である。 H2SO4 と HF(特に後者)はブランクを蒸発させて確認する。 354>
ESTIMATION OF PHOSPHORUS
ここでも、さまざまな権威によって多くの方法が示されているが、その大部分は慎重に実行すれば正確な結果をもたらすものである。 技術的な分析に最も適した方法は、米国の国際鉄鋼規格委員会の小委員会(Messrs Barba, Blair, Drown, Dudley, and Shimer)が作成した体積還元法と、Messrs Dudley and Pease, Jour.が示した修正還元法の2つである。 Anal. Appl. Chem., vii. 108. 354>
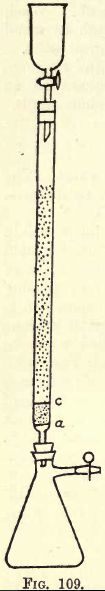
鉄を溶解し、Pをアンモニウムのリンモリブデン酸塩として沈殿させる。 これを溶解し、ZnとH2SO4の作用でMoO3を還元し、還元液をK2Mn2O8(標準液)で滴定し、使用したcc数からPの含有量を算出することができる。 -多くの作業を行う場合は、振盪装置が必要である(化学品カタログ参照)。 しかし、学生は必要な振とうを手で行うことができる。 分析に進む前に、還元装置(Jones reductorの改良版)を用意しなければならない(図109参照)。
aには、丈夫なプラチナ箔の細かい穴のあいた円盤がある。 aとcの間には約3/4インチのきれいな白い砂があり、cはもう一つの穴のあいた白金の円板です。
この円板の上に、細かい粒状のアマルガム亜鉛で管を満たします。 5グラムの水銀を25ccの強硝酸に溶かし、水で希釈して1リットルの溶液にします。 この溶液に、20号ふるいにかけても30号ふるいにかけない粒状亜鉛を半キロ注ぐ。 1~2分間振盪する。 溶液を注ぎます。 亜鉛を洗い、乾燥させ、アマルガム化する。 354>
以下の試薬を準備する。 12 gms. 純 K2Mn2O8 を 1 リットルの水に溶かす。 354>
(b) モリブデン酸塩溶液 50gms.を溶かす。 MoO3を200 c.cs, NH4HO (S.G. .96)に溶かす。 濾過し、濾液に500 c.cs.を加える。 HNO3 (S.G. 1.2)を加える。 354>
(c) 酸性硫酸アンモニウム溶液 500c.cs.の蒸留水に27.5c.cs.の硫酸アンモニウムを添加する。 354>
(d) 標準K2Mn2O8溶液-結晶化したK2Mn2O8 2gmsを蒸留水1000c.csに溶解させる。 この溶液を次のように標準化する。 鉄の含有量が既知である十分に洗浄した鉄線を、1~3 gm ずつ 3 ロット秤量する。 100 c.c. 三角フラスコに移し,それぞれに40 c.cs. 8E. H2SO4 を加える。 溶解したら5分間煮沸し、150 c.c.s.に希釈した後、リダクターに通して洗浄し、分析指示通りの200 c.c.s.まで液量を増加させる。 各ロットを K2Mn2O8 で滴定する。 その結果、金属鉄は1/100ミリグラムまで一致するはずである。 採取した線材に含まれる不純物について、必要な手当をする。 1 c.c. K2Mn2O8 = .0034923 gm, Feとすると、このFeの値にFeに対するMoO3の比率、すなわち.9076を掛け、MoO3に対するP
の比率、すなわち.019で積算すると、
1 c.c. K2Mn2O8 = .0000602 gm. P
分析
1gmのボーリングを秤量する。 200ccの三角フラスコに移す。 70 c.c.s.を加える。 5E. HNO3.を加えます。 溶液が完全になったら、1分間煮沸し、K2Mn2O8の「酸化」溶液10 c.cs.を添加する。 ピンク色が消え、MnO2 が分離するまで沸騰させる。 これを取り出し、純粋な(リンを含まない)FeSO4 の結晶を攪拌しながら徐々に加え、中身が透明になるまで攪拌する。 溶液を 80℃に加熱する(As がある場合は 35℃に加熱する)。 27℃の温度でモリブデン酸溶液75ccを加え、ゴム栓でフラスコを閉じ、5分間振盪する。 5分間静置する。 354>
ペーパー上の沈殿物を5 c.cs.で溶かし、硫化アンモニウムで色がなくなるまで硫酸酸性アンモニウム溶液で洗浄する。 この溶液を元のフラスコに戻し、フラスコの側面に付着している沈殿物を溶かします。 濾液と洗浄液が150 c.cs.になるまで洗浄する。 10 c.csの強酸化水素(S.G.1.84)を加え、200 c.csに希釈する。 354>
暖かいE/2 H2SO4を100 c.cs.漏斗に注ぎます。 フラスコをフィルターポンプに接続し、クランプを開いて、溶液が漏斗からほとんど、しかし完全に流出しないようにする。 次に、漏斗に次のブランク-5 c.cs.を加える。 NH4HO (S.G. 0.90)、10 c.cs.。 H2SO4 (S.G. 1.84), および水 50 c.cs. を混ぜ合わせる。 再び留め金を開けて,この混合物を漏斗からほとんど流れ出させるようにする。 次に200 c.cs, E/2 H2SO4を漏斗に加え、ほぼ流出させます。
フラスコを外し、まず漏斗の栓の油を閉じます。 フラスコの中身をK2Mn2O8で滴定します。 一般に0.1cc程度の過マンガン酸が消費されるので、この量は今後の測定値から差し引かなければなりません。 清潔なフラスコを取り付けます。 フィルターポンプを接続し、始動させます。 ストップコックとクランプを開けて、溶液をほぼ流しきるようにします。 溶液の入ったフラスコを100c.cs.で洗い出す。 E/2 H2SO4 を加える。 これを漏斗に加え、前と同様に処理します。
最後に、さらに100ccの酸を加えてほぼ流し切ります。
これで、フィルターフラスコ内の還元溶液は明るい緑色になります。
前と同様に取り出し、過マンガン酸溶液で滴定をします。 緑色はピンク褐色、ピンク黄色、無色と変化し、最後に永久的なピンク色が得られます(1分間静置後)。 得られた測定値からブランクの測定値を差し引き、上に示したデータから存在するPの割合を計算する
この容量法の代わりに、黄色のモリブデン酸リン酸塩沈殿物を直接量ることを好む化学者もいる。 詳しくはBlair’s Analysis of Iron, p.108を参照。 この時期には、そのような資料を参照し、比較し、ある程度は判断して使用できるようになっていなければならない。 鉄と鋼」、あるいはこのセクションで扱われるどのテーマについても、1冊の教科書ですべてを網羅することはできない。したがって、技術的な仕事に秀でようとする分析者は、最新の文献とともに、与えられた参考文献を注意深く熟読しなければならない。 マンガンはピーターの比色法か酢酸法(Blairなどを参照)で同様に測定することができる
。