枝が出てくる細胞は分生子脚細胞で、元の壁の内側に褐色の色素を持つ二次壁の肥厚があって他の生細胞と区別される。 茎は先端方向に伸び、長さ約100µmになると先端が膨らみ、直径約10µmの子のう膜小胞を形成する。 その後、小胞体から1段の多数の一次性子嚢が芽生え、その露出した先端から二次性子嚢であるフィアライドが芽生える。 665>
古典的な遺伝学的解析では、突然変異体の分離と解析によって、アスペルギルス分生に関する基本的な遺伝的概要が確立された。 分生子に影響を与える遺伝子座の変異頻度を他の機能のものと比較することにより、300から1000の遺伝子座が分生子に関係していると推定された(Martinelli & Clutterbuck, 1971)。 mRNAの種を分析したところ、約6,000が植物性菌糸で発現し、さらに1,200が分生子と分生子を含む培養物で発現していることがわかった。 分生子を持たないA. nidulansの突然変異体のうち、分生子の成長と発達に関係する段階で欠陥があったのはわずか2%で、分生子突然変異体の85%は、植物性菌糸の成長と能力獲得においても欠陥があった。
特に2つの遺伝子が分生子の形態形成に重要な役割を果たしている。これらは小胞とメチュラの形成に欠陥のある「ブリッスル」(brlA)遺伝子と、分生子がハイファのビーズの長さに置換される「そろばん」(abaA)であり、したがってフィアライドからの分生子の出芽と最後の分生に欠陥があると推定される。 第3の遺伝子wetAは、胞子成熟の初期段階での欠陥がある。 wetA変異体の子嚢は色素と疎水性を欠き、数時間後に自己融解し、様々な胞子特異的mRNAを発現しない。 wetA遺伝子の転写物はbrlAとabaA変異体で欠失し(すなわちbrlAとabaAはwetAに対してエピスタティックである)、二重変異体の研究からこれら3つの遺伝子はbrlA → abaA → wetAという順序で作用することが示された
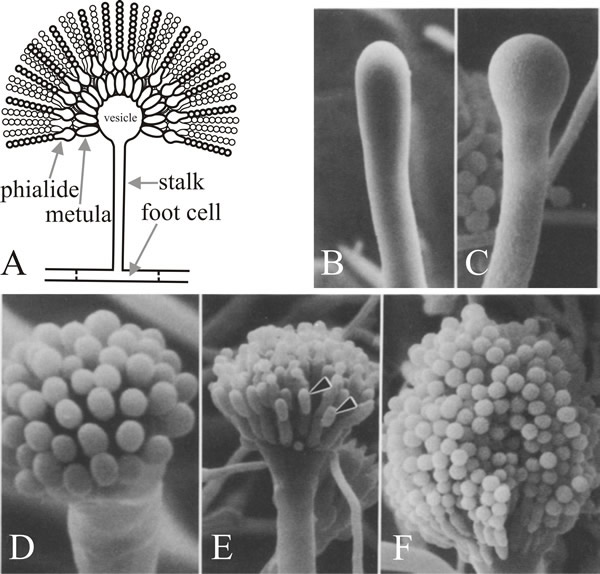
A. nidulansの子嚢形成の突然変異解析の顕著な特徴は、これら3つの遺伝子のみの突然変異体が子嚢および胞子の形態形成に異常を起こすのに対し、他の最大1000の遺伝子座が変異すると子嚢形成をしなくなることである。 このことは、brlA, abaA, wetAが分生子形成に必要な他の遺伝子の発現を統合する調節因子であり、それ自体は分生子形成に特化していないことを意味している。 麹菌の分生子形成変異体の多くは有性生殖にも欠損を示すことから、もう一つの結論として、異なる発生過程における形態形成遺伝子の使い分けがある程度経済的に行われていると考えられる。 おそらく、異なる発生様式では、発生に特化した構造遺伝子ではなく、多くの経路で機能し、反応する制御因子によって発生特異性を付与された構造遺伝子が使われるのでしょう。 このことは、真核生物の発生の鍵は、比較的少数の制御遺伝子を用いて、他の多くの遺伝子の活動を統合する能力にあるという考え方に象徴されている
分子解析は、brlA、abaAおよびwetAが制御因子であるという解釈を支持している。brlA配列はジンクフィンガー蛋白質をコードし、配列特異的DNA結合転写活性化剤として発生制御標的遺伝子(図8)に対して働いている。 しかし、それだけではない。brlA産物は、標的遺伝子によって親和性が異なるからである。 実際、brlA遺伝子座は重複する転写単位からなり(図9)、下流の単位はbrlAα、上流の単位はbrlAβと呼ばれている。これらの間で、それらの産物は、シグナルにどう応答するか、シグナルが消滅したときにその応答をどう維持するか、という発生上の2つの古典的問題を解決している
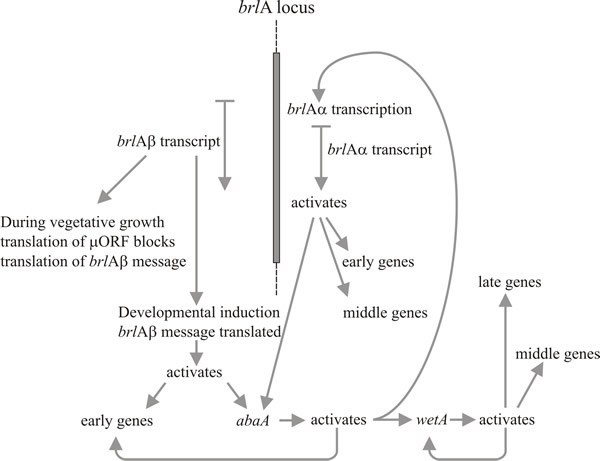
図8. Aspergillus nidulansの分生子形成の遺伝子制御回路の概要。
2つのbrlA転写単位はその長さの大部分で同じ読み枠を共有しているが、brlAβはその読み枠のアミノ末端にさらに23アミノ酸残基を持っており、その転写物はまたその5´末端付近に41アミノ酸残基の別の読み枠(μORFと呼ぶ)を持っている。 μORF産物は下流(BrlA)のリーディングフレームからの翻訳を抑制し、植生菌糸でBrlA転写物が検出されても、BrlAペプチドは生成されない。 µORFによる抑制は、菌糸体がコンピテントな状態になったときにのみ克服される。これは、おそらく窒素制限(子嚢菌の胞子形成開始に共通の環境シグナル)がシグナルとなり、アミノアシルtRNAプールが減少してµORFによる翻訳制御に乱れが生じるためと考えられる。 µORFの作用が停止すると、既存の転写物からBrlAペプチドを翻訳することができる。
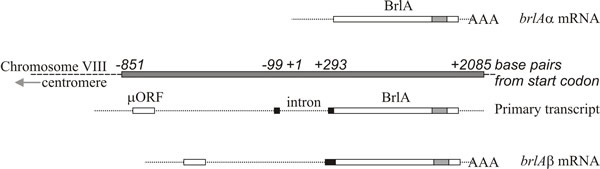
このプロセスの発見者は、分生子経路の活性化を「翻訳トリガー」(Timberlake, 1993)と表現し、翻訳トリガーが菌糸の栄養状態に敏感に分化させる方法であることを示唆している。 つまり、有能な菌糸は分生子形成の準備をするが、分生子形成経路の不可逆的な活性化は、胞子形成条件が理想的になるまで植物的成長を維持する翻訳抑制によって阻止されるのである。
したがって、brlAの活性化は分生子発生の最初のステップと見なされ、その産物は次に調節因子であるabaAを含む分生子特異的遺伝子のパネルを活性化させる。 abaA産物はDNA結合性の転写調節タンパク質でもあり、brlAによって誘導された構造遺伝子の発現を増強する。 abaAはbrlAも活性化するので、brlA遺伝子とabaA遺伝子は相互活性化因子である。 もちろん、abaAが発現する前にbrlAの発現が必要であるが、結果としてabaAがbrlAを活性化することで、後者の発現が強化され、事実上、外部事象に依存しない経路の進行が可能となるのである。 abaA産物はさらに構造遺伝子を活性化し、最後の制御遺伝子であるwetAが胞子特異的な構造遺伝子を活性化する。 brlAとabaAは分化中の分生子では発現しないので、wetAはおそらく胞子におけるこれらの発現の不活性化に関与している(おそらくフィアライドにおいても。現在の胞子核がwetA制御遺伝子を必要とする成熟段階に達すると、フィアライド核は次の胞子の形成を始めるために分生子開始状態に「戻される」ことが必要である)。 wetAの発現は、まずフィアライド内でbrlAとabaAの順次作用により活性化され、その後、自動調節される(wetA産物がwetA転写を活性化する)。
Timberlake(1993)はこの機構をフィードバック固定と呼んだ。核となる制御配列の相互活性化、フィードバック活性化、自動調節は経路全体の発現を強化し、それを開始した外部環境の合図から独立させ、フィアライドからの分離後でも胞子が成熟を続けることを可能にする。 子嚢形成は、他の多くの形態形成過程と同様に、当然ながら連続したステップに分けられる。 この制御ネットワークは、形態形成の経路が、一方では能力の発達に、他方では環境的な手がかりに応答して開始されることに、翻訳トリガーがいかに関連づけられるかを示している。
このセクションでは、分生子の表現型が変化した多数の突然変異の分離に始まり、遺伝子分離と遺伝子相補性の「古典的」研究を続けた50年ほど前の研究に基づいて説明することを意図的に選びました(Martinelli & Clutterbuck, 1971)。 胞子形成に関する我々の理解がどのように達成されたかを示すだけでなく、このような現象を調査するためにこれらの「昔ながらの」技術を用いることの価値を示している。
しかしながら、アスペルギルスの成長および発生の基盤となる分子機構について完了した大規模な研究を無視することはできない。 これらの研究により、胞子形成のキーイベントがbrlAがコードするジンクフィンガー転写因子の活性化であること、abaAとwetA遺伝子が分生子形成に必要な調節因子であることが確認された。 abaAがコードする転写因子は、子のう膜の分化後、分生子形成の中期にbrlAによって活性化され、wetA遺伝子は、abaAによって活性化され、分生子形成の後期に重要な細胞壁成分の合成や成熟子実体の代謝を指令する機能を有する。 Aspergillus nidulansでは、これら3つの遺伝子が中央制御経路を形成し、他の遺伝子とともに、分生子特異的な遺伝子発現と、発生能力の獲得、分生子形成、胞子成熟に関わる遺伝子活性化の順序を制御する(Lee et al.、2016)
これらの発生経路の多くの側面が、他の麹菌にも保存されていた。 アスペルギルス属のメンバーは、最もよく遭遇する真菌の一つであり、すべて分生子の長い鎖を形成することで無性生殖を行う。 Aspergillus oryzae や Aspergillus niger などのいくつかの種は、産業界で酵素生産と食品加工に用いられている。一方、Aspergillus flavus は、最も強力な自然発がん物質であるアフラトキシンを生産して、食品の腐敗に関与している。 アスペルギルス・フミガータスは、疎水性の小さな分生子を大量に生産して飛散し、先進国では空気感染する真菌病原体として広く知られるようになった。 A. fumigatusは、免疫不全の患者において、高い死亡率を有する侵襲性アスペルギルス症を引き起こす。 これらのアスペルギルス種の分生子形成には,BrlA-AbaA-WetA発生シグナル経路が保存されている(Yu, 2010; Tao & Yu, 2011; Krijgsheld et al, 2013)。 さらに、プロテオミクス、トランスクリプトミクス、メタボロミクス研究により、アスペルギルス分生子の形成、成熟、休眠、発芽の間に何千もの遺伝子、転写物、酵素、代謝反応に生じるダイナミックな変化の詳細が明らかになっている(van Leeuwen et al, 2013; Novodvorska et al, 2016; Teertstra et al, 2017)。
2019年7月更新