Ionization Energies of s- and p-Block Elements
周期表第3列の元素のイオン化エネルギーは、㈳Liや㈳Beと同じパターンを示す(表㈳PageIndex{2})。 価電子軌道(この場合は3sまたは3p)から電子を取り除くとイオン化エネルギーは着実に増加し、その後、表中の太い斜線で示すように、充填内殻準位から電子を取り除くとイオン化エネルギーが特に大きく増加するのです。 つまり、前の希ガスの価電子配置を持つイオンから電子を取り除くと、周期表の3行目で最もイオン化エネルギーが増加するのです。 このように、元素の化学反応には価電子が関与しているのが普通である。
| Element | (I_1) | (I_2) | (I_3) | (I_4) | (I_5) | (I_6) | (I_7) | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| *Inner-…殻電子 | |||||||||||||
| Na | 495.8 | 4562.4* | – | – | – | ||||||||
| Mg | 737.7 | 1450.7 | 7732.7 | – | |||||||||
| Al | 577.4.4 | 1816.7 | 2744.7> | – | – | – | – | 11,577.4.4 | – | – | |||
| Si | 786.5 | 1577.1 | 3231.6 | 4355.5 | 16,090.3 | – | – | – | – | – | – | – | – |
| P | 1011.8 | 1907.4.4 | 2914.1 | 4963.6 | 6274.0 | 21,267.4.3 | – | ||||||
| S | 999.6 | 2251.8 | 3357 | 4556.2 | 7004.3 | 8495.8 | 27,107.4.3 | ||||||
| Cl | 1251.2 | 2297.7 | 3822 | 5158.8 | 2000.3 | 2000.3 | 1000.3 | 1000.3 | 1000.36 | 6540 | 9362 | 11,018.2 | |
| Ar | 1520.1 | 11,018.2 | 11,018.2 | 11,018.16 | 2665.9 | 3931 | 5771 | 7238 | 8781.0 | 11,995.3 | |||
Example \(\PageIndex{1}): Highest Fourth Ionization Energy
周期表における位置から、これらの元素で最も第4イオン化エネルギーが高いものを予測しなさい。
Given: three elements
Asked for: element with highest fourth ionization energy
Strategy:
- List the electron configuration of each element.
- Detail are outside a filled or partially filled valence shell.B, C, or N.B. Electron configuration is lost of a individual in which elements, which are you want to do it. 最も高いエネルギーは、充填された電子コアから電子が除去されることに対応することを認識し、どの元素が最も高い第4イオン化エネルギーを持つかを予測する。
解答:
A これらの元素はすべて周期表の2行目にあり、次の電子配置を持っています:
- B:2s22p1
- C:2s22p2
- N:です。 2s22p3
B 元素の第4イオン化エネルギー( \(I_4) )とは、第4電子を取り除くのに必要なエネルギーと定義されます:
炭素、窒素はそれぞれ4個、5個の価電子を持っているので、これらの第4イオン化エネルギーは価電子が一部で満たされ、そこから電子を取り除くことに対応します。 しかし、ホウ素の第4イオン化エネルギーは、満たされた1s2副殻から電子を取り除くことに相当します。 これにはもっと多くのエネルギーが必要なはずです。 実際の値は次の通りです。 B, 25,026 kJ/mol; C, 6223 kJ/mol; N, 7475 kJ/mol.
Exercise \(\PageIndex{1}Getty): Lowest Second Ionization Energy
周期表における位置から、これらの元素のうち最も低い第2イオン化エネルギーを持つものを予測しなさい。 Sr、Rb、Arのうち、どれが一番低いか答えなさい
Answer
Table(\ce{Sr})
Table(\PageIndex{2}) のデータの1列目を見ると、第一イオン化エネルギーは周期表の3行目に渡って増加する傾向があることが分かります。 これは、価電子同士の遮蔽が弱く、有効核電荷が列をまたいでどんどん増えていくためです。 そのため、価電子は原子核に強く引き寄せられ、原子サイズは小さくなり、イオン化エネルギーは大きくなります。 電子と原子核の間の静電的な相互作用が強くなると、電子を取り除くためのエネルギーがさらに大きくなるという、表裏一体の効果があるのです。 周期表の最初の6行の原子番号に対する第一イオン化エネルギーの周期的変化のプロット。 しかし、Al(3s23p1)とS(3s23p4)では、第一イオン化エネルギーが減少しています。 これらの「例外」の電子配置が、その理由を教えてくれる。 アルミニウムの3s2副殻の電子は、互いに核電荷を遮蔽するよりも3p1電子を遮蔽する方が優れているので、s電子はp電子よりも原子核の近くに侵入し、p電子はより容易に除去されるのです。 Sでの減少は、同じp軌道にある2つの電子が互いに反発し合うために起こる。 このため、S原子は16族元素と同様に安定性にやや劣る。
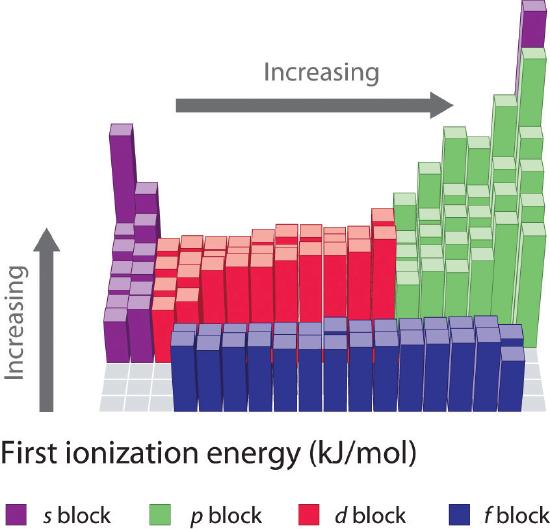
周期表1~6行目の元素の第一イオン化エネルギーをプロットしたのが図(㋑)で、数値とグラフで示したのが図(㋒)である。 これらの図は3つの重要な傾向を示している。
- sおよびpブロックの第2行(Li→Ne)、第4行(K→Kr)、第5行(Rb→Xe)、第6行(Cs→Rn)で見られる変化は周期表の第3行について述べたパターンと類似している。 ただし、遷移金属は4、5、6列目に、ランタノイドは6列目に含まれる。 遷移金属の最初のイオン化エネルギーは、ランタノイドと同様、互いにある程度似ています。 イオン化エネルギーは各列で左から右に増加しますが、ns2np1 (13族)、ns2np4 (16族)、 ns2(n – 1)d10 (12族)で食い違いが生じています。 主量子数nは列が下がるほど大きくなりますが、充填された内殻が価電子を遮蔽する効果があるため、実効核電荷の増加は比較的小さくなります。 その結果、原子は電子を獲得するにつれて大きくなる。 原子核から離れた価電子は結合が弱くなり、取り出しやすくなるため、イオン化エネルギーが低下する。 3370>
- 最初の2つの傾向により、正イオンを作りやすい(イオン化エネルギーが低い)元素は周期表の左下に、イオン化しにくい元素は周期表の右上に位置しています。 3370>

一般に、周期表の左下から右上へ向かって斜めに大きくなる。
ガリウム(Ga)は、遷移金属の1列目に続く元素で、以下の電子配置である。 4s23d104p1。 これは、ガリウムの3d10副殻が4p副殻の内側にあり、4p電子を原子核から遮蔽しているためです。 ガリウムがイオン化されたときに取り除かれる第2、第3電子は、3d10副殻ではなく、4s2軌道にあることが、実験によって明らかにされている。 ガリウムの化学反応は、3d10の電子配置をもつGa3+イオンによって支配されている。 この電子配置と類似の電子配置は特に安定で、より重いp-ブロック元素によく見られます。 擬似希ガス配位と呼ばれることもある。 実際、これらの配位を示す元素では、(n – 1)d10で満たされた副殻から電子を取り除いた化合物は知られていない
。