Nombre genérico: naftifine hydrochloride
Forma de dosificación: cream
Medically reviewed by Drugs.com. Actualizado por última vez el 1 de enero de 2021.
- Descripción general
- Efectos secundarios
- Dosificación
- Profesional
- Embarazo
- Más
Indicaciones y uso de Naftifine crema
La crema de clorhidrato de naftifina está indicada para el tratamiento de la tinea pedis interdigital, tinea cruris y tinea corporis causadas por el organismo Trichophyton rubrum.
Dosis y administración de naftifina en crema
Sólo para uso tópico. La crema de clorhidrato de naftifina no es para uso oftálmico, oral o intravaginal. Aplicar una fina capa de crema de clorhidrato de naftifina una vez al día en las zonas afectadas más un margen de ½ pulgada de piel sana circundante durante 2 semanas.
Formas de dosificación y concentraciones
Cada gramo contiene 20 mg de clorhidrato de naftifina (2%) en una base de color blanco a blanquecino.
Contraindicaciones
Ninguna
Advertencias y precauciones
Reacciones adversas locales
Interrumpir el tratamiento si se produce irritación o sensibilidad con el uso de naftifina hidrocloruro en crema. Indique a los pacientes que se pongan en contacto con su médico si se desarrollan estas condiciones tras el uso de la crema de clorhidrato de naftifina.
Reacciones adversas
Experiencia en ensayos clínicos
Debido a que los ensayos clínicos se realizan en condiciones muy variadas, las tasas de reacciones adversas observadas en los ensayos clínicos de un medicamento no pueden compararse directamente con las tasas de los ensayos clínicos de otro medicamento y pueden no reflejar las tasas observadas en la práctica clínica.
Durante los ensayos clínicos, 903 sujetos fueron expuestos a las formulaciones de crema de naftifina al 1% y al 2%. Un total de 564 sujetos con tinea pedis interdigital, tinea cruris o tinea corporis fueron tratados con crema de clorhidrato de naftifina.
En dos ensayos aleatorizados, controlados con vehículo (400 sujetos fueron tratados con crema de clorhidrato de naftifina). La población tenía entre 12 y 88 años, era principalmente masculina (79%), 48% caucásica, 36% negra o afroamericana, 40% hispana o latina y tenía predominantemente tinea pedis interdigital o tinea cruris. La mayoría de los sujetos recibieron dosis una vez al día, por vía tópica, durante 2 semanas para cubrir las zonas de piel afectadas más un margen de ½ pulgada de piel sana circundante. En los dos ensayos controlados con vehículo, el 17,5% de los sujetos tratados con crema de clorhidrato de naftifina experimentaron una reacción adversa en comparación con el 19,3% de los sujetos con vehículo. La reacción adversa más común (mayor o igual al 1%) es el prurito. La mayoría de las reacciones adversas fueron de gravedad leve. La incidencia de reacciones adversas en la población tratada con crema de clorhidrato de naftifina no fue significativamente diferente que en la población tratada con el vehículo.
En un tercer ensayo aleatorizado, controlado con vehículo, 116 sujetos pediátricos con tinea corporis fueron tratados con crema de clorhidrato de naftifina. La población tenía entre 2 y 18 años de edad (media de 9 años), predominantemente varones (61%), 47% blancos, 51% negros o afroamericanos, 92% hispanos o latinos, e infectados con tinea corporis. La crema de clorhidrato de naftifina se aplicó de forma tópica una vez al día durante 2 semanas en todas las zonas de la superficie corporal afectadas con tinea corporis más un margen de ½ pulgada de piel sana alrededor de las lesiones afectadas. La incidencia de reacciones adversas en la población tratada con crema de clorhidrato de naftifina no fue significativamente diferente que en la población tratada con vehículo.
En dos ensayos pediátricos abiertos de farmacocinética y seguridad, 49 sujetos pediátricos de 2 a menos de 18 años de edad con tinea pedis interdigital, tinea cruris y tinea corporis recibieron crema de clorhidrato de naftifina. La incidencia de reacciones adversas en la población pediátrica fue similar a la observada en la población adulta.
Experiencia postcomercialización
Durante el uso posterior a la aprobación del clorhidrato de naftifina se han identificado las siguientes reacciones adversas: enrojecimiento/irritación, inflamación, maceración, hinchazón, ardor, ampollas, drenaje seroso, formación de costras, dolor de cabeza, mareos, leucopenia, agranulocitosis.
Debido a que estas reacciones se notifican voluntariamente desde una población de tamaño incierto, no siempre es posible estimar de forma fiable su frecuencia o establecer una relación causal con la exposición al medicamento.
USO EN POBLACIONES ESPECÍFICAS
Embarazo
Resumen de riesgos
No se dispone de datos con naftifina clorhidrato crema en mujeres embarazadas para informar sobre el riesgo asociado al fármaco de defectos congénitos mayores y aborto espontáneo. En estudios de reproducción animal, no se observaron efectos adversos sobre el desarrollo embriofetal a dosis orales administradas durante el periodo de organogénesis hasta 18 veces la dosis máxima recomendada en humanos (MRHD) en ratas preñadas o a dosis subcutáneas administradas durante el periodo de organogénesis hasta 2 veces la MRHD en ratas preñadas o 4 veces la MRHD en conejos preñados.
Se desconoce el riesgo de fondo estimado de defectos congénitos mayores y aborto espontáneo para la población indicada. Todos los embarazos tienen un riesgo de fondo de defecto de nacimiento, pérdida u otros resultados adversos. En la población general de Estados Unidos, el riesgo de fondo estimado de defectos congénitos importantes y de aborto espontáneo en embarazos clínicamente reconocidos es del 2% al 4% y del 15% al 20%, respectivamente.
Datos
Datos en animales
Se realizaron estudios de desarrollo embriofetal sistémico en ratas y conejos. Para la comparación de las dosis en animales y en humanos basada en la comparación de la superficie corporal (mg/m2), la MRHD se establece en 8 g de crema al 2% por día (2,67 mg/kg/día para un individuo de 60 kg).
Se administraron dosis orales de 30, 100 y 300 mg/kg/día de clorhidrato de naftifina durante el período de organogénesis a ratas hembras preñadas. No se observaron efectos relacionados con el tratamiento en el desarrollo embriofetal con dosis de hasta 300 mg/kg/día (18 veces la MRHD). Se administraron dosis subcutáneas de 10 y 30 mg/kg/día de clorhidrato de naftifina durante el período de organogénesis a ratas hembras preñadas. No se observaron efectos relacionados con el tratamiento en el desarrollo embriofetal con 30 mg/kg/día (2 veces la MRHD). Se administraron dosis subcutáneas de 3, 10 y 30 mg/kg/día de clorhidrato de naftifina durante el periodo de organogénesis a conejas preñadas. No se observaron efectos relacionados con el tratamiento sobre el desarrollo embriofetal a 30 mg/kg/día (4 veces la MRHD).
Se realizó un estudio de desarrollo peri y postnatal en ratas. Se administraron dosis orales de 30, 100 y 300 mg/kg/día de clorhidrato de naftifina a ratas hembras desde el día 14 de gestación hasta el día 21 de lactancia. Se observó una reducción del aumento de peso corporal de las hembras durante la gestación y de las crías durante la lactancia con 300 mg/kg/día (18 veces la MRHD). No se observó toxicidad para el desarrollo con 100 mg/kg/día (6 veces la MRHD).
Lactación
Resumen de riesgos
No se dispone de información sobre la presencia de naftifina clorhidrato en crema en la leche humana, los efectos del medicamento en el lactante o los efectos del medicamento en la producción de leche. La falta de datos clínicos durante la lactancia impide una determinación clara del riesgo de naftifina clorhidrato en crema para un lactante durante la lactancia; por lo tanto, el desarrollo y los beneficios para la salud de la lactancia deben considerarse junto con la necesidad clínica de la madre de naftifina clorhidrato en crema y cualquier efecto adverso potencial sobre el lactante amamantado de naftifina clorhidrato en crema o de la condición materna subyacente.
Uso pediátrico
Se ha establecido la seguridad y eficacia de naftifina hidrocloruro crema en pacientes pediátricos de 12 años o más con tinea pedis y tinea cruris interdigitales y de 2 años o más con tinea corporis .
El uso de naftifina clorhidrato en crema en estos grupos de edad está respaldado por la evidencia de estudios adecuados y bien controlados en adultos y niños, con datos adicionales de seguridad y PK de dos ensayos abiertos realizados en 49 sujetos pediátricos expuestos a naftifina clorhidrato en crema.
No se ha establecido la seguridad y eficacia de naftifina clorhidrato en crema en el tratamiento de la tinea cruris y la tinea pedis interdigital en pacientes pediátricos menores de 12 años. No se ha establecido la seguridad y eficacia de naftifina clorhidrato crema en el tratamiento de la tinea corporis en pacientes pediátricos menores de 2 años.
Uso geriátrico
Los estudios clínicos de naftifina clorhidrato en crema no incluyeron un número suficiente de sujetos de 65 años o más para determinar si responden de forma diferente a los sujetos más jóvenes.
Descripción de naftifina en crema
Naftifina clorhidrato en crema, USP es una crema de color blanco a blanquecino para uso tópico únicamente. Cada gramo contiene 20 mg de clorhidrato de naftifina, USP, (2%), un compuesto antifúngico sintético de alilamina.
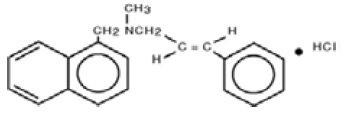
Químicamente, naftifina HCl es (E)-N-Cinamil-N-metil-1-naftalenometilamina clorhidrato.
La fórmula molecular es C21H21N-HCl con un peso molecular de 323,86.
La fórmula estructural del clorhidrato de naftifina, USP es:
La crema de clorhidrato de naftifina, USP contiene los siguientes ingredientes inactivos: alcohol bencílico, alcohol cetílico, cera de ésteres cetílicos, miristato de isopropilo, polisorbato 60, agua purificada, hidróxido de sodio, monoestearato de sorbitán y alcohol estearílico. Puede añadirse ácido clorhídrico para ajustar el pH.
Crema de naftifina – Farmacología clínica
Mecanismo de acción
La crema de clorhidrato de naftifina es un fármaco antifúngico tópico.
Farmacodinámica
No se ha establecido la farmacodinámica de la crema de clorhidrato de naftifina.
Farmacocinética
Los estudios de biodisponibilidad in vitro e in vivo han demostrado que la naftifina penetra en el estrato córneo en una concentración suficiente para inhibir el crecimiento de los dermatofitos.
Se evaluó la farmacocinética de la crema de clorhidrato de naftifina tras su aplicación tópica una vez al día durante 2 semanas a 21 sujetos adultos, tanto hombres como mujeres, con tinea pedis y tinea cruris. La mediana de la cantidad total de crema aplicada fue de 6,4 g (rango de 5,3 g a 7,5 g) al día. Los resultados mostraron que la exposición sistémica (es decir, la concentración máxima (Cmáx) y el área bajo la curva del tiempo 0 a 24 horas (AUC0-24) a la naftifina aumentó a lo largo del período de tratamiento de 2 semanas en los 21 sujetos. La media geométrica (coeficiente de variación o CV%) del AUC0-24 fue de 117 (41,2) ng*hr/mL el día 1, y de 204 (28,5) ng*hr/mL el día 14. La media geométrica (CV %) de la Cmáx fue de 7 ng/mL (55,6) el día 1 y de 11 ng/mL (29,3) el día 14. La mediana del tiempo hasta la Cmáx (Tmáx) fue de 8 horas (rango de 4 a 24 horas) el día 1 y de 6 horas (rango de 0 a 16 horas) el día 14. La acumulación tras 14 días de aplicación tópica fue inferior a dos veces. Las concentraciones mínimas aumentaron en general a lo largo del período de estudio de 14 días. La naftifina siguió detectándose en el plasma en 13/21 (62%) sujetos el día 28, las concentraciones plasmáticas medias (desviación estándar o SD) fueron de 1,6 ± 0,5 ng/mL (rango por debajo del límite de cuantificación (BLQ) a 3 ng/mL). En el mismo ensayo farmacocinético realizado en pacientes con tinea pedis y tinea cruris, la mediana de la fracción de la dosis excretada en la orina durante el período de tratamiento fue del 0,0016% en el día 1 frente al 0,0020% en el día 14.
En un segundo ensayo en el que participaron 22 sujetos, se evaluó la farmacocinética de naftifina clorhidrato en crema en 20 sujetos pediátricos de 13 a menos de 18 años de edad con tinea pedis y tinea cruris. Los sujetos fueron tratados con una dosis media de 8,1 g (rango de 6,6 g a 10,1 g) aplicada en las zonas afectadas una vez al día durante 2 semanas. Los resultados mostraron que la exposición sistémica aumentó durante el periodo de tratamiento. La media geométrica (CV%) del AUC0-24 fue de 138 (50,2) ng*hr/mL el día 1, y de 192 (74,9) ng*hr/mL el día 14. La media geométrica (CV %) de la Cmáx fue de 9,21 ng/mL (48,4) el día 1 y de 12,7 ng/mL (67,2) el día 14. La mediana de la fracción de la dosis excretada en la orina durante el período de tratamiento fue del 0,0030% el día 1 y del 0,0033% el día 14.
Un tercer ensayo evaluó la farmacocinética de la crema de clorhidrato de naftifina en 27 sujetos pediátricos de 2 a menos de 12 años de edad con tinea corporis al menos moderada. Los sujetos se dividieron en grupos más jóvenes (de 2 a menos de 6 años, 17 sujetos) y mayores (de 6 a menos de 12 años, 10 sujetos). Se aplicaron dosis medias de 1,3 g (rango de 1 g a 3,1 g) y 2,3 g (rango de 2,2 g a 4,2 g) una vez al día durante 2 semanas en los grupos de menor y mayor edad, respectivamente, en la zona afectada más un margen de ½ pulgada. Se realizaron evaluaciones farmacocinéticas en plasma y orina el día 1 sólo en el grupo de mayor edad y el día 14 en ambos grupos. Todos los sujetos mostraron niveles medibles de naftifina en plasma tras la aplicación tópica de la crema de clorhidrato de naftifina. Tras una dosis única el Día 1 en los sujetos de 6 a menos de 12 años de edad, los valores medios geométricos (CV%) de la Cmáx y el AUC0-24 fueron de 3,60 (76,6) ng/mL y 49,8 (64,4) ng*h/mL, respectivamente. El día 14 en este grupo, la Cmáx y el AUC0-24 fueron de 3,31 (51,2) ng/mL y 52,4 (49,2) ng*h/mL, respectivamente. En los sujetos de 2 a menos de 6 años de edad el día 14, la Cmáx y el AUC0-24 fueron de 3,98 (186) ng/mL y 54,8 (150) ng*h/mL, respectivamente. En el grupo de sujetos mayores de 6 a 12 años, las exposiciones sistémicas (tanto la Cmáx como el AUC0-24) en los días 1 y 14 fueron comparables. La mediana de la fracción de la dosis excretada en la orina durante las 24 horas siguientes a la aplicación del fármaco el Día 1 y el Día 14 fue del 0,0029% y del 0,0014%, respectivamente.
Microbiología
Aunque se desconoce el mecanismo exacto de acción contra los hongos, el hidrocloruro de naftifina parece interferir en la biosíntesis de esteroles mediante la inhibición de la enzima escualeno2, 3-epoxidasa.Esta inhibición de la actividad enzimática da lugar a una disminución de las cantidades de esteroles, especialmente de ergosterol, y a la correspondiente acumulación de escualeno en las células.
Mecanismo de resistencia
Hasta la fecha, no se ha identificado un mecanismo de resistencia a la naftifina.
La naftifina ha demostrado ser activa frente a la mayoría de los aislados de los siguientes hongos, tanto in vitro como en infecciones clínicas, como se describe en la sección INDICACIONES Y USO:
Trichophyton rubrum
Toxicología no clínica
Carcinogénesis, mutagénesis, alteración de la fertilidad
En un estudio de carcinogenicidad dérmica de 2 años de duración, se administró crema de clorhidrato de naftifina a ratas Sprague-Dawley a dosis tópicas del 1%, 2% y 3% (10, 20 y 30 mg/kg/día de clorhidrato de naftifina). En este estudio no se observaron tumores relacionados con el fármaco hasta la dosis más alta evaluada en este estudio de 30 mg/kg/día (12 veces la MRHD en base a la comparación del AUC).
El clorhidrato de naftifina no reveló ninguna evidencia de potencial mutagénico o clastogénico en base a los resultados de dos pruebas de genotoxicidad in vitro (ensayo de Ames y ensayo de aberración cromosómica en células de ovario de hámster chino) y una prueba de genotoxicidad in vivo (ensayo de micronúcleos en médula ósea de ratón).
La administración oral de clorhidrato de naftifina a ratas, durante el apareamiento, la gestación, el parto y la lactancia, no demostró efectos sobre el crecimiento, la fertilidad o la reproducción, a dosis de hasta 100 mg/kg/día (6 veces la MRHD).
Estudios clínicos
Tinea Cruris
Se ha investigado la seguridad y la eficacia de la crema de hidrocloruro de naftifina en un ensayo multicéntrico aleatorizado, doble ciego y controlado con vehículo en 146 sujetos con tinea cruris sintomática y con cultivos de dermatofitos positivos. Los sujetos fueron aleatorizados para recibir crema de clorhidrato de naftifina o vehículo. Los sujetos se aplicaron crema de clorhidrato de naftifina o vehículo en la zona afectada más un margen de ½ pulgada de piel sana alrededor de la zona afectada una vez al día durante 2 semanas. Se evaluaron los signos y síntomas de la tinea cruris (presencia o ausencia de eritema, prurito y descamación) y se realizó un examen de KOH y un cultivo de dermatofitos en el punto final de eficacia primaria en la semana 4.
La edad media de la población del ensayo fue de 47 años y el 87% eran hombres y el 43% eran blancos. Al inicio del estudio, se confirmó que los sujetos tenían signos y síntomas de tinea cruris, un examen KOH positivo y la presencia confirmada de dermatofitos según los resultados de los cultivos de un laboratorio central de micología. El análisis de la población por intención de tratar consistió en una comparación de las proporciones de sujetos con una curación completa en la visita de la semana 4 (véase la Tabla 1). La curación completa se definió como la curación clínica (ausencia de eritema, prurito y descamación) y la curación micológica (cultivo de KOH y dermatofitos negativos).
El porcentaje de sujetos que experimentaron una curación clínica y el porcentaje de sujetos que experimentaron una curación micológica en la semana 4 se presentan individualmente en la Tabla 1 siguiente.
|
Punto final |
Crema de clorhidrato de naftifina, 2% |
Vehículo |
|
N=75 |
N=71 |
|
|
Curea completa |
19 (25%) |
2 (3%) |
|
Tratamiento eficazb |
45 (60%) |
7 (10%) |
|
Curación micológica |
54 (72%) |
11 (16%) |
|
a. La curación completa es un criterio de valoración compuesto por la curación micológica y la curación clínica. La curación clínica se define como la ausencia de eritema, prurito y descamación (grado 0). |
||
|
b. El tratamiento efectivo es una preparación de KOH negativa y un cultivo de dermatofitos negativo, grados de eritema, descamación y prurito de 0 o 1 (ausente o casi ausente). |
||
|
c. La curación micológica se define como un cultivo de KOH y de dermatofitos negativo. |
||
Tinea pedis interdigital
Se ha investigado la eficacia de la crema de clorhidrato de naftifina en un ensayo multicéntrico aleatorizado, doble ciego y controlado con vehículo en 217 sujetos con tinea pedis interdigital sintomática y con cultivo de dermatofitos positivo. Los sujetos fueron aleatorizados para recibir crema de clorhidrato de naftifina o vehículo. Los sujetos se aplicaron crema de clorhidrato de naftifina o vehículo en la zona afectada del pie más un margen de ½ pulgada de piel sana alrededor de la zona afectada una vez al día durante 2 semanas. Se evaluaron los signos y síntomas de la tinea pedis interdigital (presencia o ausencia de eritema, prurito y descamación) y se realizó un examen de KOH y un cultivo de dermatofitos en el punto final de eficacia primario en la semana 6.
La edad media de la población del ensayo fue de 42 años y el 71% eran hombres y el 57% eran blancos. Al inicio del estudio, se confirmó que los sujetos tenían signos y síntomas de tinea pedis interdigital, examen KOH positivo y cultivo de dermatofitos confirmado. El criterio de valoración primario de la eficacia fue la proporción de sujetos con una curación completa en la visita de la semana 6 (véase la tabla 2). La curación completa se definió como una curación clínica (ausencia de eritema, prurito y descamación) y una curación micológica (examen KOH y cultivo de dermatofitos negativos).
Los resultados de eficacia en la semana 6, cuatro semanas después del final del tratamiento, se presentan en la Tabla 2 siguiente. La crema de clorhidrato de naftifina demostró una curación completa en los sujetos con tinea pedis interdigital, pero no se demostró una curación completa en los sujetos que sólo tenían tinea pedis de tipo mocasín.
|
Punto final |
Crema de clorhidrato de naftifina, 2% |
Vehículo |
|
N=147 |
N=70 |
|
|
Curea completa |
26 (18%) |
5 (7%) |
|
Tratamiento eficazb |
83 (57%) |
14 (20%) |
|
Curación micológica |
99 (67%) |
15 (21%) |
|
a. La curación completa es un criterio de valoración compuesto por la curación micológica y la curación clínica. |
||
|
b. El tratamiento eficaz es una preparación de KOH negativa y un cultivo de dermatofitos negativo, grados de eritema, descamación y prurito de 0 o 1 (ausente o casi ausente). |
||
|
c. La curación micológica se define como un cultivo de KOH y de dermatofitos negativo. |
||
Tinea corporis
Se ha investigado la seguridad y la eficacia de la crema de clorhidrato de naftifina en un ensayo multicéntrico aleatorizado, doble ciego y controlado con vehículo en 184 sujetos con tinea corporis sintomática y con cultivo de dermatofitos positivo. Los sujetos fueron aleatorizados para recibir crema de clorhidrato de naftifina o vehículo. Los sujetos se aplicaron el agente del estudio en todas las áreas de la superficie corporal afectadas con tinea corporis más un margen de ½ pulgada de piel sana alrededor de las lesiones afectadas durante dos semanas. Se evaluaron los signos y síntomas de la tinea corporis (presencia o ausencia de eritema, induración y prurito) y se realizó un examen KOH y un cultivo de dermatofitos para la evaluación del criterio de valoración primario de la eficacia en el día 21.
La población del ensayo era pediátrica (mayor o igual a 2 y menor a 18 años de edad) con una mediana de edad de 9 años (crema de clorhidrato de naftifina) u 8 años (vehículo); el 61% de los sujetos eran varones y el 45% eran blancos. Al inicio del estudio, se confirmó que los sujetos tenían signos y síntomas de tinea corporis, un examen KOH positivo y un cultivo de dermatofitos confirmado. El criterio de valoración primario de la eficacia fue la proporción de sujetos con una curación completa en la visita del día 21. La curación completa se definió como una curación clínica (ausencia de eritema, induración y prurito en todas las lesiones presentes al inicio) y una curación micológica (examen de KOH y cultivo de dermatofitos negativos).
Los resultados de eficacia en el Día 21, una semana después del final del tratamiento, se presentan en la Tabla 3 siguiente.
|
Crema de clorhidrato de naftifina, 2% |
Vehículo |
|
|
Punto final |
N=91 |
N=93 |
|
Curea completa |
42 (46%) |
26 (28%) |
|
Tratamiento eficazb |
53 (58%) |
32 (34%) |
|
Cura micológica |
57 (63%) |
36 (39%) |
|
a. La curación completa es un criterio de valoración compuesto por la curación micológica y la curación clínica. |
||
|
b. El tratamiento efectivo es una preparación de KOH negativa y un cultivo de dermatofitos negativo, grados de eritema, induración y prurito de 0 o 1 (ausente o leve). |
||
|
c. La curación micológica se define como un cultivo de KOH y dermatofitos negativo. |
||
Cómo se suministra/almacenamiento y manipulación
La crema de clorhidrato de naftifina, USP 2%, es una crema de color blanco a blanquecino que se suministra en el siguiente tamaño:
Tubos de 45 gramos – NDC 70700-161-18
Tubos de 60 gramos – NDC 70700-161-17
Almacenar la crema de hidrocloruro de naftifina a 25°C (77°F); se permiten excursiones a 15° a 30°C (59° a 86°F) .
Información para el paciente
- Informe a los pacientes que la crema de clorhidrato de naftifina es sólo para uso tópico. La crema de clorhidrato de naftifina no está indicada para uso oral, intravaginal u oftálmico.
- Si se produce irritación o sensibilidad con el uso de la crema de clorhidrato de naftifina se debe interrumpir el tratamiento e instaurar una terapia adecuada. Se debe indicar a los pacientes que se pongan en contacto con su médico si se desarrollan estas condiciones tras el uso de naftifine hydrochloride cream.
Distribuido por:
Xiromed, LLC,
Florham Park, NJ 07932
Rev. 09/2020
PI-161-00
Etiqueta del envase Sección del panel de visualización principal – Tubo de 45 g

NDC 70700-161-18
Crema de naftifina, 2%
Xiromed, LLC
Sólo para uso tópico
No para uso oftálmico, Uso Oral o Intravaginal
45 g
Sólo para uso tópico
Etiqueta del envase sección del panel de visualización principal – Tubo de 60g

NDC 70700-161-17
Naftifina Crema, 2%
Xiromed, LLC
Sólo para uso tópico
No para uso oftálmico, Uso oral o intravaginal
60 g
Sólo con receta
| Hidrocloruro de NAFTIFINA crema de hidrocloruro de NAFTIFINA |
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
|
||||||||||||||||||||||
Etiquetadora – Xiromed, LLC (080228637)
Registrante – Xiromed Pharma España, S.L. (468835741)
Más información sobre naftifina tópica
- Efectos secundarios
- Durante el embarazo o la lactancia
- Información sobre la dosis
- Precios &Cupones
- En Español
- 7 Reseñas
- Clase de medicamentos: antifúngicos tópicos
Recursos para el consumidor
- Información para el paciente
- Naftifina tópica (lectura avanzada)
Recursos para el profesional
- Información para la prescripción
- Naftifina (Consejo profesional para el paciente)
- Gel de naftifina (FDA)
Otras marcas Naftin
Guías de tratamiento relacionadas
- Tinea Pedis
- Tinea Corporis
- Tinea Cruris
Aviso médico